Khoa học tự nhiên 8 Bài 9: Base, thang pH
A. Lý thuyết KHTN 8 Bài 9: Base, thang pH
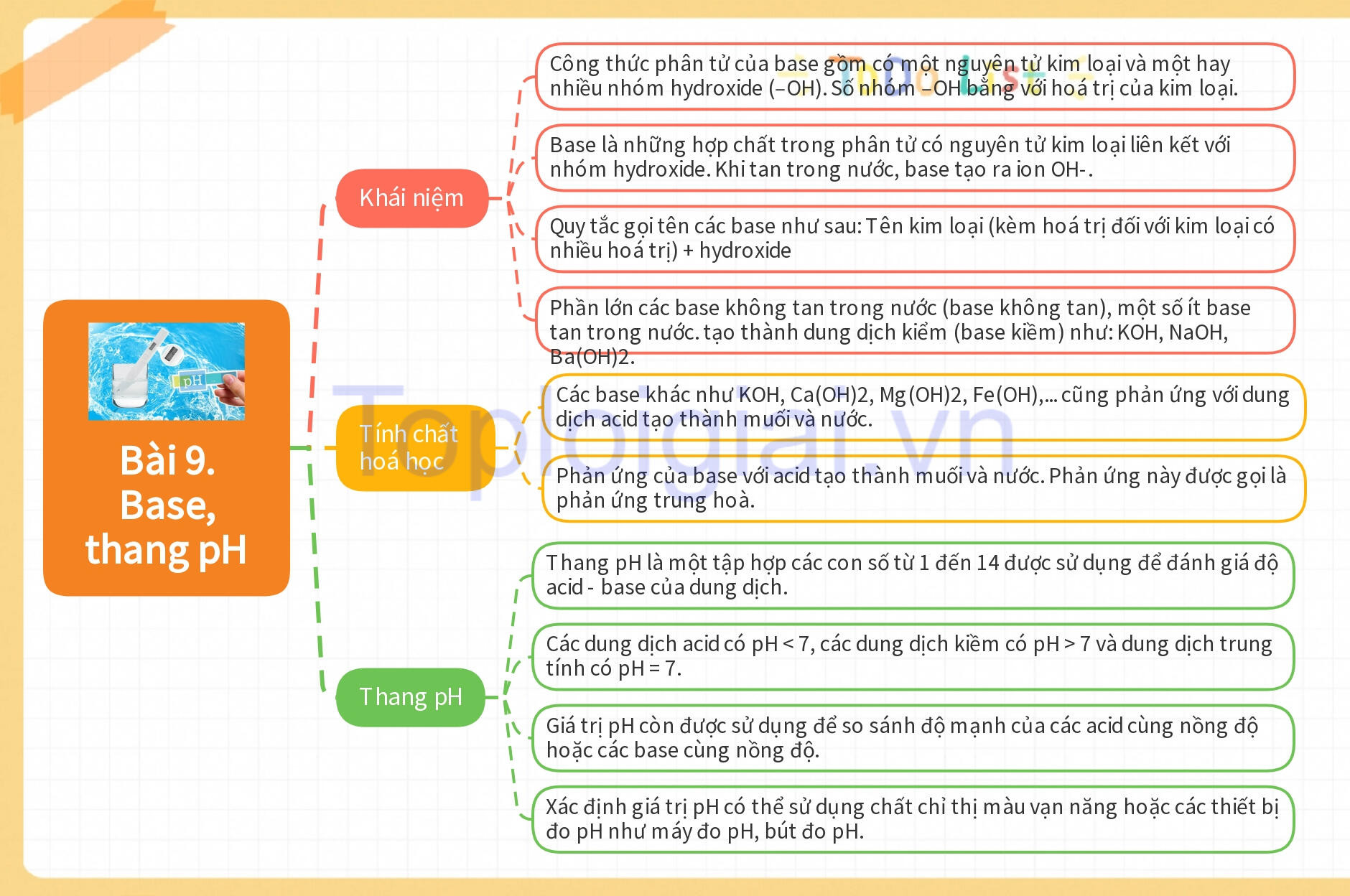
I. Khái niệm
– Tương tự acid, base cũng là một trong những hợp chất phổ biến.
– Công thức phân tử của base gồm có một nguyên tử kim loại và một hay nhiều nhóm hydroxide (–OH). Số nhóm –OH bằng với hoá trị của kim loại.
– Khái niệm về base được phát biểu như sau: Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH-.
– Hầu hết các hydroxide của kim loại là các base. Quy tắc gọi tên các base như sau:
– Tên kim loại (kèm hoá trị đối với kim loại có nhiều hoá trị) + hydroxide
Ví dụ: Fe(OH) : iron(II) hydroxide;
Fe(OH)3: iron(III) hydroxide.
– Phần lớn các base không tan trong nước (base không tan), một số ít base tan trong nước. tạo thành dung dịch kiểm (base kiềm) như: KOH, NaOH, Ba(OH)2.
II. Tính chất hoá học
– Tính chất hoá học của base
+ Chuẩn bị: Dung dịch NaOH loãng, dung dịch HCl loãng, giấy quỳ tím, dung dịch phenolphthalein; ống nghiệm, ống hút nhỏ giọt.
+ Các base khác như KOH, Ca(OH)2, Mg(OH)2, Fe(OH),… cũng phản ứng với dung dịch acid tạo thành muối và nước.
+ Phản ứng của base với acid tạo thành muối và nước. Phản ứng này được gọi là phản ứng trung hoà.
Ví dụ: Ca(OH)2 +H2SO4→ CaSO4 + 2H2O.
III. Thang pH
– Thang pH là một tập hợp các con số từ 1 đến 14 được sử dụng để đánh giá độ acid – base của dung dịch.

– Các dung dịch acid có pH < 7, các dung dịch kiềm có pH > 7 và dung dịch trung tính có pH = 7.
– Giá trị pH còn được sử dụng để so sánh độ mạnh của các acid cùng nồng độ hoặc các base cùng nồng độ.
– Xác định giá trị pH có thể sử dụng chất chỉ thị màu vạn năng hoặc các thiết bị đo pH như máy đo pH, bút đo pH.
Sơ đồ tư duy KHTN 8 Bài 9: Base, thang pH
B. Bài tập trắc nghiệm KHTN 8 Bài 9: Base, thang pH
Đang cập nhật.