Khoa học tự nhiên 8 Bài 3: Mol và tỉ khối chất khí
A. Lý thuyết KHTN 8 Bài 3: Mol và tỉ khối chất khí
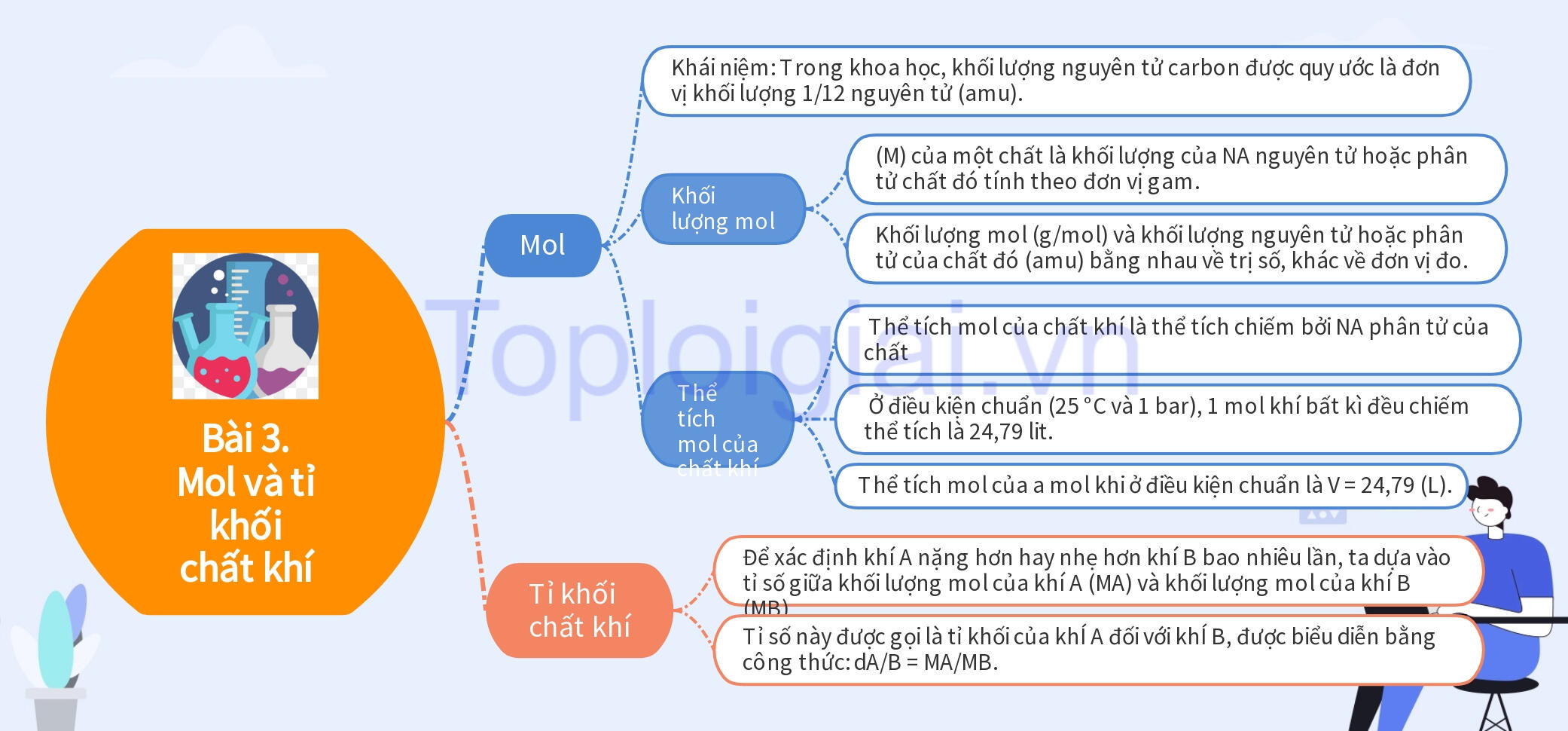
I. Mol
1. Khái niệm
– Khái niệm: Trong khoa học, khối lượng nguyên tử carbon được quy ước là đơn vị khối lượng 1/12 nguyên tử (amu).
– Khối lượng 1 nguyên tử carbon là 12 amu và khối lượng này rất nhỏ.
– Số Avogadro (Ng) là số nguyên tử trong 12 gam carbon và có giá trị là 6,022×10²³.

2. Khối lượng mol
– (M) của một chất là khối lượng của NA nguyên tử hoặc phân tử chất đó tính theo đơn vị gam.
– Khối lượng mol (g/mol) và khối lượng nguyên tử hoặc phân tử của chất đó (amu) bằng nhau về trị số, khác về đơn vị đo.
3. Thể tích mol của chất khí
– Thể tích mol của chất khí là thể tích chiếm bởi NA phân tử của chất khi đó và ở cùng điều kiện nhiệt độ và áp suất, hai bình khí có thể tích bằng nhau có cùng số mol khí.
– Ở điều kiện chuẩn (25 °C và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lit.
– Thể tích mol của a mol khi ở điều kiện chuẩn là V = 24,79 (L).
II. Tỉ khối chất khí
– Để xác định khí A nặng hơn hay nhẹ hơn khí B bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol của khí A (MA) và khối lượng mol của khí B (MB). Tỉ số này được gọi là tỉ khối của khÍ A đối với khÍ B, được biểu diễn bằng công thức: dA/B = MA/MB.
– Để xác định một khi A nặng hơn hay nhẹ hơn không khí bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol của khí A và “khối lượng mol” của không khí:
– Coi không khí gồm 20% oxygen và 80% nitrogen về thể tích. Vậy trong 1 mol không khí có 0,2 mol oxygen và 0,8 mol nitrogen. Khối lượng mol của không khí là: Mkk= 0,2×32 + 0,8×28 = 28.8 (g/mol).
Tỉ khối của khí A so với không khí là: d = m/Mkk.
Sơ đồ tư duy KHTN 8 Bài 3: Mol và tỉ khối chất khí
B. Bài tập trắc nghiệm KHTN 8 Bài 3: Mol và tỉ khối chất khí
Đang cập nhật.
Video bài giảng KHTN 8 Bài 3: Mol và tỉ khối chất khí – Kết nối tri thức