Giáo án Hóa học 10 Chân trời sáng tạo bản word trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 20k cho 1 bài Giáo án lẻ bất kì):
B1: – –
B2:
Xem thử tài liệu tại đây: Link tài liệu
|
Trường THPT …………. Tổ: ………………….. |
Họ và tên giáo viên ………………………….. |
|||
|
BÀI 18: HYDROGEN HALIDE VÀ MỘT SỐ PHẢN ỨNG CỦA ION HALIDE |
||||
|
Tuần: |
Tiết: |
Ngày soạn: |
Thời gian thực hiện: 4 tiết |
|
I. MỤC TIÊU
1. Năng lực chung
– Tự chủ và tự học: Chủ động, tích cực tìm hiểu các đặc điểm vật lí, tính chất hóa học của các hợp chất chứa halogen, cũng như những ứng dụng phổ biến của ion halide trong đời sống.
– Giao tiếp, hợp tác: Sử dụng ngôn ngữ khoa học để diễn đạt về tính chất của hydrogen halide, ion halide, các ứng dụng trong thực tiễn. Hoạt động nhóm và cặp đôi một cách hiệu quả theo yêu cầu của giáo viên, các thành viên trong nhóm đều tham gia và trình bày báo cáo. Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
– Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm, liên hệ thực tiễn nhằm giải quyết các vấn đề trong bài học và cuộc sống.
2. Năng lực hóa học
Nhận thức hóa học:
– Nhận xét (từ bảng dữ liệu về nhiệt độ sôi) và giải thích được xu hướng biến đổi nhiệt độ sôi của các hydrogen halide từ HCl tới HI dựa vào tương tác van der Waals.
– Giải thích được sự bất thường về nhiệt độ sôi của HF so với các HX khác.
– Trình bày được xu hướng biến đổi tính acid của dãy hydrohalic acid.
– Trình bày được tính khử của các ion halide (Cl–, Br–, I–) thông qua phản ứng với chất oxi hoá là sulfuric acid đặc.
Tìm hiểu thế giới tự nhiên dưới góc độ hóa học:
– Thực hiện được thí nghiệm phân biệt các ion F–, Cl–, Br–, I– bằng cách cho dung dịch silver nitrate vào dung dịch muối của chúng.
Vận dụng kiến thức, kĩ năng đã học
– Nêu được ứng dụng của một số hydrogen halide.
3. Phẩm chất
– Cẩn thận, trung thực, trách nhiệm và thao tác an toàn trong quá trình làm thực nghiệm.
– Có niềm say mê, hứng thú với việc khám phá và học tập bộ môn hóa học.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
– Kế hoạch bài dạy, PowerPoint bài giảng (kèm theo máy chiếu).
– Các phiếu học tập, phiếu hướng dẫn hoạt động.
– Giấy A3.
– Dụng cụ và hóa chất (6 bộ/ lớp)
Dụng cụ: ống nghiệm (24 ống nghiệm), ống hút nhỏ giọt (6 ống), giá để ống nghiệm (6 cái).
Hóa chất: Dung dịch AgNO3, NaF, NaCl, NaBr và NaI có cùng nồng độ 0,1M.
2. Học sinh
– Ôn tập bài cũ và chuẩn bị bài mới.
II. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a. Mục tiêu
– Tạo hứng thú và kích thích sự tò mò của học sinh vào chủ đề học tập. Học sinh tiếp nhận kiến thức chủ động, tích cực, hiệu quả. Khơi gợi lại các kiến thức cũ liên quan đến bài học.
b. Nội dung
HS làm việc cá nhân hoàn thành câu hỏi khởi động, từ đó xác định mục tiêu bài học.
|
CÂU HỎI KHỞI ĐỘNG Câu 1: Quan sát hình ảnh và kết hợp với đọc đoạn thông tin sau, hãy trả lời các câu hỏi bên dưới: Thủy tinh vốn cứng, trơn và khá trơ về mặt hóa học nên việc chạm khắc là điều không đơn giản. Trước đây, muốn khắc các hoa văn, cần phủ lên bề mặt thủy tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phần thủy tinh cần khắc lộ ra. Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp CaF2 và H2SO4 đặc lên lớp paraffin đó, phần thủy tinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoa văn trên vật dụng cần trang trí.
Chữ được khắc trên bề mặt tấm thủy tinh a) Có thể dùng hợp chất nào để khắc chữ lên thủy tinh? b) Tại sao có thể thay thế hợp chất trên bằng hỗn hợp CaF2 và H2SO4 đặc? Viết phương trình hóa học để minh họa. Câu 2: Hãy viết 04 phương trình hóa học trong đó có sự tham gia phản ứng của HCl mà em đã được học. |
c. Sản phẩm
|
TRẢ LỜI CÂU HỎI KHỞI ĐỘNG Câu 1: a) Có thể sử dụng hydrofluoric acid để khắc chữ lên thuỷ tinh. b) Hỗn hợp CaF2 và H2SO4 đặc xảy ra phản ứng hóa học để tạo thành HF có khả năng ăn mòn thủy tinh: CaF2 + H2SO4 → CaSO4 + 2HF. Câu 2: 4 phương trình hoá học có sự tham gia của HCl: 2HCl + Fe → FeCl2 + H2 HCl + NaOH → NaCl + H2O 2HCl + Na2CO3 → 2NaCl + CO2 + H2O 2HCl + CaO → CaCl2 + H2O |
d. Tổ chức thực hiện
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Bước 1: Chuyển giao nhiệm vụ học tập Yêu cầu học sinh hoạt động cá nhân, trả lời các câu hỏi trong phiếu “câu hỏi khởi động” trong thời gian 5 phút. Giáo viên có thể kết hợp cho học sinh theo dõi thí nghiệm qua video khắc chữ lên thuỷ tinh. |
Nhận nhiệm vụ, nêu thắc mắc nếu có trước khi thực hiện nhiệm vụ.
|
|
Bước 2: Thực hiện nhiệm vụ Theo dõi các học sinh thực hiện nhiệm vụ, hỗ trợ nếu học sinh gặp khó khăn bằng các gợi ý phù hợp. |
Đọc ngữ liệu, quan sát hình ảnh, kết hợp với kiến thức đã được học trước đây để trả lời các câu hỏi. |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu 02 học sinh trình bày kết quả hoạt động, mỗi học sinh ứng với một câu hỏi trong phiếu. |
Học sinh trình bày sản phẩm của mình. Các học sinh khác theo dõi để nhận xét góp ý. |
|
Bước 4: Kết luận và nhận định Nhận xét và kết luận về độ chính xác của các câu trả lời. Từ đó, giáo viên giới thiệu cho học sinh các hợp chất hydrogen halide và ion halide, dẫn dắt học sinh vào bài để tìm hiểu về các tính chất của chúng. |
Học sinh đưa ra nhận xét góp ý.
Học sinh theo dõi, chỉnh sửa nội dung sản phẩm cá nhân. |
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu về tính chất vật lí của hydrogen halide
a. Mục tiêu
– Nhận xét (từ bảng dữ liệu về nhiệt độ sôi) và giải thích được xu hướng biến đổi nhiệt độ sôi của các hydrogen halide từ HCl tới HI dựa vào tương tác van der Waals.
– Giải thích được sự bất thường về nhiệt độ sôi của HF so với các HX khác.
b. Nội dung
HS làm việc nhóm, hoàn thành phiếu học tập, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 1 Câu 1: Dựa vào bảng số liệu 18.1 và hình ảnh 18.1 – SGK Hoá 10, cho biết nhiệt độ sôi của các hydrogen halide từ HCl đến HI biến đổi như thế nào? Giải thích. Câu 2: Quan sát hình 18.2 – SGK Hoá 10, giải thích nhiệt độ sôi cao bất thường của hydrogen fluoride so với các hydrogen halide còn lại. Câu 3: Cho biết độ tan của hydrogen fluoride trong nước ở 0℃ là vô hạn. Giải thích nguyên nhân dẫn đến tính chất này. |
c. Sản phẩm
|
TRẢ LỜI PHIẾU HỌC TẬP SỐ 1 Câu 1: Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Giải thích: Từ HCl đến HI, khối lượng phân tử tăng làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng. Câu 2: Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals giữa các phân tử. So với HCl, HBr và HI để phá vỡ liên kết giữa các phân tử HF, ngoài năng lượng để phá vỡ tương tác van der Waals, cần thêm năng lượng cao hơn để phá vỡ các liên kết hydrogen, nên nhiệt độ sôi của HF cao bất thường so với các hydrogen halide còn lại. Câu 3: Phân tử HF hình thành được liên kết hydrogen với các phân tử nước nên tan tốt trong nước. |
d. Tổ chức thực hiện
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Bước 1: Chuyển giao nhiệm vụ học tập Chia lớp thành 6 nhóm. Giới thiệu sơ lược về bảng 18.1 trong SGK, nhắc lại cho học sinh nắm cách gọi tên các hydrogen halide. Yêu cầu học sinh thảo luận và trả lời câu hỏi trong phiếu học tập số 1 trong 10 phút. |
Nhận nhiệm vụ, nêu thắc mắc nếu có trước khi thực hiện nhiệm vụ. |
|
Bước 2: Thực hiện nhiệm vụ Quan sát và ghi nhận hoạt động của các nhóm. Hỗ trợ các nhóm học sinh nếu gặp khó khăn trong quá trình tham gia hoạt động bằng các gợi ý phù hợp. |
Thảo luận và ghi câu trả lời vào phiếu học tập. |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu đại diện hai nhóm báo cáo kết quả phiếu học tập số 1. |
Báo cáo sản phẩm thảo luận của nhóm. Nhóm thứ nhất báo cáo câu hỏi số 1, nhóm thứ hai báo cáo câu hỏi số 2 và 3. Các nhóm còn lại theo dõi, thảo luận, nhận xét và góp ý. |
|
Bước 4: Kết luận và nhận định Nhận xét sản phẩm của các nhóm, phân tích các nội dung mà nhóm đã trình bày, thống nhất nội dung cốt lõi (kiến thức trọng tâm) để ghi vào vở. |
Nhận xét sản phẩm của nhóm khác. Theo dõi và ghi nhận nội dung kiến thức trọng tâm. |
|
Kiến thức trọng tâm – Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng. – Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại. |
|
Hoạt động 2: Tìm hiểu về hydrohalic acid
a. Mục tiêu: Trình bày được xu hướng biến đổi tính acid của dãy hydrohalic acid.
b. Nội dung: HS làm việc theo nhóm, hoàn thành phiếu học tập số 2, từ đó lĩnh hội kiến thức.
|
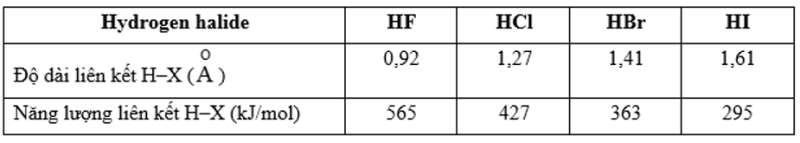
PHIẾU HỌC TẬP SỐ 2 Câu 1: Dựa vào bảng sau, nhận xét mối liên hệ giữa sự biến đổi năng lượng liên kết và độ dài liên kết H–X với sự biến đổi tính acid của các hydrohalic acid.
Câu 2: Hoàn thành phương trình hoá học của các phản ứng sau: NaOH + HCl → Zn + HCl → CaO + HBr → K2CO3 + HI → Câu 3: Em hãy đề xuất cách bảo quản hydrofluoric acid trong phòng thí nghiệm. |
c. Sản phẩm
|
TRẢ LỜI PHIẾU HỌC TẬP SỐ 2 Câu 1: Độ âm điện càng lớn, năng lượng liên kết H–X càng lớn, dẫn đến độ dài liên kết càng nhỏ. Từ fluorine đến iodine, độ âm điện giảm, năng lượng liên kết H–X cũng giảm, dẫn đến độ dài liên kết tăng dần. Trong các hydrohalic acid, độ dài liên kết càng lớn, tính acid càng mạnh. Câu 2: Các phương trình hoá học: NaOH + HCl → NaCl + H2O Zn + 2HCl → ZnCl2 + H2 CaO + 2HBr → CaBr2 + H2O K2CO3 + 2HI → 2KI + H2O + CO2 Câu 3: Vì hydrofluoric aicd có tính ăn mòn thủy tinh nên không sử dụng các lọ thủy tinh để đựng dung dịch hydrofluoric aicd, thay vào đó ta có thể dùng lọ bằng nhựa, tối màu để đựng hydrofluoric aicd. Ngoài ra, cần đậy kín lọ hóa chất, bảo quản ở nơi khô ráo, tránh ánh sáng trực tiếp. |
d. Tổ chức thực hiện
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Bước 1: Chuyển giao nhiệm vụ học tập Chia lớp thành 6 nhóm (như các hoạt động trước). Giới thiệu sơ lược về việc hòa tan các hydrogen halide trong nước thì thu được các dung dịch acid, trong đó HF là acid yếu, còn lại là các acid mạnh có tính chất điển hình của acid. Yêu cầu học sinh thảo luận và trả lời câu hỏi trong phiếu học tập số 2 trong 10 phút. |
Nhận nhiệm vụ, nêu thắc mắc nếu có trước khi thực hiện nhiệm vụ. |
|
Bước 2: Thực hiện nhiệm vụ Quan sát và ghi nhận hoạt động của các nhóm. Hỗ trợ các nhóm học sinh nếu gặp khó khăn trong quá trình tham gia hoạt động bằng các gợi ý phù hợp. Hướng dẫn học sinh thực hiện đúng các bước của kĩ thuật khăn trải bàn. |
Thảo luận và ghi câu trả lời vào phiếu học tập; có thể sử dụng kĩ thuật khăn trải bàn để thảo luận. |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu đại diện hai nhóm báo cáo kết quả phiếu học tập số 2. |
Báo cáo sản phẩm thảo luận của nhóm. Nhóm thứ nhất báo cáo câu 1 và 3, nhóm thứ hai báo cáo câu 2. Các nhóm còn lại theo dõi, thảo luận, nhận xét và góp ý. |
|
Bước 4: Kết luận và nhận định Nhận xét sản phẩm của các nhóm, phân tích các nội dung mà nhóm đã trình bày, thống nhất nội dung cốt lõi (kiến thức trọng tâm) để ghi vào vở. |
Nhận xét sản phẩm của nhóm khác. Theo dõi và ghi nhận nội dung kiến thức trọng tâm. |
|
Kiến thức trọng tâm – Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid. |
|
…………………………………………
…………………………………………
…………………………………………
Tài liệu có 23 trang, trên đây trình bày tóm tắt 8 trang của Giáo án Hóa hoc 10 Chân trời sáng tạo Bài 18: Hydrogen halide và một số phản ứng của ion halide.
Xem thêm các bài giáo án Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Giáo án Bài 14: Tính biến thiên enthalpy của phản ứng hoá học
Giáo án Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Giáo án Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học
Giáo án Bài 17: Tính chất vật lí và tính chất hóa học của nhóm VIIA
Giáo án Bài 18: Hydrogen halide và một số phản ứng của ion halide
Để mua Giáo án Hóa học 10 Chân trời sáng tạo năm 2023 mới nhất, mời Thầy/Cô liên hệ https://tailieugiaovien.com.vn/