Trắc nghiệm Hóa học 10 Bài 4: Ôn tập chương 1
Phần 1: Trắc nghiệm Ôn tập chương 1
Câu 1. Nguyên tử nguyên tố nitrogen có Z = 7. Nitrogen là
A. nguyên tố s.
B. nguyên tố p.
C. nguyên tố d.
D. nguyên tố f.
Đáp án: B
Giải thích:
Cấu hình electron của nguyên tử nitrogen (Z = 7): 1s22s22p3.
Electron cuối cùng điền vào phân lớp p nên nitrogen là nguyên tố p.
Câu 2. Số proton, neutron và electron của ![]() lần lượt là
lần lượt là
A. 11, 11, 12.
B. 11, 12, 11.
C. 12, 12, 11.
D. 12, 11, 11.
Đáp án: B
Giải thích:
Số hiệu nguyên tử Z = 11 = Số proton = Số electron
Số khối A = 23 = Z + N ® N = A – Z = 23 – 11 = 12.
Số proton, neutron và electron của ![]() lần lượt là 11, 12, 11.
lần lượt là 11, 12, 11.
Câu 3. Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng?
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Đáp án: B
Giải thích:
![]() :
:
Số hiệu nguyên tử Z = 19 = Số proton = Số electron.
Cấu hình electron của nguyên tử K: [Ar]4s1 Có 1 electron thuộc lớp ngoài cùng.
![]() :
:
Số hiệu nguyên tử Z = 13 = Số proton = Số electron.
Cấu hình electron của nguyên tử Al: [Ne]3s23p1 Có 3 electron thuộc lớp ngoài cùng.
![]() :
:
Số hiệu nguyên tử Z = 17 = Số proton = Số electron.
Cấu hình electron của nguyên tử Cl: [Ne]3s23p5 Có 7 electron thuộc lớp ngoài cùng.
![]() :
:
Số hiệu nguyên tử Z = 8 = Số proton = Số electron.
Cấu hình electron của nguyên tử O: 1s22s22p4 Có 6 electron thuộc lớp ngoài cùng.
Câu 4. Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p3. Số electron trong nguyên tử X là
A. 11.
B. 12.
C. 15.
D. 14.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử X: 1s22s22p63s23p3.
Nguyên tử X có 15 electron.
Câu 5. Nguyên tố magnesium có Z = 12. Nguyên tử magnesium có
A. 3 lớp electron và có 1 electron thuộc lớp ngoài cùng.
B. 3 lớp electron và có 3 electron thuộc lớp ngoài cùng.
C. 2 lớp electron và có 2 electron thuộc lớp ngoài cùng.
D. 3 lớp electron và có 2 electron thuộc lớp ngoài cùng.
Đáp án: D
Giải thích:
Cấu hình electron của nguyên tử magnesium có Z = 12 là 1s22s22p63s2 hoặc [Ne]3s2 hoặc (2, 8, 2).
Nguyên tử6 magnesium có 3 lớp electron và có 2 electron thuộc lớp ngoài cùng.
Câu 6. Nguyên tử sulfur (Z = 16) có cấu hình electron là
A. [Ne]3s23p4.
B. [Ne]3s23p3.
C. [Ne]3s2.
D. [Ar]4s1.
Đáp án: A
Giải thích:
Nguyên tử sulfur (Z = 16) có cấu hình electron là 1s22s22p63s23p4 hoặc [Ne]3s23p4 hoặc (2, 8, 6).
Câu 7. Nguyên tử X có số hiệu nguyên tử Z = 15. Lớp electron nào trong nguyên tử X có mức năng lượng cao nhất?
A. K.
B. L.
C. M.
D. N.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử X (Z = 15): 1s22s22p63s23p3.
Nguyên tử X có 3 lớp electron Lớp electron thứ ba (n = 3, lớp M) trong nguyên tử X có mức năng lượng cao nhất.
Câu 8. Nguyên tử Y có 3 lớp electron, trong đó lớp ngoài cùng có 4 electron. Cấu hình electron của nguyên tử Y là
A. 1s22s22p63s2.
B. 1s22s22p63s23p1.
C. 1s22s22p63s23p2.
D. 1s22s22p63s23p3.
Đáp án: C
Giải thích:
Nguyên tử Y có 3 lớp electron, trong đó lớp ngoài cùng có 4 electron.
Cấu hình electron của nguyên tử Y là: 1s22s22p63s23p2.
Câu 9. Nguyên oxygen có 8 proton và 8 neutron. Kí hiệu của nguyên tử oxygen là
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Đáp án: D
Giải thích:
Nguyên tử oxygen có:
Số hiệu nguyên tử Z = Số proton = 8
Số khối: A = Z + N = 8 + 8 =16.
Kí hiệu của nguyên tử oxygen là ![]() .
.
Câu 10. Lớp L có số electron tối đa là
A. 6.
B. 8.
C. 12.
D. 18.
Đáp án: B
Giải thích:
Lớp thứ n (n ≤ 4) chứa tối đa 2n2 electron.
Lớp L (n = 2) có số electron tối đa là: 2n2 = 2×22 = 8.
Câu 11. Cấu hình electron của:
Nguyên tử X: 1s22s22p63s23p5.
Nguyên tử Y: 1s22s22p63s23p64s2.
Phát biểu nào sau đây là đúng?
A. X là nguyên tố kim loại, Y là nguyên tố phi kim.
B. X là nguyên tố phi kim, Y là nguyên tố kim loại.
C. X là nguyên tố khí hiếm, Y là nguyên tố kim loại.
D. X là nguyên tố kim loại, Y là nguyên tố khí hiếm.
Đáp án: B
Giải thích:
Nguyên tử X: 1s22s22p63s23p5.
Nguyên tử X có 7 electron thuộc lớp ngoài cùng ® X là nguyên tố phi kim.
Nguyên tử Y: 1s22s22p63s23p64s2.
Nguyên tử Y có 2 electron thuộc lớp ngoài cùng Y là nguyên tố kim loại.
Câu 12. Nguyên tố phosphorus có Z = 15. Ở trạng thái cơ bản, nguyên tử phosphorus có số electron độc thân là
A. 5.
B. 4.
C. 3.
D. 2.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử nguyên tố P (Z = 15): 1s22s22p63s23p3 hoặc [Ne]3s23p3.
Cấu hình electron của nguyên tử P có Z = 15: 1s22s22p63s23p3 có thể được biểu diễn theo ô orbital như sau:
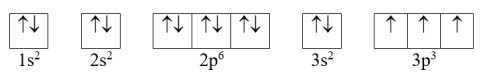
Nguyên tử P có 3 electron độc thân ở trạng thái cơ bản.
Câu 13. Tổng số hạt proton, neutron và electron trong nguyên tử X là 28. Số hạt mang điện nhiều hơn số hạt không mang điện là 8. X là
A. Na.
B. O.
C. F.
D. S.
Đáp án: C
Giải thích:
Nguyên tử X được tạo nên từ hạt proton (p) mang điện tích dương, neutron (n) không mang điện và electron (e) mang điện tích âm.
Trong nguyên tử, số p = số e.
Tổng số hạt proton, neutron và electron trong nguyên tử X là 28.
® 2p + n = 28 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 8.
® 2p – n = 8 (2)
Từ (1) và (2), suy ra: p = 9, n = 10.
Số hiệu nguyên tử Z = số p = 9 ® X là nguyên tố fluorine (kí hiệu F).
Câu 14. Nguyên tố vanadium (V) có 2 đồng vị là ![]() và
và ![]() , trong đó
, trong đó ![]() chiếm 0,25%. Tính nguyên tử khối trung bình của vanadium (V).
chiếm 0,25%. Tính nguyên tử khối trung bình của vanadium (V).
A. 51,2500.
B. 51,9975.
C. 50,9975.
D. 50,2500.
Đáp án: C
Giải thích:
Đồng vị ![]() chiếm: 100% – 0,25% = 99,75% .
chiếm: 100% – 0,25% = 99,75% .
Nguyên tử khối trung bình của vanadium (V) là:
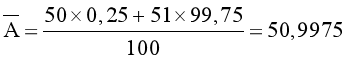
Câu 15. Nguyên tử của nguyên tố X có tổng số hạt cơ bản (proton, electron, neutron) là 34, trong đó số hạt không mang điện bằng 54,545% số hạt mang điện. Số khối của X là
A. 23.
B. 24.
C. 32.
D. 35.
Đáp án: A
Giải thích:
Nguyên tử X được tạo nên từ hạt proton (p) mang điện tích dương, neutron (n) không mang điện và electron (e) mang điện tích âm.
Trong nguyên tử, số p = số e.
Tổng số hạt proton, neutron và electron trong nguyên tử X là 34.
2p + n = 34 (1)
Số hạt không mang điện bằng 54,545% số hạt mang điện.
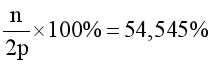 (2)
(2)
Từ (1) và (2), suy ra: p = 11, n = 12.
Số khối của nguyên tử X là: A = Z + N = 11 + 12 = 23.
Phần 2: Lý thuyết Ôn tập chương 1
1. Thành phần của nguyên tử
a) Các hạt cấu tạo nên nguyên tử
Thành phần cấu tạo của nguyên tử gồm:
– Hạt nhân: ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện (trừ trường hợp ).
– Vỏ nguyên tử: chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
Khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử:
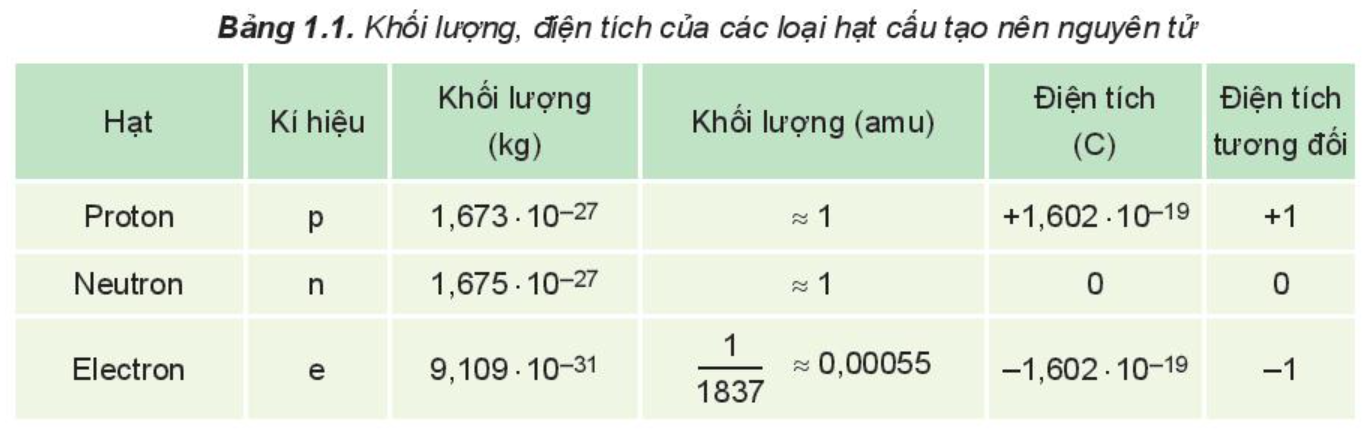
Chú ý: Trong nguyên tử, số proton bằng số electron. Nguyên tử trung hòa về điện.
b) Kích thước và khối lượng nguyên tử
Hạt nhân nguyên tử có kích thước vô cùng nhỏ so với nguyên tử
Khối lượng nguyên tử tập trung ở hạt nhân (do khối lượng của electron rất nhỏ so với khối lượng của proton và neutron).
2. Nguyên tố hóa học
a) Số khối
Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N
b) Kí hiệu nguyên tử
Khi viết kí hiệu nguyên tử, đặt hai chỉ số đặc trưng ở bên trái kí hiệu nguyên tố, trong đó số hiệu nguyên tử Z ở phía dưới và số khối A ở phía trên.
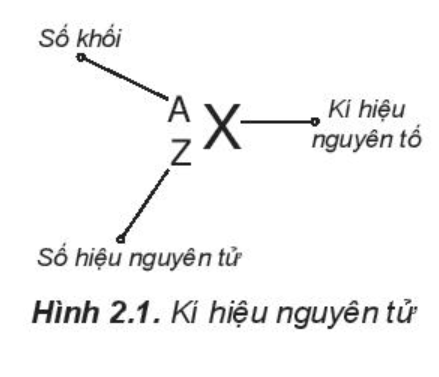
c) Đồng vị
∗ Khái niệm
Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
∗ Nguyên tử khối trung bình
Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu ) của hỗn hợp các đồng vị của nguyên tố đó.
Biểu thức tổng quát tính nguyên tử khối trung bình ():
Trong đó, là nguyên tử khối trung bình; X và Y, … lần lượt là nguyên tử khối của các đồng vị X và Y, …; a và b, … lần lượt là % số nguyên tử của các đồng vị X và Y, …
3. Cấu trúc lớp vỏ electron nguyên tử
a) Hình dạng orbital nguyên tử
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
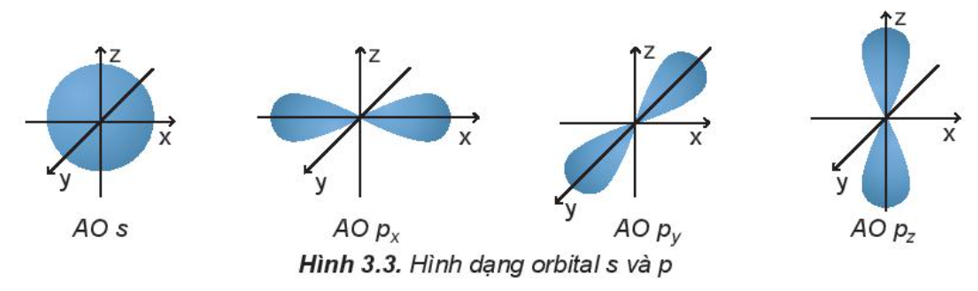
b) Lớp và phân lớp electron
|
n |
1 |
2 |
3 |
4 |
|
Lớp electron |
K |
L |
M |
N |
|
Phân lớp |
1s |
2s, 2p |
3s, 3p, 3d |
4s, 4p, 4d, 4f |
|
Số AO (n2) |
1 |
4 |
9 |
16 |
|
Số electron tối đa (2n2) |
2 |
8 |
18 |
32 |
Chú ý:
Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Trong lớp electron thứ n có n2 AO (n ≤ 4).
4. Cấu hình electron của nguyên tử
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
Quy tắc Hund (Hun): Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
a) Viết cấu hình electron của nguyên tử
Bước 1: Xác định số electron trong nguyên tử.
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng: 1s 2s 2p 3s 3p 4s …
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng.
b) Đặc điểm của lớp electron ngoài cùng
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
|
Đặc điểm của lớp electron ngoài cùng |
||||
|
Số electron |
1, 2, 3 |
4 |
5, 6, 7 |
8 |
|
Loại nguyên tố |
Kim loại |
Kim loại hoặc phi kim |
Phi kim |
Khí hiếm (trừ He) |
Xem thêm các bài trắc nghiệm Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Trắc nghiệm Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Trắc nghiệm Bài 4: Ôn tập chương 1
Trắc nghiệm Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Trắc nghiệm Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì