Giải bài tập Hóa học lớp 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Video giải Hóa học 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm – Kết nối tri thức
Giải hóa học 10 trang 34 Kết nối tri thức
Mở đầu trang 34 Hóa học 10: Trong bảng tuần hoàn, một số tính chất của nguyên tử và đơn chất biến đổi theo xu hướng nào trong một chu kì trong một nhóm A? Vì sao?
Phương pháp giải:
– Trong một chu kỳ
+ đối với nguyên tử: bán kính giảm dần, số electron hóa trị và độ âm điện tăng dần
+ đối với đơn chất: tính kim loại giảm dần, tính phi kim tăng dần
– Trong một nhóm:
+ đối với nguyên tử: bán kính và số lớp electron tăng dần, độ âm điện giảm dần
+ đối với đơn chất: tính kim loại tăng dần và phi kim giảm dần
Lời giải:
– Trong một chu kì, khi đi từ trái sang phải:
+ Bán kính nguyên tử giảm dần, độ âm điện tăng dần.
+ Tính kim loại giảm dần và tính phi kim tăng dần.
+ Số electron hóa trị của nguyên tử các nguyên tố nhóm A tăng lần lượt từ 1 đến 8
– Trong một nhóm A, khi đi từ trên xuống dưới:
+ Bán kính nguyên tử tăng dần, độ âm điện giảm dần
+ Tính kim loại tăng dần và tính phi kim giảm dần.
+ Số lớp electron của nguyên tử các nguyên tố tăng dần
Giải hóa học 10 trang 35 Kết nối tri thức
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
Câu 1 trang 35 Hóa học 10: Dựa vào Bảng 6.1, cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố: Li, Al, Ar, Ca, Si, Se, P, Br
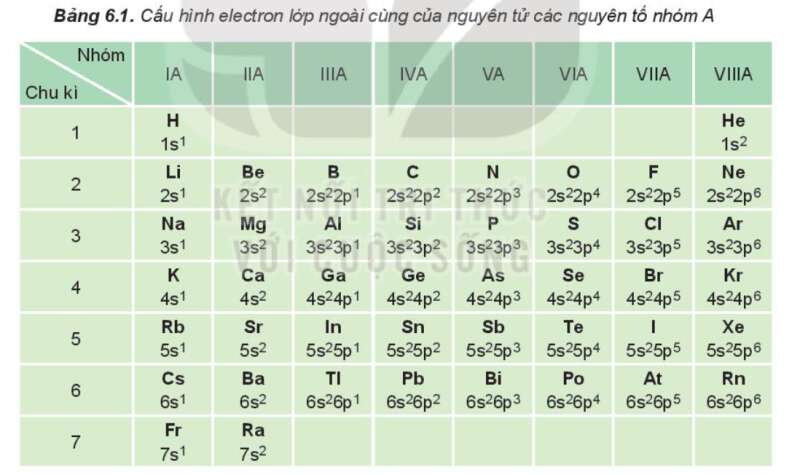
Phương pháp giải:
Nguyên tử của các nguyên tố cùng một nhóm A có số electron lớp ngoài cùng ( electron hóa trị) bằng nhau. => Số thứ tự nhóm bằng số electron lớp ngoài cùng của nguyên tử.
Lời giải:
Trong bảng 6.1, nguyên tố:
+ Li nằm ở nhóm IA => Li có 1 electron lớp ngoài cùng.
+ Al nằm ở nhóm IIIA => Al có 3 electron lớp ngoài cùng.
+ Ar nằm ở nhóm VIIIA => Ar có 8 electron lớp ngoài cùng.
+ Ca nằm ở nhóm IIA => Ca có 2 electron lớp ngoài cùng.
+ Si nằm ở nhóm IVA => Si có 4 electron lớp ngoài cùng.
+ Se nằm ở nhóm VIA => Se có 6 electron lớp ngoài cùng.
+ Br nằm ở nhóm VIIA => Br có 7 electron lớp ngoài cùng.
Câu 2 trang 35 Hóa học 10: Nêu vị trí trong bảng tuần hoàn của các nguyên tố có Z = 8; Z = 17 và Z = 20. Xác định số electron hóa trị của nguyên tử các nguyên tố.
Phương pháp giải:
Z là số hiệu nguyên tử của các nguyên tố. Số hiệu nguyên tử bằng số thứ tự của nguyên tố trong bảng tuần hoàn hóa học.
Lời giải:
Z = 8 => Nguyên tố nằm ở ô số 8, chu kì 2, nhóm VIA => Có 6 electron hóa trị.
Z = 11 => Nguyên tố nằm ở ô số 11, chu kì 3, nhóm IA => Có 1 electron hóa trị.
Z = 17 => Nguyên tố nằm ở ô số 17, chu kì 3, nhóm VIIA => Có 7 electron hóa trị.
Z = 20 => Nguyên tố nằm ở ô số 20, chu kì 4, nhóm IIA => Có 2 electron hóa trị.
Giải hóa học 10 trang 36 Kết nối tri thức
II. Bán kính nguyên tử
Câu 3 trang 36 Hóa học 10: Dựa vào bảng tuần hoàn, hãy so sánh và giải thích sự khác nhau về bán kính nguyên tử của
a) lithium (Z = 3) và potassium (Z = 19).
b) calcium (Z = 20) và selenium ( Z = 34)
Phương pháp giải:
– Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
– Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân
Lời giải:
a) Lithium và potassium nằm cùng một nhóm IA trong bảng tuần hoàn.
=> Bán kính nguyên tử của lithium nhỏ hơn bán kính nguyên tử của potassium.
b) Calcium và selenium nằm cùng một chu kì 4 trong bảng tuần hoàn.
=> Bán kính nguyên tử của calcium lớn hơn bán kính nguyên tử của selenium.
Giải hóa học 10 trang 37 Kết nối tri thức
III. Độ âm điện
Câu 4 trang 37 Hóa học 10: Dãy các nguyên tố được sắp xếp theo thứ tự độ âm điện tăng dần là Ca, Mg, P, S. Hãy giải thích sự sắp xếp này dựa trên sự biến đổi độ âm điện theo chu kì và nhóm A.
Phương pháp giải:
– Độ âm điện tăng từ trái qua phải trong một chu kì.
– Độ âm điện giảm dần từ trên xuống dưới trong một nhóm.
Lời giải:
– Ca (Z =20), Mg (Z = 12), P (Z = 15) và S (Z = 16) cùng nằm ở chu kì 2
– Trong một chu kì, khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng thì lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng nên độ âm điện tăng.
Câu 5 trang 37 Hóa học 10: Almelec là hợp kim của aluminium với một lượng nhỏ magnesium và silicon (98,8% aluminium; 0,7% magnesium và 0,5 % silicon). Almelec được sử dụng làm dây điện cao thế do nhẹ, dẫn điện tốt và bền. Dựa vào bảng tuần hoàn các nguyên tố hóa học, hãy:
a) Sắp xếp theo thứ tự tăng dần về bán kính nguyên tử các nguyên tố hóa học có trong almelec.
b) Cho biết thứ tự giảm dần về độ âm điện của các nguyên tố hóa học có trong almelec.
Phương pháp giải:
– Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
– Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân
– Độ âm điện tăng từ trái qua phải trong một chu kì.
– Độ âm điện giảm dần từ trên xuống dưới trong một nhóm.
Lời giải:
a) Mg (Z = 12 ), Al (Z = 13) và Si (Z = 14) cùng nằm ở chu kì 3 => bán kính nguyên tử tăng dần theo thứ tự: Si, Al, Mg.
b) Mg (Z = 12 ), Al (Z = 13) và Si (Z = 14) cùng nằm ở chu kì 3 => độ âm điện của các nguyên tố theo thứ tự giảm dần: Si, Al, Mg.
Giải hóa học 10 trang 39 Kết nối tri thức
IV. Tính kim loại và tính phi kim
Câu 6 trang 39 Hóa học 10: Dựa vào bảng tuần hoàn các nguyên tố hóa học, sắp xếp các nguyên tố Ba, Mg, Ca, Sr theo thứ tự giảm dần tính kim loại và giải thích.
Phương pháp giải:
Trong một nhóm, tính kim loại tăng theo chiều tăng của điện tích hạt nhân.
Lời giải:
– Trong một nhóm, tính kim loại tăng theo chiều tăng của điện tích hạt nhân.
– Các nguyên tố Ba, Mg, Ca và Sr đều nằm ở nhóm IIA => Các nguyên tố được sắp xếp theo thứ tự giảm dần tính kim loại Ba, Sr, Ca, Mg.
Câu 7 trang 39 Hóa học 10: Trong các nguyên tố O, F, Cl Se, nguyên tố có tính phi kim mạnh nhất là
A. O.
B. F.
C. Se.
D. Cl.
Phương pháp giải:
– Trong một nhóm, tính kim loại tăng và tính phi kim giảm theo chiều tăng của điện tích hạt nhân.
– Trong một chu kì, tính kim loại giảm và tính phi kim tăng theo chiều tăng của điện tích hạt nhân.
Lời giải:
– Nguyên tố O và F nằm cùng một chu kì 2 => tính phi kim theo thứ tự tăng dần O, F
– Nguyên tố O và Se nằm cùng một nhóm => tính phi kim theo thứ tự tăng dần Se, O
– Nguyên tố F và Cl nằm cùng một nhóm => tính phi kim theo thứ tự tăng dần Cl, F
=> Nguyên tố có tính phi kim mạnh nhất trong các nguyên tố O,F, Cl, Se là F
Bài giảng Hóa học 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố – Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Bài 9: Ôn tập chương 2