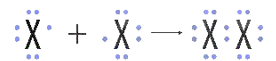Giáo án Hóa học 10 Chân trời sáng tạo bản word trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 20k cho 1 bài Giáo án lẻ bất kì):
B1: – –
B2:
Xem thử tài liệu tại đây: Link tài liệu
|
Trường THPT …………. Tổ: ………………….. |
Họ và tên giáo viên ………………………….. |
|||
|
BÀI 17: TÍNH CHẤT VẬT LÍ VÀ TÍNH CHẤT HÓA HỌC CỦA NHÓM VIIA |
||||
|
Tuần: |
Tiết: |
Ngày soạn: |
Thời gian thực hiện: 5 tiết |
|
I. MỤC TIÊU DẠY HỌC
1. Năng lực chung
– Giao tiếp và hợp tác: Tham gia đóng góp ý kiến trong nhóm, biết lắng nghe, tiếp thu sự góp ý và hỗ trợ các thành viên trong nhóm.
– Giải quyết vấn đề và sáng tạo: Lập được kế hoạch và thực hiện được kế hoạch, liên hệ thực tiễn nhằm giải quyết các vấn đề trong bài học vào cuộc sống.
2. Năng lực hoá học
– Nhận thức hoá học:
+ Nêu được vị trí của các nguyên tố halogen trong bảng tuần hoàn, cấu hình electron nguyên tử, cấu hình electron lớp ngoài cùng của nguyên tử halogen.
+ Viết được công thức cấu tạo, công thức phân tử đơn chất halogen (F2, Cl2, Br2, I2).
+ Nêu được các giá trị độ âm điện, sự biến đổi độ âm điện từ fluorine đến iodine.
+ Nêu được tính chất vật lí của các đơn chất halogen (F2, Cl2, Br2, I2).
+ Nêu được sự giống nhau và khác nhau về số oxi hóa của fluorine với chlorine, bromine, iodine.
+ Trình bày được tính chất hóa học đặc trưng (tính oxi hóa mạnh) của các đơn chất halogen dựa trên cấu hình electron, độ âm điện…
– Tìm hiểu tự nhiên dưới góc độ hoá học: Tiến hành được thí nghiệm so sánh tính oxi hoá của các đơn chất halogen; điều chế khí chlorine trong phòng thí nghiệm; tính tẩy màu của khí chlorine ẩm.
– Vận dụng kiến thức, kĩ năng đã học: Nêu được ứng dụng của các đơn chất trong đời sống, giải thích được nguyên nhân để vận dụng những ứng dụng đó vào thực tiễn.
3. Phẩm chất
– Cẩn thận, trung thực, trách nhiệm và thao tác an toàn trong quá trình làm thực nghiệm.
– Có niềm say mê, hứng thú với việc khám phá và học tập bộ môn hoá học.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên:
– Các phiếu học tập.
– Hình ảnh các quặng, video thí nghiệm.
– Bảng tuần hoàn các nguyên tố hóa học.
– Hóa chất: Dung dịch NaCl, NaI, dung dịch chlorine, bromine, hồ tinh bột.
– Dụng cụ thí nghiệm: Ống nghiệm, ống nhỏ giọt, kẹp gỗ.
2. Học sinh:
– Ôn tập bài cũ và chuẩn bị bài mới.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a) Mục tiêu: Kích thích sự hứng thú, tạo tư thế sẵn sàng học tập và tiếp cận nội dung bài học.
b) Nội dung: Trò chơi âm nhạc (5 phút).
c) Sản phẩm: Tên các nguyên tố thuộc nhóm halogen và hợp chất của chúng trong tự nhiên.
d) Tổ chức thực hiện:
– GV mở một bài hát đồng thời dùng mũ chuyền lần lượt đến các HS. Khi nhạc dừng, HS đang giữ mũ sẽ phải kể tên một nguyên tố nhóm halogen hoặc một hợp chất có trong tự nhiên có chứa các nguyên tố halogen. Tiếp tục chuyền mũ khi nhạc nổi lên. Nếu HS đang giữ mũ không nêu được chất, trò chơi dừng lại.
– Kết thúc trò chơi, GV đặt vấn đề vào bài: Sau đây, cô sẽ cùng các em tìm hiểu tính chất vật lí và hoá học các đơn chất nhóm VIIA.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu vị trí nhóm halogen trong bảng tuần hoàn.
a) Mục tiêu:
– Xác định vị trí của của nhóm halogen trong bảng tuần hoàn.
– Nêu được các nguyên tố có trong nhóm VIIA (nhóm halogen).
b) Nội dung: HS làm việc cá nhân thực hiện nhiệm vụ, từ đó lĩnh hội kiến thức.
c) Sản phẩm: Câu trả lời của HS.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Bước 1: Chuyển giao nhiệm vụ học tập – Yêu cầu học sinh hoạt động cá nhân, quan sát Hình 17.1, cho biết: + Vị trí nhóm halogen trong bảng tuần hoàn. + Các nguyên tố có trong nhóm halogen? |
Nhận nhiệm vụ |
|
Bước 2: Thực hiện nhiệm vụ Theo dõi và hỗ trợ cho HS. |
Suy nghĩ, thảo luận và trả lời câu hỏi: – Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts). – Trong đó astatine (At) và tennessine (Ts) là các nguyên tố phóng xạ. |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu đại diện một học sinh báo cáo kết quả. |
Báo cáo sản phẩm. |
|
Bước 4: Kết luận và nhận định Nhận xét và chốt kiến thức. |
Học sinh rút ra kiến thức trọng tâm |
|
Kiến thức trọng tâm – Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts). – Trong đó astatine (At) và tennessine (Ts) là các nguyên tố phóng xạ. |
|
Hoạt động 2: Tìm hiểu trạng thái tự nhiên của các halogen
a) Mục tiêu: Phát biểu được trạng thái tự nhiên của các đơn chất halogen.
b) Nội dung: HS hoạt động theo cặp đôi, trả lời câu hỏi, hình thành kiến thức.
c) Sản phẩm: Câu trả lời của HS.
d) Tổ chức hoạt động:
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Bước 1: Chuyển giao nhiệm vụ học tập – Yêu cầu học sinh hoạt động theo cặp đôi, cho biết: + Dạng tồn tại của các nguyên tố halogen trong tự nhiên? + Khoảng 71% bề mặt Trái Đất được bao phủ bởi biển và đại dương, phần còn lại là các lục địa và đảo. Theo em, hàm lượng nguyên tố halogen nào nhiều nhất trong tự nhiên? |
Nhận nhiệm vụ |
|
Bước 2: Thực hiện nhiệm vụ Theo dõi và hỗ trợ cho HS. |
– HS thảo luận tìm ra câu trả lời: + Halogen trong tự nhiên chỉ tồn tại ở dạng hợp chất, chủ yếu tồn tại dưới dạng muối của các ion halide (F–, Cl–, Br–, I–) + Cứ mỗi lít nước biển chứa khoảng 35 gam muối, phần lớn là sodium chloride (NaCl). Khoảng 71% bề mặt Trái Đất được bao phủ bởi biển và đại dương ⇒ hàm lượng nguyên tố chlorine có nhiều nhất trong tự nhiên. |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu đại diện một học sinh báo cáo kết quả. |
Báo cáo sản phẩm. |
|
Bước 4: Kết luận và nhận định Nhận xét và chốt kiến thức. |
Học sinh rút ra kiến thức trọng tâm. |
|
Kiến thức trọng tâm Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất. Hợp chất chủ yếu của halogen là muối halide. + Ion fluoride được tìm thấy trong các khoáng chất như fluorite (CaF2); fluorapatite (Ca5(PO4)3F) và cryolite (Na3AlF6). + Ion chloride có nhiều trong nước biển, trong quặng halite (NaCl, thường gọi là muối mỏ), sylvite (KCl). + Ion bromide có trong quặng bromargyrite (AgBr); + Ion iodide có trong iodargyrite (AgI);… |
|
Hoạt động 3: Tìm hiểu cấu hình electron lớp ngoài cùng của nguyên tử và đặc điểm cấu tạo phân tử halogen.
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Bước 1: Chuyển giao nhiệm vụ học tập – Yêu cầu học sinh hoạt động theo cặp đôi, trả lời các câu hỏi: 1. Viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen. 2. Từ đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử, nhận xét xu hướng hình thành liên kết trong phân tử halogen. |
Nhận nhiệm vụ |
|
Bước 2: Thực hiện nhiệm vụ Theo dõi và hỗ trợ cho HS. |
– HS thảo luận tìm ra câu trả lời: 1. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen có dạng: ns2np5. Cụ thể + F: 2s22p5 + Cl: 3s23p5 + Br: 4s24p5 + I: 5s25p5 2. Do có 7 electron ở lớp ngoài cùng, chưa đạt cấu hình bền vững như khí hiếm, nên ở trạng thái tự do, hai nguyên tử halogen góp chung một cặp electron để hình thành phân tử halogen.
Với X là kí hiệu các nguyên tố halogen. Công thức cấu tạo của phân tử halogen: X-X |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu đại diện một học sinh báo cáo kết quả. |
Báo cáo sản phẩm. |
|
Bước 4: Kết luận và nhận định Nhận xét và chốt kiến thức. |
Học sinh rút ra kiến thức trọng tâm. |
|
Kiến thức trọng tâm – Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron. – Để đạt cấu hình electron bền vững giống khí hiếm, hai nguyên tử halogen góp chung một cặp electron để hình thành phân tử.
+ Với X là kí hiệu các nguyên tố halogen. + Công thức cấu tạo của phân tử halogen: X – X. → Như vậy, đơn chất halogen tồn tại ở dạng phân tử X2, liên kết trong phân tử là liên kết cộng hóa trị không phân cực. |
|
…………………………………………
…………………………………………
…………………………………………
Tài liệu có 16 trang, trên đây trình bày tóm tắt 6 trang của Giáo án Hóa hoc 10 Chân trời sáng tạo Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA.
Xem thêm các bài giáo án Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Giáo án Bài 14: Tính biến thiên enthalpy của phản ứng hoá học
Giáo án Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Giáo án Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học
Giáo án Bài 17: Tính chất vật lí và tính chất hóa học của nhóm VIIA
Giáo án Bài 18: Hydrogen halide và một số phản ứng của ion halide
Để mua Giáo án Hóa học 10 Chân trời sáng tạo năm 2023 mới nhất, mời Thầy/Cô liên hệ https://tailieugiaovien.com.vn/