Giải SBT Hóa học 11 Bài 22: Cấu trúc phân tử hợp chất hữu cơ
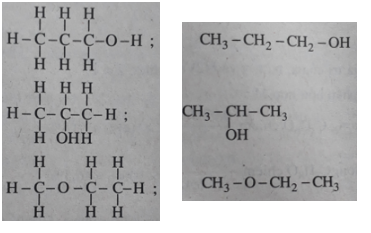
Bài 22.1 trang 31 SBT Hóa học 11:Hai chất
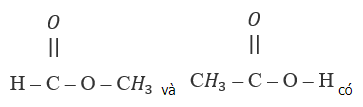
A. Công thức phân tử và công thức cấu tạo đều giống nhau.
B. Công thức phân tử và công thức cấu tạo đều khác nhau.
C. Công thức phân tử giống nhau nhưng công thức cấu tạo khác nhau.
D. Công thức phân tử khác nhau và công thức cấu tạo giống nhau.
Lời giải:
Hai chất trên có công thức phân tử giống nhau (C2H4O2) nhưng công thức cấu tạo khác nhau.
Chọn C.
Bài 22.2 trang 31 SBT Hóa học 11: Hai công thức
A. là các công thức của hai chất có cùng công thức phân tử nhưng có công thức cấu tạo khác nhau.
B. là các công thức của hai chất có công thức phân tử khác nhau nhưng có công thức cấu tạo tương tự nhau.
C. là các công thức của hai chất có công thức phân tử và công thức cấu tạo đều khác nhau.
D. chỉ là công thức của một chất vì công thức phân tử và công thức cấu tạo đều giống nhau.
Lời giải:
Hai chất trên chỉ là công thức của một chất vì công thức phân tử và công thức cấu tạo đều giống nhau.
Chọn D.
Bài 22.3 trang 31 SBT Hóa học 11: Chất nào trong các chất dưới đây là đồng phân của CH3COOCH3 ?
A. CH3CH2OCH3 B. CH3CH2COOH
C. CH3COCH3 D. CH3CH2CH2OH
Lời giải:
Những hợp chất khác nhau nhưng có cùng công thức phân tử là những chất đồng phân.
CH3COOCH3 và CH3CH2COOH có cùng CTPT chúng là đồng phân của nhau.
Chọn B
Bài 22.4 trang 31 SBT Hóa học 11: CH3 – CH2 – OH và CH3 – O – CH3 khác nhau về điểm gì?
A. Công thức cấu tạo
B. Công thức phân tử
C. Số nguyên tử cacbon
D. Tổng số liên kết cộng hóa trị
Lời giải:
CH3 – CH2 – OH và CH3 – O – CH3 có cùng CTPT (C2H6O) và khác nhau về CTCT.
Chọn A.
Bài 22.5 trang 31 SBT Hóa học 11: Nhận xét nào sau đây đúng về hợp chất hữu cơ?
A. Mỗi công thức phân tử chỉ biểu diễn một hợp chất hữu cơ.
B. Mỗi công thức phân tử đều có thể ứng với nhiều hợp chất hữu cơ.
C. Mỗi công thức cấu tạo đều có thể ứng với nhiều hợp chất hữu cơ.
D. Công thức cấu tạo vừa cho biết thành phần vừa cho biết cấu tạo của hợp chất.
Lời giải:
Công thức cấu tạo vừa cho biết thành phần vừa cho biết cấu tạo của hợp chất.
Chọn D.
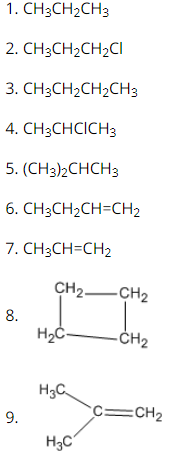
Bài 22.6 trang 31 SBT Hóa học 11: Trong số 9 chất dưới đây, những chất nào là đồng đẳng của nhau ? Những chất nào là đồng phân của nhau ?
Lời giải:
Các chất đồng đẳng:
(1) và (3); (1) và (5); (6) và (7); (7) và (9)
Các chất đồng phân:
(2) và (4); (3) và (5); (6), (8) và (9)
Bài 22.7 trang 32 SBT Hóa học 11: Hỗn hợp khí A chứa hai hiđrocacbon kế tiếp nhau trong một dãy đồng đẳng. Lấy 1,12 lít A (đktc) đem đốt cháy hoàn toàn. Sản phẩm cháy được dẫn qua bình (1) đựng H2SO4 đặc, sau đó qua bình (2) đựng dung dịch NaOH (có dư). Sau thí nghiệm, khối lượng bình (1) tăng 2,16 g và bình (2) tăng 7,48 g. Hãy xác định công thức phân tử và phần trăm về thể tích của từng chất trong hỗn hợp A.
Phương pháp giải:
Cách 1: Sử dụng phương pháp trung bình
+) Đặt công thức chung của hai chất đó là
+) Phương trình cháy: + ( + ) + (1)
+) Bình (1) giúp định lượng H2O , bình (2) giúp định lượng CO2
+) Dựa vào phương trình và dữ kiện đề bài tìm được điều kiện của và
+) Biện luận để tìm x và y Công thức 2 chất ban đầu
+) Gọi số mol 2 chất lần lượt là: a, b (mol)
+) Lập hệ phương trình 2 ẩn a, b % thể tích mỗi khí
Cách 2 : Gợi ý: Đặt lượng CxHy là a mol, lượng Cx+1Hy+2 là b mol.
Dựa vào dữ kiện đề bài lập phương trình với ẩn a, b, x, y. Biện luận tìm ra x, y từ đó xác định phần trăm về thể tích của từng chất trong hỗn hợp A.
Lời giải:
Cách 1: Hai hiđrocacbon kế tiếp nhau trong dãy đồng đẳng có công thức phân tử là CxHy và Cx+1Hy+2.
Đặt công thức chung của hai chất đó là trong đó là số nguyên tử cacbon trung bình (x < < x +1) và là số nguyên tử hiđro trung bình (y < < y + 2).
+ ( + ) +
n + .n
+ 2 +
Số mol 2 chất mang đốt : = 0,05 (mol).
Số mol H2O: = 0,12 (mol).
Số mol CO2: = 0,17(mol).
Theo phương trình : 1 mol tạo ra mol CO2 và mol .
Theo đầu bài: 0,05 mol tạo ra 0,17 mol CO2 và 0,12 mol .
= = 3,4 ; x < 3,4 < x + 1 2,4 < x < 3,4
x là số nguyên nên x = 3
= = 2,4 = 4,8 y < 4,8 < y + 2
2,8 < y < 4,8.
Trong khoảng này có hai số nguyên là 3 và 4 nhưng số nguyên tử hiđro trong một phân tử hiđrocacbon không bao giờ là số lẻ nên y = 4.
Công thức phân tử của hai chất là và . Đặt lượng là a mol, lượng là b mol:
% về thể tích (cũng là % về số mol) của trong hỗn hợp A :
.100% = 60,0%.
% về thể tích của trong hỗn hợp A là 40,0%.
Cách 2 : Đặt lượng CxHy là a mol, lượng Cx+1Hy+2 là b mol.
Ta có : a + b = 0,05 (1)
a mol ax mol mol
b mol b.(x+1) mol
Số mol : ax + b(x + 1) = 0,17 (2)
Số mol : (3)
Từ (2) ta có (a + b)x + b = 0,17 ;
b = 0,17-0,05x
b là số mol của một trong hai chất nên 0 < b < 0,05.
Do đó 0 < 0,17 – 0,05x < 0,05 2,4 < x < 3,4 x = 3.
b = 0,17 – 0,05 x 3 = 0,02 a = 0,05 – 0,02 = 0,03. Thay giá trị của a và b vào (3) ta có :
0,03y + 0,02(y + 2) = 0 y = 4.
Trả lời : chiếm 60,0% thể tích hỗn hợp A.
chiếm 40,0% thể tích hỗn hợp A.
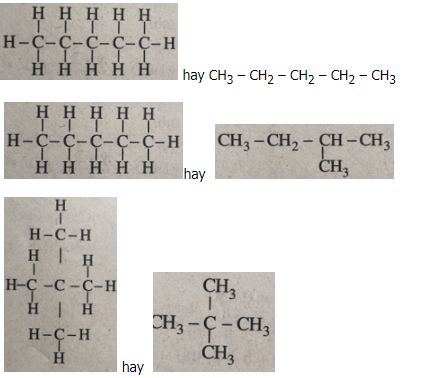
Bài 22.8 trang 32 SBT Hóa học 11: Hỗn hợp M chứa ba hiđrocacbon là đồng phân của nhau. Khi đốt cháy hoàn toàn 1,80 g M, thu được 2,80 lít CO2 (đktc).
1. Xác định công thức phân tử của các chất mang đốt biết rằng tỉ khối hơi của M đối với oxi là 2,25.
2. Dựa vào thuyết cấu tạo hoá học, hãy viết công thức cấu tạo khai triển và công thức cấu tạo rút gọn của từng chất trong hỗn hợp M.
Phương pháp giải:
1. +) Công thức các chất trong hỗn hợp M đều là .
+) Tính mC và mH
+) Lập tỉ lệ x, y => CTĐGN
+) Tính phân tử khối của M dựa vào tỉ khối => CTPT
2. Dựa vào thuyết cấu tạo hóa học viết CTCT
Lời giải:
Các chất đồng phân có cùng CTPT và có PTK bằng nhau. Các chất trong hỗn hợp M đều là .
Khối lượng C trong 2,8 lít CO2: = 1,50(g).
Đó cũng là khối lượng C trong 1,80 g , vậy khối lượng H : 1,80- 1,50 = 0,30 (g).
x : y = = 0,125 : 0,30 = 5 : 12.
Công thức đơn giản nhất là .
Khối lượng 1 mol : 2,25 x 32,0 = 72,0 (g).
Do đó, công thức phân tử cũng là .
Công thức cấu tạo của các đồng phân :
Bài 22.9 trang 32 SBT Hóa học 11: Hỗn hợp M ở thể lỏng, chứa hai hợp chất hữu cơ kế tiếp nhau trong một dãy đồng đẳng. Nếu làm bay hơi 2,58 g M thì thể tích hơi thu được đúng bằng thể tích của 1,40 g khí N2 ở cùng điều kiện. Đốt cháy hoàn toàn 6,45 g M thì thu được 7,65 g H2O và 6,72 lít CO2 (đktc).
Xác định công thức phân tử và phần trăm khối lượng của từng chất trong hỗn hợp M.
Phương pháp giải:
+) Tính số mol 2 chất có trong 6,45 g M
+) Khi đốt hỗn hợp M, thu được CO2 và H2O ; vậy các chất trong hỗn hợp phải chứa C và H, có thể có O. Công thức phân tử hai chất đó là CxHyOz và Cx+1Hy+2Oz (x, y nguyên và > 0 ; z nguyên và > 0).
+) Giả sử trong 6,45 g M có a mol CxHyOz và b mol Cx+1 Hy+2Oz
+) PTHH:
+) Dựa vào PTHH và dữ kiện đề bài lập hệ phương trình, biến đổi hệ phương trình để tìm a, b, x, y CTPT các chất trong M
+) Tính thành phần phần trăm khối lượng của từng chất trong hỗn hợp M.
Lời giải:
Số mol 2 chất trong 2,58 g M : = 0,05 (mol).
Số mol 2 chất trong 6,45 g M : = 0,125 (mol).
Khi đốt hỗn hợp M, thu được CO2 và H2O ; vậy các chất trong hỗn hợp phải chứa C và H, có thể có O. Hai chất lại kế tiếp nhau trong một dãy đồng đẳng (nghĩa là hơn nhau 1 nhóm CH2) nên công thức phân tử hai chất đó là CxHyOz và Cx+1Hy+2Oz (x, y nguyên và > 0 ; z nguyên và > 0).
Giả sử trong 6,45 g M có a mol CxHyOz và b mol Cx+1 Hy+2Oz:
a mol xa mol mol
b mol (x+1)b mol
Số mol CO2: xa + (x + 1)b = = 0,3 (mol) (3)
Số mol : = 0,425 (mol)
ya + (y + 2)b = 0,85 (4)
Giải hệ phương trình :
Biến đổi (3) ta có x(a + b) + b = 0,300 <=>b = 0,300-0,125x
0 < b < 0,125 0 < 0,300 – 0,125x < 0,125 <=>1,40 < x < 2,40
x = 2 ; b = 0,300 – 0,125x 2 = 0,05.
a = 0,125 – 0,05 = 0,075.
Thay giá trị của a và b vào (4) ta có :
0,0750y + 0,0500(y + 2) = 0,85
y = 6.
Thay giá trị của a, b, x, y vào (2) ta tìm được z = 1.
Thành phần hỗn hợp M :
Khối lượng C2H6O chiếm . 100% = 53,5%.
Khối lượng C3H8O chiếm . 100% = 46,5%
Bài 22.10 trang 32 SBT Hóa học 11: Hỗn hợp X chứa ba chất hữụ cơ đồng phân. Nếu làm bay hơi 2,10 g X thì thể tích hơi thu được bằng thể tích của 1,54 g khí CO2 ở cùng điều kiện. Để đốt cháy hoàn toàn 1,50 g X cần dùng vừa hết 2,52 lít O2 (đktc). Sản phẩm cháy chỉ có CO2 và H2O theo tỉ lệ 11 : 6 về khối lượng.
1. Xác định công thức phân tử của ba chất trong X.
2. Dựa vào thuyết cấu tạo hoá học, hãy viết công thức cấu tạo (triển khai và rút gọn) của từng chất đó.
Phương pháp giải:
1. +) Áp dụng định luật bảo toàn khối lượng
+) Mặt khác, CO2 và H2O theo tỉ lệ 11 : 6 về khối lượng => và
+) Tính khối lượng các nguyên tố trong X (chú ý sự có mặt của O)
+) Tìm CTĐGN của X
+) Tính phân tử khối của X => CTPT
+) Viết các CTCT của các chất trong X
Lời giải:
Ba chất đồng phân có công thức phân tử giống nhau. Đốt X ta chỉ được CO2 và H2O, vậy các chất trong X có chứa C, H và có thể có chứa O.
Theo định luật bảo toàn khối lượng :
Mặt khác =11:6
Từ đó tìm được : = 3,30 g và = 1,80 g
Khối lượng C trong 3,30 g CO2: = 0,9 (g).
Khối lượng H trong 1,80 g H2O : =0,2 (g)
Khối lượng O trong 1,50 g X : 1,50 – 0,9 – 0,2 = 0,4 (g).
Các chất trong X có dạng CxHyOz
x : y : z = = 0,075 : 0,2 : 0,025 = 3 : 8 : 1.
Công thức đơn giản nhất là .
CTPT cũng là .
Các CTCT: