Lý thuyết Hóa học lớp 11 Bài 2: Cân bằng trong dung dịch nước
A. Lý thuyết Cân bằng trong dung dịch nước
1. Sự điện li, chất điện li, chất không điện li
a. Tìm hiểu hiện tượng điện li
– Sự điện li là quá trình phân li các chất trong nước tạo thành các ion.
Ví dụ:
NaCl → Na+ + Cl–
NaOH → Na+ + OH–
HCl → H+ + Cl–
b. Tìm hiểu sự phân loại các chất điện li
– Chất điện li mạnh: Là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion
Ví dụ: Axit HCl, HNO3, Bazo mạnh (NaOH, KOH),…
– Chất điện li yếu: Là chất khi tan trong nước, chỉ có một số phân tự hòa tan thành ion, còn lại vẫn tồn tạo ở dạng phân tử
Ví dụ: Axit hữu cơ CH3COOH, axit HClO, H2S, HE,…
– Chất không điện li: Là chất khi hòa tan trong nước, các phân tử không phân li thành ion.
2. Thuyết Brønsted–Lowry về acid–base
– Acid là chất proton (H+)
– Base là chất nhận proton
=> Acid và base có thể là phân tử hoặc ion
CH3COOH + H2O ⇌ CH3COO– + H3O+
3. Khái niệm pH chất chỉ thị Acid – base
a. Tìm hiểu khái niệm pH
– pH là chỉ số đánh giá độ acid hay base của một dung dịch
– Thang pH thường dùng có giá trị từ 1 đến 14
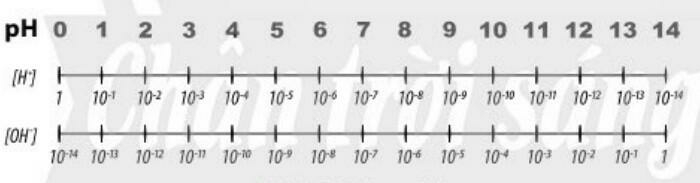
b. Tìm hiểu ý nghĩa của pH trong thực tiễn
– Chất chỉ thị acid – base là chất có màu sắc biến đổi theo giái trị pH của dung dịch

4. Chuẩn độ Acid – Base
– Để xác định nồng độ dung dịch acid hoặc base chưa biết người ta dùng dung dịch acid hoặc base (kiềm) đã biết chính xác nồng độ.
5. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+, CO32-
a. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+
– Ion Al3+, Fe3+, dễ bị phân hủy trong nước tạo thành base không tan và cho môi trường acid.
b. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion CO32-
CO32- +H2O ⇌ HCO3– + HO–
– Ion CO32- bị phân hủy cho môi trường base
Sơ đồ tư duy Cân bằng trong dung dịch nước
B. Trắc nghiệm Cân bằng trong dung dịch nước
Đang cập nhật …
Xem thêm các bài tóm tắt Lý thuyết Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 1: Khái niệm về cân bằng hóa học
Lý thuyết Bài 2: Cân bằng trong dung dịch nước
Lý thuyết Bài 3: Đơn chất nitrogen
Lý thuyết Bài 4: Ammonia và một số hợp chất ammonium
Lý thuyết Bài 5: Một số hợp chất với oxygen của nitrogen