Giải SBT Hóa học 11 Bài 4: Ammonia và một số hợp chất ammonium
Bài 4.1 trang 18 SBT Hóa học 11: Liên kết trong phân tử NH3 là
A. liên kết cộng hoá trị phân cực.
C. liên kết cộng hoá trị không phân cực.
B. liên kết ion.
D. liên kết hydrogen.
Lời giải:
Liên kết trong phân tử NH3 được hình thành bởi cặp electron dùng chung giữa nguyên tử N và các nguyên tử H. Do độ âm của N lớn hơn độ âm điện của H nên cặp electron dùng chung bị lệch về phía N.
=> Liên kết hoá học trong phân tử NH3 là liên kết cộng hóa trị phân cực.
→ Chọn A.
Bài 4.2 trang 18 SBT Hóa học 11: Trong dung dịch, ammonia thể hiện tính base yếu do
A. phân tử ammonia chứa liên kết cộng hoá trị phân cực và liên kết hydrogen.
B. phân tử ammonia chứa liên kết cộng hoá trị phân cực và liên kết ion.
C. phần lớn các phân tử ammonia kết hợp với nước tạo ra các ion và OH–.
D. một phần nhỏ các phân tử NH3 kết hợp với ion H+ của nước tạo và OH–.
Lời giải:
Khi tan trong nước, ammonia nhận thêm H+ từ nước, do đó ammonia có tính base.
→ Chọn D.
Bài 4.3 trang 18 SBT Hóa học 11: Để tạo độ xốp cho một số loại bánh, có thể dùng chất nào sau đây?
A. (NH4)3PO4.
B. NH4HCO3.
C. CaCO3.
D. NaCl.
Lời giải:
NH4HCO3 thường được dùng làm bột nở trong sản xuất bánh bao:
Khi gặp nhiệt độ cao, NH4HCO3 bị phân hủy thành NH3, CO2 và hơi H2O làm cho bánh nở to hơn và xốp.
→ Chọn B.
Bài 4.4 trang 18 SBT Hóa học 11: Cho hỗn hợp khí (X) gồm N2, H2, NH3 có tỉ khối so với khí hydrogen là 8. Dẫn hỗn hợp khí (X) đi qua dung dịch H2SO4 đặc, dư thì thể tích khí còn lại một nửa. Thành phần % theo thể tích mỗi khí trong hỗn hợp (X) lần lượt là
A. 25% N2, 25% H2 và 50% NH3.
B. 25% N2, 50% H2 và 25% NH3.
C. 50% N2, 25% H2 và 25% NH3.
D. 20% N2, 30% H2 và 50% NH3.
Lời giải:
Giả sử tổng số mol của hỗn hợp X là 1 mol.
Ta có: NH3 phản ứng với H2SO4 đặc, do đó sau khi dẫn hỗn hợp khí (X) đi qua dung dịch H2SO4 đặc, còn lại khí N2, H2.
Ta có:
Ta có:
Ta lại có:
Giải hệ phương trình gồm (1) và (2):
→ Chọn A.
Bài 4.5 trang 18 SBT Hóa học 11: Trong các phát biểu sau, phát biểu nào không đúng?
A. Ở điều kiện thường, NH3 là chất khí không màu.
B. Khí NH3 nặng hơn không khí.
C. Khí NH3 dễ hoá lỏng, tan nhiều trong nước.
D. Phân tử NH3 chứa các liên kết cộng hoá trị phân cực.
Lời giải:
Phát biểu B không đúng vì:
Khí ammonia nhẹ hơn không khí .
→ Chọn B.
Bài 4.6 trang 18 SBT Hóa học 11: Trong phòng thí nghiệm, người ta có thể phân biệt muối ammonium với một số muối khác bằng cách cho nó tác dụng với dung dịch base. Hiện tượng nào xảy ra?
A. Thoát ra một chất khí màu lục nhạt, làm xanh giấy quỳ tím ẩm.
B. Thoát ra một chất khí không màu, làm xanh giấy quỳ tím ẩm.
C. Thoát ra một chất khí màu nâu đỏ, làm xanh giấy quỳ tím ẩm.
D. Thoát ra một chất khí không màu, làm hồng giấy quỳ tím ẩm.
Lời giải:
Muối ammonium phản ứng với dung dịch base sinh ra khí ammonia (không màu) làm quỳ tím hóa xanh.
Ví dụ:
→ Chọn B.
Bài 4.7 trang 19 SBT Hóa học 11: Trong các nhận xét dưới đây về muối ammonium, nhận xét nào đúng?
A. Muối ammonium tồn tại dưới dạng tinh thể ion, phân tử gồm cation ammonium và anion hydroxide.
B. Tất cả muối ammonium đều dễ tan trong nước, khi tan điện li hoàn toàn thành cation ammonium và anion gốc acid.
C. Dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí làm quỳ tím ẩm hoá đỏ.
D. Khi nhiệt phân các muối ammonium luôn có khí NH3 thoát ra.
Lời giải:
A sai vì phân tử muối ammonium gồm cation ammonium và anion anion gốc acid.
B đúng.
C sai vì dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí ammonia làm quỳ tím ẩm hoá xanh.
D sai vì muối có một số muối ammonium khi nhiệt phân không tạo NH3. Ví dụ:
![]()
→ Chọn A.
Bài 4.8 trang 19 SBT Hóa học 11: Cho các phát biểu sau:
(1) Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị lạnh.
(2) Để làm khô khí NH3 có lẫn hơi nước, có thể dẫn khí NH3 đi qua bình đựng dung dịch H2SO4 đặc.
(3) Khi cho quỳ tím ẩm vào lọ đựng khí NH3, quỳ tím chuyển thành màu đỏ.
(4) Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
Có bao nhiêu phát biểu đúng?
A. 2.
B. 3.
C. 1.
D. 4.
Lời giải:
– Phát biểu đúng: (1), (4).
– Phát biểu sai: (2), (3).
+ (2) sai vì NH3 phản ứng với H2SO4 đặc, do đó không sử dụng dung dịch H2SO4 đặc để làm khô khí NH3.
+ (4) sai vì NH3 (ammonia) là có tính base, làm quỳ tím ẩm hóa xanh.
→ Chọn A.
Bài 4.9 trang 19 SBT Hóa học 11: Tã lót trẻ em sau khi được giặt sạch vẫn còn mùi khai do vẫn lưu lại một lượng ammonia. Để khử hoàn toàn mùi của ammonia thì người ta cho vào nước xả cuối cùng một ít hoá chất có sẵn trong nhà. Hãy chọn hóa chất thích hợp:
A. Phèn chua.
B. Giấm ăn.
C. Muối ăn.
D. Nước gừng tươi.
Lời giải:
Vì ammonia là dung dịch có tính base, nên ta cần một hóa chất có tính acid để khử ammonia. Trong các hóa chất trên, giấm ăn có tính acid (chứa acetic acid).
→ Chọn B.
Bài 4.10 trang 19 SBT Hóa học 11: Trong khí thải của quy trình sản xuất thuốc trừ sâu, phân bón hoá học có lẫn khí NH3. Khí này rất độc đối với sức khoẻ của con người và gây ô nhiễm môi trường. Con người hít phải khí này với lượng lớn sẽ gây ngộ độc: họ, đau ngực (nặng), đau thắt ngực, khó thở, thở nhanh, thở khò khè; chảy nước mắt và bỏng mắt, mù mắt, đau họng nặng, đau miệng; mạch nhanh, yếu, sốc; lẫn lộn, đi lại khó khăn, chóng mặt, thiếu sự phối hợp, bồn chồn, ngẩn ngơ). Để xử lí NH3 lẫn trong khí thải, người ta có thể dẫn khí thải qua một bể lọc chứa hoá chất nào sau đây?
A. Dung dịch Ca(OH)2.
B. Dung dịch HCl.
C. Dung dịch NaOH.
D. Nước.
Lời giải:
Vì ammonia là dung dịch có tính base, nên ta cần một hóa chất có tính acid để khử ammonia. Trong các hóa chất trên, dung dịch HCl có tính acid.
→ Chọn B.
Bài 4.11 trang 20 SBT Hóa học 11: Khi phun NH3 vào không khí bị nhiễm Cl2 thấy xuất hiện “khói trắng”. Giải thích và viết phương trình hoá học minh hoạ.
Lời giải:
NH3 là một chất khử mạnh, do đó ban đầu Cl2 bị khử bởi NH3:
Sau đó NH3 tiếp tục phản ứng với các phân tử HCl mới sinh ra từ phản ứng trên, tạo “khói trắng” NH4Cl:
NH3 + HCl → NH4Cl
Bài 4.12 trang 20 SBT Hóa học 11: Cho một ít chất chỉ thị phenolphtalein vào dung dịch NH3 loãng thu được dung dịch (A). Màu của dung dịch (A) thay đổi như thế nào khi
a) đun nóng dung dịch một hồi lâu.
b) thêm dung dịch HCl với số mol HCl bằng số mol NH3 có trong dung dịch (A).
c) thêm vài giọt dung dịch Na2CO3.
d) thêm từ từ dung dịch AlCl3 tới dư.
Lời giải:
Cho một ít chất chỉ thị phenolphtalein vào dung dịch NH3 loãng thu được dung dịch (A) có màu hồng.
Cân bằng hóa học tồn tại trong dung dịch ammonia:
a) Khi đun nóng, khí NH3 bay lên, cân bằng chuyển dịch theo chiều nghịch, làm lượng OH– giảm (tính base giảm). Do đó, màu hồng của dung dịch (A) nhạt dần.
b) Khi thêm dung dịch HCl với số mol HCl bằng số mol NH3, muối NH4Cl được sinh ra từ phản ứng:
NH3 + HCl → NH4Cl
Vì muối NH4Cl bị thủy phân, tạo môi trường acid, dung dịch (A) dần mất màu hồng.
c) Thủy phân muối Na2CO3 cho môi trường base:
Do đó, dung dịch (A) có màu hồng đậm hơn.
d) Khi thêm AlCl3 tới dư, xảy ra phản ứng:
Sau đó, NH4Cl và AlCl3 dư đều bị thủy phân, tạo môi trường acid:
Do đó, màu hồng của dung dịch (A) nhạt dần.
Bài 4.13 trang 20 SBT Hóa học 11: Xét phản ứng tổng hợp ammonia theo phương trình hoá học:
![]()
Ở nhiệt độ T, phản ứng đạt tới trạng thái cân bằng.
a) Cân bằng chuyển dịch theo chiều nào khi thêm H2? Khi thêm NH3?
b) Khi tăng thể tích của hệ thì cân bằng dịch chuyển như thế nào?
c) Giá trị của hằng số cân bằng thay đổi như thế nào trong trường hợp a) và trường hợp b)?
Lời giải:
a) Khi thêm H2, cân bằng chuyển dịch theo chiều làm giảm lượng khí H2, tức cân bằng chuyển dịch theo chiều thuận.
Khi thêm NH3, cân bằng chuyển dịch theo chiều làm giảm lượng khí NH3, tức cân bằng chuyển dịch theo chiều nghịch.
b) Khi tăng thể tích của hệ (giảm áp suất của hệ), cân bằng chuyển dịch theo chiều làm tăng áp suất của hệ, tức là chiều làm tăng số mol khí của hệ (chiều nghịch).
c) Giá trị của hằng số cân bằng không thay đổi trong trường hợp a) và trường hợp b), vì KC của phản ứng xác định chỉ phụ thuộc vào nhiệt độ mà trong hai trường hợp trên, nhiệt độ không đổi.
Bài 4.14* trang 20 SBT Hóa học 11: Một lượng lớn ammonium ion trong nước rác thải sinh ra khi vứt bỏ vào ao hồ được vi khuẩn oxi hoá thành nitrate và quá trình đó làm giảm oxygen hòa tan trong nước gây ngạt cho sinh vật sống dưới nước. Người ta có thể xử lí nguồn gây ô nhiễm đó bằng nước vôi trong (dung dịch Ca(OH)2) và khí chlorine để chuyển ammonium ion thành ammonia rồi chuyển tiếp thành nitrogen không độc thải ra môi trường. Giải thích cách làm này bằng phương trình hoá học.
Lời giải:
Trong dung dịch nước vôi trong, xảy ra phương trình điện li sau:
Ion ammonium phản ứng với base, sinh ra khí NH3
NH3 có tính khử mạnh, phản ứng với Cl2 tạo khí N2 không độc.
Bài 4.15 trang 21 SBT Hóa học 11: Muối NH4NO3 sẽ nhiệt phân theo phản ứng nào trong 2 phản ứng sau?
Biết enthalpy tạo thành chuẩn của các chất có giá trị như sau:
|
Chất |
NH4NO3(s) |
NH3(g) |
N2O(g) |
HNO3(g) |
H2O(g) |
|
(kJ/mol) |
-365,61 |
-45,90 |
82,05 |
-134,31 |
-241,82 |
Lời giải:
Vì phản ứng (1) là phản ứng thu nhiệt, phản ứng (2) là phản ứng tỏa nhiệt nên phản ứng (2) dễ xảy ra hơn.
=> Muối NH4NO3 sẽ nhiệt phân theo phản ứng (2).
Bài 4.16 trang 21 SBT Hóa học 11: Hiện nay người ta sản xuất ammonia bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (thành phần chính của khí thiên nhiên).
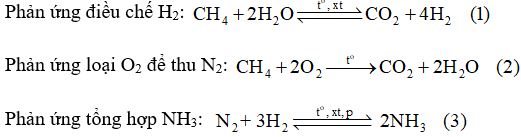
Để sản xuất khí ammonia, nếu lấy 841,7 m3 không khí (chứa 21,03% O2; 78,02% N2, còn lại là khí hiếm theo thể tích), thì cần phải lấy bao nhiêu m3 khí methane và bao nhiêu m3 hơi nước để có đủ lượng N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Giả thiết các phản ứng (1), (2) đều xảy ra hoàn toàn và các thể tích khí đo ở cùng điều kiện.
Lời giải:
Theo phương trình hóa học (2):
Theo phương trình hóa học (3):
Theo phương trình hóa học (1):
Bài 4.17 trang 21 SBT Hóa học 11: Hợp chất có công thức hoá học NH4NO3 được giới chức quốc gia Lebanon xác định là nguyên nhân gây ra vụ nổ thảm khốc ở thủ đô Beirut vào ngày 04/08/2020. Tia lửa hàn trong quá trình sửa chữa nhà kho có thể đã làm 2 750 tấn NH4NO3 cất trữ phát nổ, phá huỷ nhiều nhà cửa, dẫn đến nhiều người thiệt mạng. Hãy giải thích vì sao NH4NO3 có khả năng phát nổ.
Lời giải:
![]()
Ammonium nitrate khi ở nhiệt độ cao bị phân huỷ thành khí N2O và hơi nước, là một phản ứng toả nhiệt và năng lượng lớn. Khi phản ứng nổ xảy ra, năng lượng được giải phóng một cách đột ngột dưới áp lực rất tăng nhanh, còn được gọi là sóng nổ hoặc sóng xung kích. Sóng xung kích gây ra thiệt hại lớn cho môi trường xung quanh. Ammonium nitrate có thể tự phân huỷ qua thời gian. Tia lửa hàn trong quá trình sửa chữa nhà kho đã khơi mào phản ứng phân huỷ ammonium nitrate gây nổ.
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 3: Đơn chất nitrogen
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate