Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 1
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: …………………………………………………………… Lớp: ………………………..
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; Fe = 56; Cu = 64; Zn = 65; Ag=108; Ba = 137)
I. TRẮC NGHIỆM (6 điểm)
Câu 1: Chất khí nào sau đây được tạo ra từ bình chữa cháy và dùng để sản xuất đá khô?
A. H2O.
B. N2.
C. CO2.
D. CO.
Câu 2: Cho m gam Al phản ứng hoàn toàn với dung dịch HNO3 loãng (dư), thu được 4,48 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của m là
A. 2,70.
B. 4,05.
C. 8,10.
D. 5,40.
Câu 3: Khí amoniac làm giấy quỳ tím ẩm
A. chuyển thành màu xanh.
B. mất màu.
C. chuyển thành màu đỏ
D. không đổi màu.
Câu 4: Phương trình ion:\(O{H^ – } + HCO_3^ – \to CO_3^{2 – } + {H_2}O\) là của phản ứng xảy ra giữa cặp chất nào sau đây?
A. NaOH + Ba(HCO3)2.
B. Ba(HCO3)2 + Ba(OH).
C. NaHCO3 + Ba(OH)2
D. NaHCO3 + NaOH.
Câu 5: Các nguyên tử thuộc nhóm IVA có cấu hình electron lớp ngoài cùng là:
A. ns2np5. B. ns2np3.
C. ns2np4. D. ns2np2.
Câu 6: Kim loại bị thụ động trong HNO3 đặc, nguội là
A. Pt, Cu. B. Al, Fe.
C. Ag, Fe. D. Pb, Ag.
Câu 7: Chất phản ứng được với NH3 là
A. Na2O. B. AlCl3 (dd).
C. Na2CO3 (dd). D. NaOH (dd).
Câu 8: Nồng độ mol của anion trong dung dịch BaCl2 0,20M là
A. 0,40M. B. 0,20M.
C. 0,30M. D. 0,10M.
Câu 9: Trong những nhận xét dưới đây về muối amoni, nhận xét nào là đúng?
A. Muối amoni là tinh thể ion, phân tử gồm cation amoni và anion hiđroxit.
B. Tất cả các muối amoni đều dễ tan trong nước, khi tan điện li hòa toàn thành cation amoni và anion gốc axit.
C. Dung dịch muối amoni tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất khí làm quỳ tím hóa đỏ.
D. Khi nhiệt phân muối amoni luôn luôn có khí amoniac thoát ra.
Câu 10: Cho P tác dụng với Mg, sản phẩm thu được là
A. Mg2P2O7. B. Mg3P2.
C. Mg(PO3)2. D. Mg3(PO4)2.
Câu 11: Các hình vẽ sau mô tả các cách thu khí trong phòng thí nghiệm:
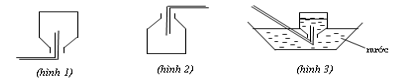
Kết luận nào sau đây đúng?
A. Hình 3: Thu khí N2, H2 và HCl.
B. Hình 2: Thu khí CO2, SO2 và NH3.
C. Hình 3: Thu khí N2, H2 và NH3.
D. Hình 1: Thu khí H2, He và NH3.
Câu 12: Khi nhiệt phân, dãy muối rắn nào dưới đây đều sinh ra kim loại, khí nitơ đioxit và oxi?
A. AgNO3, Hg(NO3)2.
B. Cu(NO3)2, Mg(NO3)2.
C. Hg(NO3)2, Mg(NO3)2.
D. AgNO3, Cu(NO3)2.
Câu 13: Độ dinh dưỡng của phân lân được tính bằng
A. % P2O5. B. % P.
C. %\(PO_4^{3 – }\). D. Ca(H2PO4)2.
Câu 14: Chất nào sau đây thuộc loại chất điện li yếu?
A. H2SO4. B. KOH.
C. CH3COOH. D. NaCl.
Câu 15: Cho dung dịch KOH đến dư vào 50 ml (NH4)2SO4 1M. Đun nóng nhẹ, thu được thể tích khí thoát ra (đktc) là
A. 1,12 lít B. 4,48 lít.
C. 0,112 lít. D. 2,24 lít.
Câu 16: Sục 0,15 mol khí CO2 vào 200 ml dung dịch Ba(OH)2 1M, kết thúc phản ứng thu được các chất:
A. Ba(HCO3)2 và Ba(OH)2 dư.
B. Ba(HCO3)2.
C. Ba(HCO3)2 và BaCO3.
D. BaCO3, Ba(OH)2 dư.
Câu 17: Số liên kết xích-ma (Ϭ) trong phân tử C4H10 là:
A. 10. B. 13.
C. 12. D. 14.
Câu 18: Cặp chất nào dưới đây là dồng phân của nhau?
A. CH3CH2CH2OH, CH3OCH2CH3
B. CH3OCH3, CH3CHO
C. CH3OH, C2H5OH
D. CH3CH2OH, CH3CH2Br
Câu 19: Chất nào sau đây là dẫn xuất của hiđrocacbon?
A. CH4 B. C2H6
C. C6H6 D. C3H6Br.
Câu 20: Số công thức cấu tạo mạch hở có thể có ứng với các công thức phân tử C2H6O là
A. 3 B. 2
C. 1 D. 4.
II. TỰ LUẬN (4 điểm)
Câu 1 (1,5 điểm): Cho 2,8 gam N2 tác dụng H2 lấy dư. Biết hiệu suất phản ứng đạt 20%. Tính thể tích của NH3 thu được sau phản ứng (đktc)?
Câu 2 (2,5 điểm): Chia 19,4 gam hỗn hợp gồm Mg, Al, Zn thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một trong O2 dư thu được 15,7 gam hỗn hợp oxit. Phần hai hòa tan trong dung dịch HNO3 đặc, nóng dư thu được V (lít) NO2 (sản phẩm khử duy nhất, (đktc)). Tính giá trị của V.
— Hết —
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I. TRẮC NGHIỆM
|
1. C |
2. D |
3. A |
4. D |
5. D |
6. B |
7. B |
8. A |
9. B |
10. B |
|
11. D |
12. A |
13. A |
14. C |
15. D |
16. D |
17. B |
18. A |
19. D |
20. B |
Câu 1:
Đáp án C
Khí CO2 được tạo ra từ bình chữa cháy và dùng để sản xuất đá khô.
Câu 2:
Đáp án D
Phương trình hóa học:
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Ta có: \({n_{NO}} = \frac{{4,48}}{{22,4}} = 0,2\,mol\)
Áp dụng định luật bảo toàn electron:
\(3.{n_{Al}} = 3.{n_{NO}} \Rightarrow {n_{Al}} = {n_{NO}} = 0,2\,mol\)
⟹ m = 0,2.27 = 5,4 gam
Câu 3:
Đáp án A
Khí amoniac làm giấy quỳ tím ẩm chuyển thành màu xanh vì:
NH3 + H2O \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} NH_4^ + + O{H^ – }\)
⟹ Môi trường bazơ.
Câu 4:
Đáp án D
Phản ứng xảy giữa cặp chất NaHCO3 và NaOH có phương trình ion là:
\(O{H^ – } + HCO_3^ – \to CO_3^{2 – } + {H_2}O\)
Câu 5:
Đáp án D
Các nguyên tử thuộc nhóm IVA có cấu hình electron lớp ngoài cùng là ns2np2.
Câu 6:
Đáp án B
Al, Fe bị thụ động trong HNO3 đặc, nguội.
Câu 7:
Đáp án B
3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
Câu 8:
Đáp án A
\(\begin{array}{l}BaC{l_2} \to B{a^{2 + }} + 2C{l^ – }\\0,2M\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,0,4M\end{array}\)
Câu 9:
Đáp án B
Tất cả các muối amoni đều dễ tan trong nước, khi tan điện li hòa toàn thành cation amoni và anion gốc axit.
Câu 10:
Đáp án B
Phương trình hóa học:
3Mg + 2P Mg3P2
Câu 11:
Đáp án D
Hình 1 được áp dụng để thu khí nhẹ hơn không khí.
Hình 2 được áp dụng để thu khí nặng hơn không khí.
Hình 3 được áp dụng để thu khí không tan hoặc ít tan trong nước.
Câu 12:
Đáp án A
Khi nhiệt phân các muối AgNO3 hay Hg(NO3)2 đều sinh ra kim loại, khí NO2 và khí O2.
Câu 13:
Đáp án A
Độ dinh dưỡng của phân lân được tính bằng % về khối lượng của P2O5 trong phân.
Câu 14:
Đáp án C
Chất điện li yếu là CH3COOH.
Phương trình điện li: CH3COOH ⇄ \(C{H_3}{\rm{CO}}{{\rm{O}}^ – } + {H^ + }\)
Câu 15:
Đáp án D
Phương trình hóa học:
2KOH + (NH4)2SO4 →2NH3 + K2SO4 + 2H2O
⟹ \({n_{N{H_3}}} = 2.{n_{{{(N{H_4})}_2}S{O_4}}} = 2.0,05.1 = 0,1\,mol\)
⟹ \({V_{N{H_3}}} = 0,1.22,4 = 2,24\)lít
Câu 16:
Đáp án D
Ta có: \({n_{Ba{{(OH)}_2}}} = 0,2.1 = 0,2\,mol\)
Nhận thấy: \(\frac{{{n_{Ba{{(OH)}_2}}}}}{{{n_{C{O_2}}}}} > 1\)⟹ Sau phản ứng thu được chứa Ba(OH)2 dư và chất rắn BaCO3.
Câu 17:
Đáp án B
Liên kết xích-ma là liên kết đơn. Liên kết đơn gồm C – C và C – H.
Số liên kết C – C là 4 – 1 = 3 liên kết.
Số liên kết C – H là 10 liên kết.
⟹ Tổng có 13 liên kết xích – ma.
Câu 18:
Đáp án A
Các chất là đồng phân của nhau khi có cùng công thức phân tử và khác nhau về công thức cấu tạo.
Các chất ở đáp án có cùng công thức phân tử là C3H8O.
Câu 19:
Đáp án D
Dẫn xuất hidrocacbon là hợp chất hữu cơ ngoài chứa nguyên tố C và H còn chứa các nguyên tố khác như O, N, S, halogen, …
Câu 20:
Đáp án B
![]()
II. Tự luận
Câu 1:
Phương trình hóa học:
N2 + 3H2 2NH3
\({n_{{N_2}}} = \frac{{2,8}}{{28}} = 0,1\,mol\)
⟹ Theo phương trình: \({n_{N{H_3}}} = 2.{n_{{N_2}}} = 2.0,1 = 0,2\,(mol)\)
Do hiệu suất phản ứng đạt 20% nên lượng NH3 sinh ra thực tế là:
\({n_{N{H_3}\,tt}} = 0,2.\frac{{20}}{{100}} = 0,04\,mol\)
Thể tích khí NH3 thu được là: V = 0,04.22,4 = 0,896 lít
Câu 2:
Ta có: m1 = m2 = \(\frac{{19,4}}{2} = 9,7\)gam
– Phần 1: Phản ứng với oxi
Số mol oxi phản ứng là: \({n_{{O_2}}} = \frac{{15,7 – 9,7}}{{32}} = 0,1875\,mol\)
Các quá trình nhường, nhận electron
Al → \(A{l^{3 + }}\)+ 3e \({O_2} + 4e \to 2\mathop O\limits^{ – 2} \)
Mg → \(M{g^{2 + }}\)+ 2e
Zn → \(Z{n^{2 + }}\)+ 2e.
Bảo toàn electron ta có:
ne nhường = ne nhận ⟹ ne nhường = 0,1875.4 = 0,75 (1)
– Phần 2: hoàn tan trong dung dịch HNO3
Các quá trình nhường, nhận electron
Al → \(A{l^{3 + }}\)+ 3e
\(2{H^ + } + NO_3^ – + e \to N{O_2} + {H_2}O\)
Mg → \(M{g^{2 + }}\)+ 2e
Zn → \(Z{n^{2 + }}\)+ 2e.
Gọi số mol khí NO2 là a mol.
Ta có: ne nhường = ne nhận ⟹ ne nhường = a (2)
Từ (1) và (2) ⟹ 0,75 = a
⟹ \({V_{N{O_2}}} = 22,4.0,75 = 16,8\)lít
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 2
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: …………………………………………………………… Lớp: ………………………..
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Cu = 64, Zn = 65)
I. TRẮC NGHIỆM (6 điểm)
Câu 1. Silic đioxit (SiO2) tan được trong dung dịch của chất nào sau đây?
A. HF. B. HNO3 đặc.
C. H2SO4 đặc. D. H3PO4.
Câu 2. Một loại nước thải công nghiệp có pH = 9. Nước thải đó có môi trường
A. bazơ. B. lưỡng tính.
C. axit. D. trung tính.
Câu 3. Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được dung dịch Y chứa 8m gam muối và x mol một chất khí duy nhất là N2O. Cho dung dịch NaOH dư vào Y, kết thúc thí nghiệm có 64,6 gam NaOH đã phản ứng. Giá trị của x gần nhất với
A. 0,148. B. 0,136.
C. 0,122. D. 0,082.
Câu 4. Khí X không màu, không mùi, rất độc nhưng được dùng trong luyện kim để khử các oxit kim loại. Khí X là
A. CO. B. H2.
C. CO2. D. NH3.
Câu 5. Nhỏ từ từ dung dịch HNO3 đến dư vào dung dịch NH4HCO3, hiện tượng xảy ra là
A. xuất hiện kết tủa trắng.
B. thoát ra khí không màu.
C. thoát ra khí mùi khai.
D. có kết tủa và sủi bọt khí.
Câu 6. Khi thực hiện phản ứng giữa dung dịch HNO3 đặc với kim loại sinh ra khí NO2 độc hại. Để hạn chế khí NO2 thoát ra gây ô nhiễm môi trường, ta phải đậy ống nghiệm bằng bông tẩm
A. nước cất. B. nước vôi.
C. giấm ăn. D. cồn y tế.
Câu 7. Thực hiện thí nghiệm với hai mẫu photpho X và Y như hình vẽ:
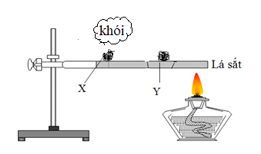
Mẫu X là
A. photpho trắng. B. photpho đỏ.
C. photpho đen. D. photpho tím.
Câu 8. Phân urê cung cấp cho cây trồng nguyên tố dinh dưỡng gì?
A. Nitơ. B. Photpho.
C. Kali. D. Canxi.
Câu 9. Ngày nay, amoniac lỏng được dùng làm chất sinh hàn trong thiết bị lạnh. Amoniac có công thức hóa học là
A. NH2. B. N2H4.
C. NH4. D. NH3.
Câu 10. Chất nào sau đây là chất điện li yếu?
A. H3PO4. B. HNO3.
C. KOH. D. Na2CO3.
Câu 11. Trong công nghiệp, axit nitric được tổng hợp từ amoniac qua ba giai đoạn với hiệu suất của toàn bộ quá trình đạt 96%. Theo quá trình trên, từ 2 tấn amoniac người ta thu được m tấn dung dịch HNO3 60%. Giá trị của m là
A. 7,41. B. 11,86.
C. 12,35. D. 12,87.
Câu 12. Dung dịch HNO3 0,0001M có pH bằng
A. 11. B. 3.
C. 10. D. 4.
Câu 13. Dung dịch X gồm 0,05 mol K+, 0,04 mol \(C{l^ – }\), 0,03 mol \(CO_3^{2 – }\) và \(NH_4^ + \). Cô cạn dung dịch X, thu được m gam chất rắn khan. Giá trị của m là:
A. 5,53. B. 6,07.
C. 5,77. D. 5,51.
Câu 14. Phản ứng Ba(OH)2 + 2HCl → BaCl2 + 2H2O có phương trình ion thu gọn là:
A. H+ + \(O{H^ – }\) → H2O.
B. Ba2+ + 2\(C{l^ – }\)→ BaCl2.
C. 2H+ + \(O{H^ – }\) → 2H2O.
D. Ba2+ + \(C{l^ – }\) → BaCl2.
Câu 15. Dẫn từ từ CO2 vào dung dịch chỉ chứa 0,025 mol Ba(OH)2. Đồ thị dưới đây biểu diễn sự phụ thuộc của số mol kết tủa BaCO3 tạo thành theo số mol CO2.
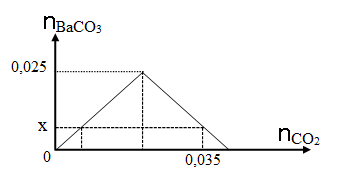
Giá trị của x là
A. 0,035. B. 0,015.
C. 0,025. D. 0,010.
Câu 16: Số liên kết xích-ma (Ϭ) trong phân tử C4H10 là:
A. 10. B. 13.
C. 12. D. 14.
Câu 17: Hợp chất X có công thức đơn giản nhất là CH2O. Tỉ khối hơi của X so với hiđro bằng 30. Công thức phân tử của X là
A. CH2O B. C2H4O2
C. C3H6O2 D. C4H8O2.
Câu 18: Hợp chất hữu cơ X (C, H, O và N) có công thức trùng với công thức đơn giản nhất, đốt cháy hoàn toàn 7,5 gam X, thu được 4,48 lít CO2; 1,12 lít N2 (các khí đều đo (đktc)) và 4,5 gam H2O. Số nguyên tử hiđro trong một phân tử X là
A. 7 B. 6
C. 5 D. 9.
Câu 19: Số công thức cấu tạo có thể có ứng với các công thức phân tử C3H8O là
A. 1 B. 2
C. 3 D. 4.
Câu 20: Trong phòng thí nghiệm người ta điều chế HNO3 từ
A. NH3 và O2.
B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc.
D. NaNO2 và HCl đặc.
II. TỰ LUẬN (4 điểm)
Câu 1 (2 điểm). Viết phương trình hóa học?
a) Viết phương trình hóa học dưới dạng phân tử và ion rút gọn của phản ứng xảy ra sau: (0,5đ)
CaCO3 + HCl
b) Viết phương trình nhiệt phân các muối trong các trường hợp sau: (1,5đ)
NH4NO3; NaNO3, MgCO3.
Câu 2 (1 điểm): Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X (C, H, O). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đựng dung dịch KOH dư. Sau thí nghiệm, khối lượng bình (1) tăng 1,8 gam, khối lượng bình (2) tăng 6,6 gam. Tỉ khối của X đối với hiđro là 44. Xác định công thức của phân tử X.
Câu 3 (1,0 điểm): Hòa tan hoàn toàn m gam Zn vào dung dịch HNO3 dư, thu được 0,448 ml khí NO (đktc, sản phẩm khử duy nhất). Tính giá trị của m.
— Hết —
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I. TRẮC NGHIỆM
|
1. A |
2. A |
3. B |
4. A |
5. B |
6. B |
7. A |
8. A |
9. D |
10. A |
|
11. B |
12. D |
13. B |
14. A |
15. B |
16. B |
17. B |
18. C |
19. C |
20. C |
Câu 1:
Đáp án A
Silic đioxit (SiO2) tan được trong dung dịch axit HF.
Phương trình hóa học:
SiO2 + 4HF → SiF4 + 2H2O
Câu 2:
Đáp án A
pH = 9 > 7 ⟹ Nước thải có môi trường bazơ.
Câu 3:
Đáp án B
Giả sử dung dịch sau phản ứng chỉ có muối nhôm.
⟹ Khối lượng khối là: \[\frac{m}{{27}}.213 \approx 7,89m < 8m\]⟹ Dung dịch còn chứa thêm muối NH4NO3.
⟹ Số mol của NH4NO3 là: \({n_{N{H_4}N{O_3}}} = \frac{{8m – 7,89m}}{{80}} = 0,001375m\)(mol)
Bảo toàn electron ta có: \(3.\frac{m}{{27}} = 8x + 0,001375m.8\) (1)
Bảo toàn Na ta có: \(4.\frac{m}{{27}} + 0,001375m = \frac{{64,6}}{{40}}\)⟹ m ≈ 10,801 gam
Thay vào (1) ⟹ x ≈ 0,13516
Câu 4:
Đáp án A
Khí X không màu, không mùi, rất độc nhưng được dùng trong luyện kim để khử các oxit kim loại.
⟹ Khí X là khí CO.
Câu 5:
Đáp án B
Nhỏ từ từ dung dịch HNO3 đến dư vào dung dịch NH4HCO3, hiện tượng xảy ra là thoát ra khí không màu.
Phương trình hóa học:
HNO3 + NH4HCO3 → NH4NO3 + CO2↑ + H2O
Câu 6:
Đáp án B
Để ngăn khí độc ta dùng hóa chất phản ứng với khí đó tạo thành chất không độc.
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm.
2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Câu 7:
Đáp án A
Photpho trắng dễ bị bốc cháy hơn photpho đỏ.
Câu 8:
Đáp án A
Phân urê cung cấp cho cây trồng nguyên tố dinh dưỡng nitơ.
Câu 9:
Đáp án D
Amoniac có công thức hóa học là NH3.
Câu 10:
Đáp án A
Chất điện li yếu là H3PO4. Phân li theo ba nấc.
Phương trình điện li:
\({H_3}P{O_4} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + {H_2}PO_4^ – \)
\({H_2}PO_4^ – \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + HPO_4^{2 – }\)
\(HPO_4^{2 – } \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + PO_4^{3 – }\)
Câu 11:
Đáp án B
Ta có:
⟹ \(x = \frac{{2.63}}{{17}} = \frac{{126}}{{17}}\)tấn
Do hiệu suất chỉ đạt 96% ⟹ Khối lượng HNO3 thực tế thu được là:
m = \(\frac{{126}}{{17}}.0,96 = \frac{{3024}}{{425}}\) ≈ 7,1153 tấn
Khối lượng dung dịch HNO3 60% thu được là:
mdd = \(\frac{{7,1153.100}}{{60}} = 11,86\)tấn
Câu 12:
Đáp án D
pH = -lg[\({H^ + }\)] = -lg(0,0001) = 4
Câu 13:
Đáp án B
Bảo toàn điện tích ta có:
\({n_{NH_4^ + }} = 0,04.1 + 0,03.2 – 0,05 = 0,05\,mol\)
Khối lượng chất rắn khan là:
m = 0,05.39 + 0,04.35,5 + 0,03.60 + 0,05.18 = 6,07 gam
Câu 14:
Đáp án A
Phương trình ion thu gọn là: H+ + \(O{H^ – }\) → H2O
Câu 15:
Đáp án B
Phương trình hóa học:
Ba(OH)2 + CO2 → BaCO3↓ + H2O (1)
BaCO3 + CO2 + H2O → Ba(HCO3)2 (2)
Khi đạt đến kết tủa cực đại thì số mol BaCO3 là 0,025 mol, khi này số mol CO2 phản ứng là 0,025 mol (Bảo toàn nguyên tố cacbon)
Khi số mol CO2 là 0,035 mol thì đã xảy ra phương trình (2).
⟹ 0,035 = 0,025 + 0,025 – x
⟹ x = 0,015 mol
Câu 16:
Đáp án B
Liên kết xích-ma là liên kết đơn.
Liên kết đơn gồm C – C và C – H.
Số liên kết C – C là 4 – 1 = 3 liên kết.
Số liên kết C – H là 10 liên kết.
⟹ Tổng có 13 liên kết xích – ma.
Câu 17:
Đáp án B
Công thức phân tử của hợp chất X có dạng (CH2O)n.
Mà MX = 30.2 = 60
⟹ 30n =60 ⟹ n = 2
⟹ Công thức phân tử của X là C2H4O2.
Câu 18:
Đáp án C
Theo bài ta có:
\({n_{C{O_2}}} = 0,2\,mol;\,{n_{{N_2}}} = 0,05\,mol;\,{n_{{H_2}O}} = 0,25\,mol\)
⟹ \({n_C} = 0,2\,mol;\,{n_N} = 0,1\,mol;\,{n_H} = 0,5\,mol\)
⟹ \({n_O} = \frac{{7,5 – 0,2.12 – 0,1.14 – 0,5.1}}{{16}} = 0,2\,mol\)
⟹ \(C:H:O:N = 2:5:2:1\)
⟹ Công thức đơn giản nhất là C2H5O2N
Mà công thức phân tử trùng công thức đơn giản nhất
⟹ Công thức phân tử là C2H5O2N.
⟹ Số nguyên tử H là 5
Câu 19:
Đáp án C
Độ bất bão hòa: \(k = \frac{{3.2 – 8 + 2}}{2} = 0\)
⟹ Phân tử chỉ có liên kết đơn.
Các công thức cấu tạo có thể có là:
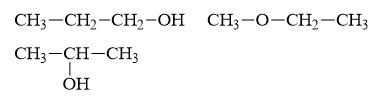
Câu 20:
Đáp án C
Trong phòng thí nghiệm thì để điều chế axit HNO3 người ta dùng NaNO3 rắn và H2SO4 đặc.
Phương trình hóa học:
NaNO3 + H2SO4 đ HNO3 + NaHSO4
II. Tự luận
Câu 1:
a) Phương trình hóa học dạng phân tử:
CaCO3 + HCl → CaCl2 + CO2↑ + H2O
Phương trình ion thu gọn là:
CaCO3 + 2\({H^ + }\)→ \(C{a^{2 + }}\)+ CO2↑ + H2O
b)
NH4NO3 N2O + 2H2O
2NaNO3 2NaNO2 + O2
2Mg(NO3)2 2MgO + 4NO2 + O2
Câu 2:
Ta có: \({m_{{H_2}O}} = 1,8\,gam \Rightarrow {n_{{H_2}O}} = 0,1\,mol\)
⟹ nH = 0,2 mol
\({m_{C{O_2}}} = 6,6\,gam \Rightarrow {n_{C{O_2}}} = \frac{{6,6}}{{44}} = 0,15\,mol\)
⟹ nC = 0,15 mol
⟹ \({n_O} = \frac{{4,4 – 0,2.1 – 0,15.12}}{{16}} = 0,15\,\,mol\)
⟹ C : H : O = 3 : 4 : 3
⟹ Công thức đơn giản nhất là C3H4O3.
⟹ Công thức phân tử dạng là (C3H4O3)n.
⟹ 88n = 88
⟹ n = 1
⟹ Công thức phân tử của X là C3H4O3.
Câu 3:
Phương trình hóa học:
3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
Ta có: \({n_{NO}} = \frac{{0,448}}{{22,4}} = 0,02\,mol\)
Bảo toàn electron ta có: 2.nZn = 3.nNO
⟹ \({n_{Zn}} = \frac{{3.0,02}}{2} = 0,03\,mol\)
⟹ Khối lượng kẽm phản ứng là: m = 0,03.65 = 1,95 gam
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 3
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: …………………………………………………………… Lớp: ………………………..
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32, Cu=64)
Câu 1: Chọn phát biểu đúng.
A. Silic có tính oxi hóa mạnh hơn cacbon.
B. Cacbon có tính oxi hóa mạnh hơn silic.
C. Silic có tính khử yếu hơn cacbon.
D. Silic và cacbon có tính oxi hóa bằng nhau.
Câu 2: Chất có thể dùng làm khô khí NH3 là
A. P2O5. B. CuSO4 khan.
C. H2SO4 đặc. D. CaO.
Câu 3: Cho các hợp chất: CaC2, CO2, HCHO, CH3COOH, C2H5OH, NaCN, CaCO3. Số hợp chất hữu cơ trong các hợp chất đã cho là:
A. 1. B. 2.
C. 4. D. 3.
Câu 4: Trong các chất sau chất nào được gọi là hiđrocacbon?
A. CH4. B. C2H6O.
C. CH3Cl. D. C12H22O11.
Câu 5: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
A. C2H5OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3CH3CH2OH, C2H5OH.
D. C4H10, C6H6.
Câu 6: Khi đốt cháy chất hữu cơ X bằng oxi không khí thu được hỗn hợp khí và hơi gồm CO2, H2O, N2. Điều đó chứng tỏ phân tử chất X
A. chắc chắn phải có các nguyên tố C, H, O, N.
B. chắc chắn phải có các nguyên tố C, H, N có thể có nguyên tố O.
C. chỉ có các nguyên tố C, H.
D. chắc chắn phải có các nguyên tố C, O, N.
Câu 7: Thuốc nổ đen là hỗn hợp
A. KNO3, C và S. B. KNO3 và S.
C. KClO3, C và S. D. KClO3 và S.
Câu 8: Sự điện li là quá trình
A. hòa tan các chất vào nước.
B. phân li ra ion của các chất trong nước.
C. phân li thành các phân tử hòa tan.
D. phân li của axit trong nước.
Câu 9: Điều khẳng định đúng là:
A. dung dịch có môi trường bazơ thì pH > 7.
B. dung dịch có môi trường trung tính thì pH < 7.
C. dung dịch có môi trường axit thì pH = 7.
D. dung dịch có môi trường trung tính thì pH > 7.
Câu 10: Trong các chất sau, chất có độ cứng lớn nhất là
A. silic. B. kim cương.
C. than chì. D. thạch anh.
Câu 11: Chất được dùng để chữa bệnh đau dạ dày là:
A. CO. B. CO2 tinh thể
C. SiO2. D. NaHCO3.
Câu 12: Những ion có thể cùng tồn tại trong một dung dịch là
A. Na+, Ca2+, \(HSO_4^ – \), \(CO_3^{2 – }\).
B. Na+, Mg2+, OH–, \(NO_3^ – \).
C. Na+, Ba2+, OH–, Cl–.
D. Ag+, H+, Cl–, \(SO_4^{2 – }\).
Câu 13: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
A. các chất phản ứng phải là chất điện li mạnh.
B. một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
C. các chất phản ứng phải là những chất dễ tan.
D. phản ứng phải là thuận nghịch.
Câu 14: Khí N2 tương đối trơ ở nhiệt độ thường là do:
A. Phân tử nitơ có liên kết ba bền vững.
B. Nitơ có bán kính nguyên tử nhỏ.
C. Nitơ có độ âm điện lớn.
D. Phân tử nitơ phân cực.
Câu 15: Cấu hình electron của nguyên tử photpho (Z = 15) là
A. 1s22s22p63s23p5. B. 1s22s22p3.
C. 1s22s22p63s23p3. D. 1s22s22p63s23p2.
Câu 16: Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhóm metylen (-CH2-) được gọi là
A. đồng phân. B. đồng vị.
C. đồng đẳng. D. đồng khối.
Câu 17: Chất được dùng để khắc chữ lên thủy tinh là
A. dung dịch H2SO4. B. dung dịch HNO3.
C. dung dịch HCl. D. dung dịch HF.
Câu 18: Phản ứng nitơ thể hiện tính khử là
A. N2 + 6Li → 2Li3N. B. N2 + 2Al → 2AlN.
C. N2 + O2 → 2NO. D. N2 + 3H2 → 2NH3.
Câu 19: Trong phản ứng sau: 4HNO3 + C → CO2 + 4NO2 + 2H2O. Cacbon là
A. chất bị khử. B. chất oxi hóa.
C. chất khử. D. chất nhận electron.
Câu 20: Công thức phân tử của phân urê là
A. (NH4)2CO3. B. NH2CO.
C. (NH2)2CO3. D. (NH2)2CO.
Câu 21: Cho phản ứng hóa học: NaOH + HCl → NaCl + H2O
Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
A. 2KOH + FeCl2 → Fe(OH)2 + 2KCl
B. NaOH + NaHCO3 → Na2CO3 + H2O
C. NaOH + NH4Cl → NaCl + NH3 + H2O
D. KOH + HNO3 → KNO3 + H2O
Câu 22: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 60,0%; %mH = 8,0%, còn lại là oxi. Tỉ khối hơi của X so với CO2 nhỏ hơn 3. Công thức phân tử của X là
A. C3H8O B. C3H8O2
C. C5H8O2 D. C5H8O.
Câu 23: Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
A. 2,44 gam B. 2,22 gam
C. 2,31 gam D. 2,58 gam.
Câu 24: Cho 2,8 gam hỗn hợp X gồm Cu và Ag phản ứng hoàn toàn với dung dịch HNO3 dư, thu được 0,04 mol NO2 (sản phẩm khử duy nhất của \(\mathop N\limits^{ + 5} \)) và dung dịch chứa m gam muối. Giá trị của m là
A. 4,48 B. 3,62
C. 3,42 D. 5,28.
Câu 25: Một loại phân supephotphat kép có chứa 69,62% muối canxi đihiđrophotphat, còn lại gồm các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là
A. 48,52% B. 42,25%
C. 39,76% D. 45,75%.
Câu 26: Cho 0,1 mol P2O5 vào dung dịch chứa 0,35 mol KOH. Dung dịch thu được có các chất:
A. K3PO4, K2HPO4
B. K2HPO4, KH2PO4
C. K3PO4, KOH
D. H3PO4, KH2PO4
Câu 27: Phản ứng nhiệt phân nào sau đây không đúng?
A. 2KNO3 2KNO2 + O2↑
B. NH4NO2 N2↑ + 2H2O
C. NH4Cl NH3 + HCl
D. NaHCO3 NaOH + CO2↑
Câu 28: Để khắc chữ lên thủy tinh người ta dựa vào phản ứng:
A. SiO2 + Na2CO3 → Na2SiO3 + CO2↑
B. SiO2 + 4HF → SiF4 + 2H2O
C. SiO2 + 2NaOH → Na2SiO3 + H2O
D. SiO2 + 2Mg → 2MgO + Si
Câu 29: Tính chất đặc biệt của kim cương là:
A. Rất mềm
B. Cản quang
C. Rất cứng
D. Có ánh kim
Câu 30: Trong thực tế, người ta thường dùng muối nào để làm xốp bánh?
A. NH4HCO3. B. BaSO4.
C. NaCl. D. NH4Cl.
— Hết —
Giám thị không giải thích thêm
Đáp án và hướng dẫn giải
|
1. B |
2. D |
3. D |
4. A |
5. A |
6. B |
7. A |
8. B |
9. A |
10. B |
|
11. D |
12. C |
13. B |
14. A |
15. C |
16. C |
17. D |
18. C |
19. C |
20. D |
|
21. D |
22. C |
23. C |
24. D |
25. B |
26. B |
27. D |
28. B |
29. C |
30. A |
Câu 1:
Trong các phản ứng thì silic thể hiện tính khử hoặc tính oxi hóa. Tính oxi hóa của silic yếu hơn của cacbon.
Đáp án B
Câu 2:
Chất làm làm khô khí NH3 phải có tác dụng hút ẩm và không phản ứng với NH3.
→ Có thể dùng CaO làm khô khí NH3.
Đáp án D
Câu 3:
Các hợp chất hữu cơ gồm HCHO, CH3COOH, C2H5OH.
→ Có 3 chất hữu cơ.
Đáp án D
Câu 4:
Hiđrocacbon là hợp chất hữu cơ chỉ chứa C và H.
Đáp án A
Câu 5:
Các chất là đồng phân của nhau khi có cùng công thức phân tử và công thức cấu tạo khác nhau.
Đáp án A
Câu 6:
Khi đốt cháy chất hữu cơ X bằng oxi không khí thu được hỗn hợp khí và hơi gồm CO2, H2O, N2 → X chắc chắn chứa các nguyên tố C, H, N và có thể có nguyên tố O.
Đáp án B
Câu 7:
Thuốc nổ đen là hỗn hợp gồm KNO3, C và S.
Đáp án A
Câu 8:
Sự điện li là quá trình các chất khi tan trong nước phân li thành các ion.
Đáp án B
Câu 9:
Dung dịch có môi trường bazo thì pH > 7.
Dung dịch có môi trường axit thì pH < 7.
Dung dịch có môi trường trung tính thì pH = 7.
Đáp án A
Câu 10:
Chất có độ cứng lớn nhất là kim cương.
Đáp án B
Câu 11:
Chất được dùng để chữa bệnh đau dạ dày là NaHCO3, chất này sẽ trung hòa bớt lượng axit trong dạ dày.
Đáp án D
Câu 12:
Những ion có thể cùng tồn tại trong một dung dịch khi chúng không phản ứng với nhau.
A. \(C{a^{2 + }} + CO_3^{2 – } \to CaC{O_3} \downarrow \)
\(2HSO_4^ – + CO_3^{2 – } \to C{O_2} \uparrow + \,2SO_4^{2 – } + {H_2}O\)
B. \(M{g^{2 + }} + 2O{H^ – } \to Mg{(OH)_2} \downarrow \)
C. Cùng tồn tại được trong 1 dung dịch.
D. \(A{g^ + } + C{l^ – } \to AgCl \downarrow \)
Đáp án C
Câu 13:
Phản ứng trao đổi ion trong dung dịch các chất điện li xảy ra khi một số ion trong dung dịch kết hợp được với nhau tạo thành một trong các loại chất sau: chất khí, chất kết tủa, chất điện li yếu.
Đáp án B
Câu 14:
Khí N2 tương đối trơ ở nhiệt độ thường là do nitơ có liên kết ba bền vững.
Đáp án A
Câu 15:
Cấu hình electron của nguyên tử photpho là 1s22s22p63s23p3.
Đáp án C
Câu 16:
Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhớm metylen (-CH2-) được gọi là đồng đẳng.
Đáp án C
Câu 17:
Dung dịch axit HF tác dụng được với SiO2 (thành phần chính của thủy tinh).
→ Dung dịch axit HF được ứng dụng để khắc chữ lên thủy tinh.
Đáp án D
Câu 18:
Nitơ thể hiện tính khử khi tác dụng với oxi.
Đáp án C
Câu 19:
Trong phản ứng này, C là chất khử còn HNO3 là chất oxi hóa.
Đáp án C
Câu 20:
Công thức của phân ure là (NH2)2CO.
Đáp án D
Câu 21:
Phương trình: NaOH + HCl → NaCl + H2O
Có phương trình ion: \(O{H^ – } + {H^ + } \to {H_2}O\)
→ Bản chất phản ứng là phản ứng trung hòa giữa kiềm và axit mạnh.
Đáp án D
Câu 22:
nC : nH : nO = \(\frac{{\% {m_C}}}{{12}}:\frac{{\% {m_H}}}{1}:\frac{{\% {m_O}}}{{16}}\)= 5 : 8 : 2
Công thức đơn giản nhất: C5H8O2 ⇒ Công thức phân tử: (C5H8O2)n
MX = (5.12 + 8 + 16.2).n < 44.3 ⇒ n < 1,4
⇒ n = 1 ⇒ Công thức phân tử: C5H8O2.
Đáp án C
Câu 23:
\[\begin{array}{l}{n_{C{O_2}}}\; = 0,015{\rm{ }}mol;{\rm{ }}{n_{NaOH}} = {n_{KOH}}{\rm{ = }}0,02{\rm{ }}mol\\ \to \sum {{n_{O{H^ – }}}} = 0,02 + 0,02 = 0,04\,mol\end{array}\]
Ta có: \(\frac{{{n_{O{H^ – }}}}}{{{n_{C{O_2}}}}} = \frac{{0,04}}{{0,15}} > 2\) => Chỉ tạo muối \(CO_3^{2 – }\)
Bảo toàn nguyên tố C:
\({n_{CO_3^{2 – }}} = {n_{C{O_2}}} = 0,015\,mol\)
\[{n_{O{H^ – }}}\] dư =\(\sum {{n_{O{H^ – }}}} \)– \[{n_{O{H^ – }}}\]pư = 0,04 – 2.0,015 = 0,01
mc/rắn =\({m_{CO_3^{2 – }}}\) + mK+ + mNa+ + \[{m_{O{H^ – }}}\]dư
= 0,015.60 + 0,02.39 + 0,02.23 + 0,01.17 = 2,31g
Đáp án C
Câu 24:
Quá trình nhận electron
2HNO3 + 1e → NO2 +\(NO_3^ – \) + H2O
→ \({n_{NO_3^ – }} = {n_{N{O_2}}} = 0,04\,mol\)
mmuối = mKL + 62.\({n_{NO_3^ – }}\) = 2,8 + 62.0,04 = 5,28 gam
Đáp án D
Câu 25:
Giả sử tính trong 100 gam phân thì khối lượng của muối canxi đihiđrophotphat là:
\(m = 100.\frac{{69,62}}{{100}} = 69,62\,gam\)
\[\begin{array}{*{20}{l}}{Ca{{({H_2}P{O_4})}_2}\; \to {\rm{ }}{P_2}{O_5}}\\\begin{array}{l}234\,gam{\rm{ }}\;\;\;\;\;\;{\rm{ }} \to 142\,gam\\69,62\,gam\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\,gam\end{array}\end{array}\]
\( \to x = \frac{{69,62.142}}{{234}} \approx 42,25\,gam\)
⇒ Độ dinh dưỡng của phân lân này là \(\frac{{24,25}}{{100}}.100\% = 42,25\% \)
Đáp án B
Câu 26:
P2O5 + 3H2O → 2H3PO4
→ \({n_{{H_3}P{O_4}}} = 2{n_{{P_2}{O_5}}} = 0,2\,mol\)
Ta thấy: \(1 < \frac{{{n_{KOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,35}}{{0,2}} = 1,75 < 2\)
Dung dịch thu được có các muối KH2PO4 và K2HPO4.
Đáp án B
Câu 27:
2NaHCO3 Na2CO3 + CO2↑ + H2O
Đáp án D
Câu 28:
Để khắc chữ lên thủy tinh người ta dựa vào phản ứng:
SiO2 + 4HF → SiF4 + 2H2O
Đáp án B
Câu 29:
Tính chất đặc biệt của kim cương là rất cứng nên được dùng làm mũi khoan, dao cắt kính, …
Đáp án C
Câu 30:
Trong thực tế, người ta thường dùng muối NH4HCO3 để làm xốp bánh.
Đáp án A
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 4
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: …………………………………………………………… Lớp: ………………………..
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32, Cu=64)
Câu 1: Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
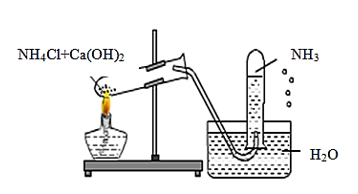
A. NH3 không được điều chế từ NH4Cl và Ca(OH)2.
B. NH3 không được thu bằng phương pháp đẩy nước mà là đẩy không khí.
C. Thí nghiệm trên xảy ra ở điều kiện thường nên không cần nhiệt độ.
D. Ống nghiệm phải để hướng xuống chứ không phải hướng lên.
Câu 2: Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của:
A. N B. K2O
C. P D. P2O5
Câu 3: Sục V lít CO2 (đkc) vào 100 ml dung dịch Ca(OH)2 2M thu được 10 gam kết tủa. V có giá trị là:
A. 2,24 lít hoặc 6,72 lít.
B. 2,24 lít.
C. 6,72 lít.
D. 2,24 lít hoặc 4,48 lít.
Câu 4: Hiđroxit nào sau đây không phải là hiđroxit lưỡng tính:
A. Cr(OH)3.
B. Al(OH)3.
C. Zn(OH)2.
D. Ba(OH)2.
Câu 5: Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là:
A. 2,24 lít. B. 11,2 lít.
C. 4,48 lít. D. 6,72 lít.
Câu 6: Cho dãy các chất sau: Al, NaHCO3, (NH4)2CO3, NH4Cl, Al2O3, Zn, K2CO3, K2SO4. Có bao nhiêu chất trong dãy vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH?
A. 5. B. 2.
C. 3. D. 4.
Câu 7: Cho N (Z = 7). Cấu hình electron của nitơ là?
A. 1s22s22p4.
B. 1s22s22p6.
C. 1s22s22p3.
D. 1s22s22p5.
Câu 8: Photpho trắng được bảo quản bằng cách ngâm trong:
A. benzen. B. ete.
C. dầu hoả. D. nước.
Câu 9: “Nước đá khô” không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là:
A. H2O rắn. B. CO2 rắn.
C. SO2 rắn. D. CO rắn.
Câu 10: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 đun nóng, sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là:
A. Al2O3, Cu, MgO, Fe.
B. Al; Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe.
D. Al2O3, Cu, MgO, Fe2O3.
Câu 11: Khi cho quỳ tím vào dung dịch HCl 0,10M thì quỳ tím đổi sang màu:
A. vàng. B. xanh.
C. trắng. D. đỏ.
Câu 12: Phân đạm giúp cho cây phát triển nhanh, cho nhiều hạt, củ, quả. Hiện nay người ta chủ yếu sử dụng đạm urê để bón cho cây trồng. Công thức phân tử của đạm urê là:
A. NaNO3. B. (NH2)2CO.
C. NH4NO3. D. NH4Cl.
Câu 13: Một dung dịch có nồng độ [\(O{H^ – }\)] = 2,5.10-10 mol/l. Môi trường của dung dịch này là:
A. Kiềm.
B. Axit.
C. Trung tính
D. Lưỡng tính.
Câu 14: Những kim loại nào sau đây không tác dụng được với dung dịch HNO3 đặc, nguội?
A. Fe, Al B. Zn, Pb
C. Mn, Ni D. Cu, Ag
Câu 15: Chất nào sau đây không dẫn điện được?
A. Nước ở hồ, nước mặn.
B. Nước biển.
C. KCl rắn, khan.
D. Dung dịch KCl trong nước.
Câu 16: Dung dịch X có chứa a mol Na+, b mol Mg2+, c mol \(C{l^ – }\) và d mol \(SO_4^{2 – }\). Biểu thức nào sau đây đúng:
A. a + b = c + d.
B. a + 2b = c + 2d.
C. a + 2b = c + d.
D. a + 2b = – c – 2d.
Câu 17: Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Hiện tượng xảy ra là?
A. có kết tủa trắng.
B. không có hiện tượng.
C. có mùi khai bay lên và có kết tủa trắng.
D. có khí mùi khai bay lên.
Câu 18: Cho 20 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Hỏi muối nào được tạo thành? Khối lượng là bao nhiêu?
A. Na3PO4: 50 gam.
B. Na2HPO4: 14,2 gam và Na3PO4: 49,2 gam.
C. Na3PO4: 50 gam và Na2HPO4: 22,5 gam.
D. NaH2PO4: 36 gam và Na2HPO4: 14,2 gam.
Câu 19: Cho các phản ứng hóa học sau:
(1) (NH4)2SO4 + BaCl2 →
(2) CuSO4 + Ba(NO3)2 →
(3) Na2SO4 + BaCl2 →
(4) H2SO4 + BaSO3 →
(5) (NH4)2SO4 + Ba(OH)2 →
(6) Fe2(SO4)3 + Ba(NO3)2 →
Dãy gồm các phản ứng có cùng một phương trình ion thu gọn là:
A. (1), (3), (5), (6).
B. (3), (4), (5), (6).
C. (2), (3), (4), (6).
D. (1), (2), (3), (6).
Câu 20: Để phân biệt các dung dịch riêng biệt gồm NaOH, NaCl, BaCl2, Ba(OH)2 chỉ cần dùng thuốc thử
A. H2O và CO2.
B. quỳ tím.
C. dung dịch H2SO4.
D. dung dịch (NH4)2SO4.
Câu 21: Cho cân bằng hoá học: N2 (k) + 3H2 (k) ⇄ 2NH3 (k). Phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi:
A. thay đổi áp suất của hệ.
B. thay đổi nồng độ N2.
C. thay đổi nhiệt độ.
D. thêm chất xúc tác Fe.
Câu 22: Phản ứng nhiệt phân không đúng là:
A. 2KNO3 2KNO2 + O2.
B. NH4NO3 N2 + 2H2O.
C. NH4Cl NH3 + HCl.
D. 2NaHCO3 Na2CO3 + CO2 + H2O.
Câu 23: Nhận định nào sau đây về muối cacbonat là đúng: Tất cả muối cacbonat đều
A. tan trong nước
B. bị nhiệt phân tạo ra oxit kim loại và cacbon đioxit.
C. không tan trong nước.
D. bị nhiệt phân trừ muối cacbonat của kim loại kiềm.
Câu 24: Tổng số liên kết π và vòng ứng với công thức C5H12O2 là:
A. 2
B. 0
C. 3
D. 1
Câu 25: Hai khoáng vật của photpho là:
A. apatit và photphorit.
B. photphorit và đolomit.
C. photphorit và cacnalit.
D. apatit và đolomit.
Câu 26: Dung dịch X chứa 0,1 mol \(N{a^ + }\); 0,2 mol \(B{a^{2 + }}\); 0,15 mol \(C{l^ – }\) và y mol \(O{H^ – }\). Khối lượng chất rắn thu được sau khi cô cạn dung dịch X bằng (giả sử chỉ có nước bay hơi)
A. 40,975 gam
B. 37,575 gam
C. 64,975 gam
D. 57,675 gam
Câu 27: Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8 đun nóng X thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là
A. 50%
B. 40%
C. 25%
D. 36%.
Câu 28: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 60,0%; %mH = 8,0%, còn lại là oxi. Tỉ khối hơi của X so với CO2 nhỏ hơn 3. Công thức phân tử của X là
A. C3H8O
B. C3H8O2
C. C5H8O2
D. C5H8O.
Câu 29: Đốt cháy hoàn toàn 100 ml hợp chất hữu cơ X, cần hết 300 ml O2, thu được 200 ml CO2 và 300 ml hơi nước. Các khí được đo ở cùng nhiệt độ, áp suất. Công thức phân tử của X là
A. C2H6O
B. C2H6O2
C. C2H4O
D. C3H6O2.
Câu 30: Phát biểu nào dưới đây không đúng?
A. SiO2 là oxit axit.
B. dung dịch đậm đặc của NaSiO3 và K2SiO3 được gọi là thủy tinh lỏng.
C. Sục khí CO2 vào dung dịch Ca(OH)2 dư, dung dịch bị vẩn đục.
D. SiO2 tan tốt trong dung dịch HCl.
— Hết —
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1. B |
2. D |
3. A |
4. D |
5. C |
6. A |
7. C |
8. D |
9. B |
10. A |
|
11. D |
12. B |
13. B |
14. A |
15. C |
16. B |
17. C |
18. D |
19. D |
20. D |
|
21. D |
22. B |
23. D |
24. B |
25. A |
26. A |
27. C |
28. C |
29. A |
30. D |
Câu 1:
NH3 tan rất tốt trong nước, nên không được thu bằng phương pháp đẩy nước mà phải thu bằng phương pháp đẩy không khí và ống nghiệm phải úp xuống vì NH3 nhẹ hơn không khí.
Đáp án B
Câu 2:
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của P2O5.
Đáp án D
Câu 3:
\[\begin{array}{*{20}{l}}{{n_{Ca{{(OH)}_2}}}\; = 0,1.\,2 = 0,2{\rm{ }}mol}\\{{n_{CaC{O_3}}}{\rm{ = }}\frac{{10}}{{100}} = 0,1{\rm{ }}mol}\end{array}\]
* TH1: Ca(OH)2 dư, dung dịch sau phản ứng chỉ chứa 1 muối
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
Bảo toàn nguyên tố C: ![]()
\({V_{C{O_2}}}\)= 0,1. 22,4 = 2,24 lít
* TH2: Dung dịch sau phản ứng chứa hai muối
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O (2)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (3)
Ta có: \({n_{CaC{O_3}}} = {n_{O{H^ – }}} – {n_{C{O_2}}}\)
\( \to {n_{C{O_2}}} = {n_{O{H^ – }}} – {n_{CaC{O_3}}}\)= 0,2.2 – 0,1 = 0,3 mol
=> \({V_{C{O_2}}}\)= 0,3.22,4 = 6,72 lít
Đáp án A
Câu 4:
Các hiđroxit lưỡng tính thường gặp như Al(OH)3, Zn(OH)2, Cr(OH)3,…
Ba(OH)2 là 1 bazơ mạnh.
Đáp án D
Câu 5:
mFe phản ứng = 20 – 3,2 = 16,8 gam
\[{n_{Fe}} = \frac{{16,8}}{{56}} = 0,3{\rm{ }}mol\]
Sau phản ứng Fe còn dư nên muối thu được là muối sắt (II).
Áp dụng định luật bảo toàn electron:
\[2\,.\,{n_{Fe}} = 3.\,{n_{NO}} \to {n_{NO}} = \frac{{2.{n_{Fe}}}}{3} = 0,2\,mol\]
VNO = 0,2.22,4 = 4,48 lít
Đáp án C
Câu 6:
Các chất tác dụng được với dung dịch NaOH và HCl là:
Al, NaHCO3, (NH4)2CO3, Al2O3, Zn.
Đáp án A
Câu 7:
Cấu hình electron của nitơ là 1s22s22p3.
Đáp án C
Câu 8:
Photpho trắng được bảo quản bằng cách ngâm trong nước.
Đáp án D
Câu 9:
Nước đá khô là CO2 hóa rắn.
Đáp án B
Câu 10:
CO khử được những oxit kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại.
Đáp án A
Câu 11:
Dung dịch HCl 0,1M có môi trường axit nên làm quỳ tím hóa đỏ.
Đáp án D
Câu 12:
Công thức hóa học của phân đạm urê là (NH2)2CO.
Đáp án B
Câu 13:
[\(O{H^ – }\)] < \({10^{ – 7}}\)
=> Môi trường axit
Đáp án B
Câu 14:
Các kim loại Fe, Al không tác dụng với axit H2SO4 đặc nguội.
Đáp án A
Câu 15:
KCl rắn, khan không dẫn được điện, nhưng dung dịch KCl trong nước hoặc KCl nóng chảy sẽ dẫn được điện.
Đáp án C
Câu 16:
Áp dụng định luật bảo toàn điện tích ta có:
a + 2b = c + 2d
Đáp án B
Câu 17:
Phương trinh hóa học:
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
=> Có mùi khai bay lên (NH3) và có kết tủa trắng BaSO4.
Đáp án C
Câu 18:
\[\begin{array}{*{20}{l}}{{n_{NaOH}} = \frac{{20}}{{40}} = 0,5{\rm{ }}mol}\\{{n_{{H_3}P{O_4}}}\; = \frac{{39,2}}{{98}} = 0,4{\rm{ }}mol}\end{array}\]
Ta có: \[\frac{{{n_{O{H^ – }}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,5}}{{0,4}} = 1,25\]
=> Sau phản ứng chất thu được là: Na2HPO4 và NaH2PO4
Ta có phương trình:
2NaOH + H3PO4 → Na2HPO4 + 2H2O (1)
NaOH + H3PO4 → NaH2PO4 + H2O (2)
Gọi số mol Na2HPO4; NaH2PO4 lần lượt là x, y
=> Ta có hệ phương trình:
\[\left\{ {\begin{array}{*{20}{l}}{x{\rm{ }} + {\rm{ }}y{\rm{ }} = {\rm{ }}0,4}\\{2x{\rm{ }} + {\rm{ }}y{\rm{ }} = {\rm{ }}0,5}\end{array}} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,1\\y = 0,3\end{array} \right.(mol)\]
\[\begin{array}{*{20}{l}}{{m_{N{a_2}HP{O_4}}}\; = 0,1.142 = 14,2{\rm{ }}gam}\\{{m_{Na{H_2}P{O_4}}}\; = 0,3.120 = 36{\rm{ }}gam}\end{array}\]
Đáp án D
Câu 19:
Phương trình ion của các phương trình:
(1) \(SO_4^{2 – } + B{a^{2 + }} \to B{\rm{aS}}{O_4} \downarrow \)
(2) \(SO_4^{2 – } + B{a^{2 + }} \to B{\rm{aS}}{O_4} \downarrow \)
(3) \(SO_4^{2 – } + B{a^{2 + }} \to B{\rm{aS}}{O_4} \downarrow \)
(4) \(2{H^ + } + SO_4^{2 – } + BaS{O_3} \to BaS{O_4} \downarrow + S{O_2} \uparrow + {H_2}O\)
(5) \(NH_4^ + + SO_4^{2 – } + B{a^{2 + }} + O{H^ – } \to \)\(N{H_3} + BaS{O_4} \downarrow + {H_2}O\)
(6) \(SO_4^{2 – } + B{a^{2 + }} \to B{\rm{aS}}{O_4} \downarrow \)
Đáp án D
Câu 20:
|
|
NaOH |
NaCl |
BaCl2 |
Ba(OH)2 |
|
(NH4)2SO4 |
Xuất hiện khí có mùi khai |
Không hiện tượng |
Xuất hiện kết tủa trắng |
Xuất hiện kết tủa trắng và khí có mùi khai bay ra |
Đáp án D
Câu 21:
Cân bằng hóa học không bị dịch chuyển khi thêm chất xúc tác Fe vì chất xúc tác chỉ có tác dụng làm phản ứng nhanh đạt đến trạng thái cân bằng.
Đáp án D
Câu 22:
NH4NO3 N2O + 2H2O
Đáp án B
Câu 23:
Tất cả muối cacbonat đều bị nhiệt phân trừ muối cacbonat của kim loại kiềm.
Đáp án D
Câu 24:
Tổng số liên kết π + Vòng = \(\frac{{5.2 – 12 + 2}}{2} = 0\)
Đáp án B
Câu 25:
Hai khoáng vật của photpho là apatit và photphorit.
Đáp án A
Câu 26:
Áp dụng định luật bảo toàn điện tích ta có:
0,1.1 + 0,2.2 = 0,15.1 + y.1 → y = 0,35 mol
Khối lượng chất rắn thu được là:
\(m = {m_{N{a^ + }}} + {m_{B{a^{2 + }}}} + {m_{C{l^ – }}} + {m_{O{H^ – }}}\)
= 0,1.23 + 0,2.137 + 0,15.35,5 + 0,35.17 = 40,975 gam
Đáp án A
Câu 27:
Ta có: \[\frac{{{n_X}}}{{{n_Y}}} = \frac{{{{\overline M }_Y}}}{{{{\overline M }_X}}} = \frac{{4.2}}{{4.1,8}} = \frac{{10}}{9}\]
Giả sử nX = 10 mol, nY = 9 mol
\(\frac{{{n_{{N_2}}}}}{{{n_{{H_2}}}}} = \frac{{4.1,8 – 2}}{{28 – 4.1,8}} = \frac{1}{4}\) → \({n_{{N_2}}} = 2\,mol;\,{n_{{H_2}}} = \,\,8\,mol\)
→ Hiệu suất tính theo N2.
→ 2 – x + 8 – 3x + 2x = 9
→ x = 0,5
Hiệu suất của phản ứng là: \(H = \frac{{0,5}}{2}.100\% = 25\% \)
Đáp án C
Câu 28:
nC : nH : nO = \(\frac{{\% {m_C}}}{{12}}:\frac{{\% {m_H}}}{1}:\frac{{\% {m_O}}}{{16}}\)= 5 : 8 : 2
Công thức đơn giản nhất: C5H8O2 ⇒ Công thức phân tử: (C5H8O2)n
MX = (5.12 + 8 + 16.2).n < 44.3 ⇒ n < 1,4
⇒ n = 1 ⇒ Công thức phân tử: C5H8O2.
Đáp án C
Câu 29:
Phương trình đốt cháy:
Bảo toàn nguyên tố C: 100x = 200 ⇒ x = 2
Bảo toàn nguyên tố H: 100y = 300.2 ⇒ y = 6
Bảo toàn nguyên tố C: 100z + 300.2 = 200.2 + 200.1 ⇒ z = 1
⇒ Công thức phân tử: C2H6O.
Đáp án A
Câu 30:
SiO2 không tan trong axit HCl.
Đáp án D
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 5
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 5)
I. TRẮC NGHIỆM KHÁCH QUAN (6 ĐIỂM, từ câu 1 – 18)
Câu 1: Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
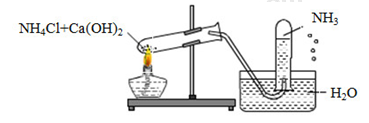
A. NH3 không được điều chế từ NH4Cl và Ca(OH)2.
B. NH3 không được thu bằng phương pháp đẩy nước mà là đẩy không khí.
C. Thí nghiệm trên xảy ra ở điều kiện thường nên không cần nhiệt độ.
D. Ống nghiệm phải để hướng xuống chứ không phải hướng lên.
Câu 2: Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của :
A. N B. K2O
C. P D. P2O5
Câu 3: Sục V lít CO2(đkc) vào 100ml dung dịch Ca(OH)2 2M thu được 10 gam kết tủa.V có giá trị là:
A. 2,24 lít hoặc 6,72 lít.
B. 2,24 lít.
C. 6,72 lít.
D. 2,24 lít hoặc 4,48 lít.
Câu 4: Hiđroxit nào sau đây không phải là hiđroxit lưỡng tính:
A. Cr(OH)3. B. Al(OH)3 .
C. Zn(OH)2. D. Ba(OH)2.
Câu 5: Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
A. 2,24 lít. B. 11,2 lít.
C. 4,48 lít. D. 6,72 lít.
Câu 6: Cho dãy các chất sau: Al, NaHCO3, (NH4)2CO3, NH4Cl, Al2O3, Zn, K2CO3, K2SO4. Có bao nhiêu chất trong dãy vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH?
A. 5. B. 2.
C. 3. D. 4.
Câu 7: Cho N (Z = 7). Cấu hình electron của Nitơ là?
A. 1s22s22p4.
B. 1s22s22p6.
C. 1s22s22p3 .
D. 1s22s22p5.
Câu 8: Photpho trắng được bảo quản bằng cách ngâm trong:
A. benzen. B. ete.
C. dầu hoả. D. nước.
Câu 9: “Nước đá khô” không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là:
A. H2O rắn. B. CO2 rắn.
C. SO2 rắn. D. CO rắn.
Câu 10: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 đun nóng, sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là:
A. Al2O3, Cu, MgO, Fe .
B. Al; Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe.
D. Al2O3, Cu, MgO, Fe2O3.
Câu 11: Khi cho quỳ tím vào dung dịch HCl 0,10M thì quỳ tím đổi sang màu:
A. vàng. B. xanh.
C. trắng. D. đỏ.
Câu 12: Phân đạm giúp cho cây phát triển nhanh, cho nhiều hạt, củ, quả. Hiện nay người ta chủ yếu sử dụng đạm urê để bón cho cây trồng. Công thức phân tử của đạm urê là:
A. NaNO3. B. (NH2)2CO.
C. NH4NO3. D. NH4Cl.
Câu 13: Một dung dịch có nồng độ [OH–] = 2,5.10-10 mol/l. Môi trường của dung dịch này là:
A. Kiềm.
B. Axit.
C. Trung tính
D. Lưỡng tính.
Câu 14: Những kim loại nào sau đây không tác dụng được với dung dịch HNO3 đặc, nguội
A. Fe, Al B. Zn, Pb
C. Mn, Ni D. Cu, Ag
Câu 15: Chất nào sau đây không dẫn điện được?
A. Nước ở hồ, nước mặn.
B. Nước biển.
C. KCl rắn, khan.
D. Dung dịch KCl trong nước.
Câu 16: Dung dịch X có chứa a mol Na+, b mol Mg2+, c mol Cl– và d mol SO42-. Biểu thức nào sau đây đúng:
A. a + b = c + d.
B. a + 2b = c + 2d.
C. a + 2b = c + d.
D. a + 2b = – c – 2d.
Câu 17: Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Hiện tượng xảy ra là?
A. có kết tủa trắng.
B. không có hiện tượng.
C. có mùi khai bay lên và có kết tủa trắng.
D. có khí mùi khai bay lên.
Câu 18: Cho 20 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Hỏi muối nào được tạo thành? Khối lượng là bao nhiêu ?
A. Na3PO4: 50 gam.
B. Na2HPO4: 14,2 gam và Na3PO4: 49,2 gam.
C. Na3PO4: 50 gam và Na2HPO4: 22,5 gam.
D. NaH2PO4: 36 gam và Na2HPO4: 14,2 gam.
II. PHẦN TỰ LUẬN (4 điểm)
Câu 1: (2,0 điểm) Viết phương trình hóa học theo sơ đồ sau, ghi rõ điều kiện (nếu có):

Câu 2: (2,0 điểm) Khi cho 3,32 gam hỗn hợp Fe và Cu tác dụng hoàn toàn với 400 ml dung dịch HNO3 0,5M thu được 1,008 lít khí NO duy nhất (đktc).
a) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu ?
b) Tính nồng độ mol của axit HNO3 trong dung dịch sau phản ứng ? Biết thể tích dung dịch không đổi.
Lời giải chi tiết
|
1 |
2 |
3 |
4 |
5 |
|
B |
D |
A |
D |
C |
|
6 |
7 |
8 |
9 |
10 |
|
A |
C |
D |
B |
A |
|
11 |
12 |
13 |
14 |
15 |
|
D |
B |
B |
A |
C |
|
16 |
17 |
18 |
|
|
|
B |
C |
D |
||
Câu 1:
NH3 tan rất tốt trong nước, nên không được thu bằng phương pháp đẩy nước
Đáp án B
Câu 2:
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của P2O5
Đáp án D
Câu 3:
n Ca(OH)2 = 0,1 .2 = 0,2 mol
n CaCO3 = 10 : 100 = 0,1 mol
* TH1
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
(1) n CaCO3 = n CO2 = 0,1 mol
V CO2 = 0,1 . 22,4 = 2,24 lit
* TH2
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O (2)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (3)
(2) n CO2 = n Ca(OH)2 = n CaCO3 = 0,1 mol
(3) n Ca(OH)2 = 0,2 – 0,1 = 0,1 mol
(3) n CO2 = 2 . n Ca(OH)2 = 0,2 mol
=> V CO2 = (0,1 + 0,2) , 22,4 = 6,72 lít
Đáp án A
Câu 4:
Đáp án D
Câu 5:
m Fe phản ứng = 20 – 3,2 = 16,8 gam
n Fe = 16,8 : 56 = 0,3 mol
Sau phản ứng Fe còn dư nên muối thu được là muối sắt (II)
Áp dụng định luật bảo toàn electron:
2 . n Fe = 3 . n NO
=> 2 .0,3 = 3 . n NO
=> n NO = 0,2 mol
V NO = 0,2 . 22,4 = 4,48 lít
Đáp án C
Câu 6:
Các chất tác dụng được với dung dịch NaOH và HCl là:
Al, NaHCO3,(NH4)2CO3, Al2O3, Zn
Đáp án A
Câu 7:
Đáp án C
Câu 8:
Photpho trắng được bảo quản bằng cách ngâm trong nước
Đáp án D
Câu 9:
Đáp án B
Câu 10:
CO khử được những oxit kim loại đứng sau Al
Đáp án A
Câu 11:
Đáp án D
Câu 12:
Đáp án B
Câu 13:
[OH–] < 10-7
=> Môi trường axit
Đáp án B
Câu 14:
Đáp án A
Câu 15:
Đáp án C
Câu 16:
Áp dụng định luật bảo toàn điện tích ta có:
a + 2b = c + 2d
Đáp án B
Câu 17:
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3 + 2H2O
=> Có mùi khai bay lên (NH3) và có kết tủa trắng BaSO4
Đáp án C
Câu 18:
n NaOH = 20 : 40 = 0,5 mol
n H3PO4 = 39,2 : 98 = 0,4 mol
Ta có : n OH : n H3PO4 = 0,5 : 0,4 = 1,25
=> Sau phản ứng chất thu được là: Na2HPO4 và NaH2PO4
Ta có phương trình:
2NaOH + H3PO4 → Na2HPO4 + 2H2O (1)
NaOH + H3PO4 → NaH2PO4 + H2O (2)
Gọi số mol Na2HPO4; NaH2PO4 lần lượt là x, y
=> Ta có hệ phương trình:
x + y = 0,4
2x + y = 0,5
=> x = 0,1 mol; y = 0,3 mol
m Na2HPO4 = 0,1 . 142 = 14,2 gam
m NaH2PO4 = 0,3 . 120 = 36 gam
Đáp án D
II. TỰ LUẬN
Câu 1
(1) N2 + O2 2NO
(2) 2NO + O2 → 2NO2
(3) 4NO2 + O2 + 2H2O → 4HNO3
(4) 6HNO3 + Fe2O3 → 2Fe(NO3)3 + 3H2O
Câu 2
nHNO3 bđ = 0,4.0,5 = 0,2 mol
nNO = 1,008/22,4 = 0,045 mol
Đặt nFe = x mol và nCu = y mol
a) Khối lượng của hỗn hợp là 3,32 gam nên ta có: 56x + 64y = 3,32 (1)
Ta có quá trình cho – nhận e:
Fe0 – 3e → Fe+3
x → 3x (mol)
Cu0 – 2e → Cu+2
y → 2y (mol)
N+5 + 3e → N+2
0,135←0,045 (mol)
Theo định luật bảo toàn e ta có: 3x + 2y = 0,135 (2)
Từ (1) và (2) ta có hệ phương trình:
b) BT “N”: nHNO3 sau pư = nHNO3 bđ – 3nFe(NO3)3 – 2nCu(NO3)2 – nNO
= 0,2 – 3.0,025 – 2.0,03 – 0,045 = 0,02 mol
=> CM HNO3 sau pư = n/V = 0,02/0,4 = 0,05 M
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 6
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 6)
Câu 1: Tổng hệ số cân bằng của các chất tham gia trong phản ứng sau là:
Mg + HNO3 → Mg(NO3)2 + N2O↑ + H2O
A. 24. B. 38.
C. 14. D. 10.
Câu 2: Phương trình điện li nào sau đây viết đúng?
A. H2SO3 → 2H+ + SO32-
B. Na2S → 2Na+ + S2-
C. H2CO3 2H+ + CO32-
D. H2SO4 2H+ + SO42-
Câu 3: Kết luận nào sau đây không đúng?
A. Sự điện li là sự phân li ra ion của các chất khi tan trong nước hoặc ở trạng thái nóng chảy
B. Dung dịch các chất điện li dẫn được điện
C. Chất khi tan trong nước hoặc ở trạng thái nóng chảy phân li thành ion gọi là chất điện li
D. Chất điện li mạnh là chất tan hoàn toàn trong nước
Câu 4: Axit HNO3 là một axit
A. yếu. B. mạnh.
C. rất yếu. D. trung bình.
Câu 5: Đối với dung dịch axit yếu CH3COOH 0,1M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion nào sau đây là đúng?
A. [H+] < [CH3COO–]
B. [H+] < 0,1M
C. [H+] = 0,1M
D. [H+] > [CH3COO–]
Câu 6: Nước đá khô là khí nào sau đây ở trạng thái rắn:
A. CO2 B. SO2
C. CO D. NO2
Câu 7: Hợp chất nào sau đây là hợp chất hữu cơ?
A. CaCO3 B. CO
C. CH4 D. CaC2
Câu 8: Chất nào sau đây khi tan trong nước, các phân tử hòa tan đều phân li thành ion?
A. H2CO3 B. CH3COOH
C. NaOH D. HF
Câu 9: Tiến hành các thí nghiệm sau ở điều kiện thường:
(a) Sục khí SO2 vào dung dịch H2S.
(b) Sục khí F2 vào nước.
(c) Cho KMnO4 vào dung dịch HCl đặc.
(d) Sục khí CO2 vào dung dịch NaOH.
(e) Cho Si vào dung dịch NaOH.
(g) Cho Na2SO3 vào dung dịch H2SO4.
(h) C + H2O(hơi) ở nhiệt độ cao.
(i) Nung Cu(NO3)2.
(k) Dẫn CO qua FeO nung nóng.
Số thí nghiệm có sinh ra đơn chất là
A. 6. B. 5.
C. 7. D. 8.
Câu 10: Khí CO không khử được chất nào sau đây ở nhiệt độ cao:
A. CaO B. CuO
C. PbO D. ZnO
Câu 11: Khử hoàn toàn 14g hỗn hợp X gồm CuO và một oxit sắt bằng CO thu được 10,32g hỗn hợp Y gồm 2 kim loại. Thể tích CO (đktc) đã dùng cho quá trình trên là:
A. 10,304 lít
B. 1,0304 lít
C. 5,152 lít
D. 51,52 lít
Câu 12: Muối được sử dụng làm bột nở cho bánh quy xốp là muối nào sau đây?
A. NaHCO3.
B. NH4HCO3
C. Na2CO3.
D. (NH4)2CO3.
Câu 13: Cho các chất: nhôm cacbua (Al4C3), axetilen (C2H2), natri cacbonat (Na2CO3), đường saccarozơ (C12H22O11), PVC ([C2H3Cl]n). Số chất không phải là hợp chất hữu cơ là
A. 2 B. 1
C. 4 D. 3
Câu 14: Đốt cháy hoàn toàn 20 ml hợp chất hữu cơ M bằng vừa đủ 105 ml khí oxi, sản phẩm cháy thu được gồm 80 ml khí CO2, 90 ml hơi H2O, 10 ml N2. Biết các thể tích đo ở cùng điều kiện nhiệt độ, áp suất, nhiệt độ. Công thức phân tử của M là (cho nguyên tử khối của các nguyên tố C = 12; H=1; O = 16; N = 14)
A. C4H10O2N2
B. C3H7O2N
C. C4H7O2N
D. C4H9O2N
Câu 15: Thành phần của dung dịch NH3 gồm:
A. NH3, NH4+ và OH‑.
B. NH3 và H2O.
C. NH4+, OH–, NH3 và H2O.
D. NH4+ và OH.
Câu 16: Dung dịch BaCl2 2M có nồng độ mol/l của anion là
A. 4M B. 1M
C. 2M D. 0,5M
Câu 17: Ở nhiệt độ thường, nitơ phản ứng được với:
A. Li B. Cl2
C. Pb D. F2
Câu 18: Phát biểu nào dưới đây không đúng:
A. Dung dịch NH3 là 1 bazơ yếu.
B. Đốt cháy NH3 không có xúc tác thu được N2 và H2O.
C. NH3 là chất khí không màu, không mùi, tan nhiều trong nước.
D. Phản ứng tổng hợp NH3 là phản ứng thuận nghịch.
Câu 19: Hấp thụ hoàn toàn 3,36 lít khí CO2 (điều kiện tiêu chuẩn) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2 thu được m gam kết tủa. Giá trị của m là
A. 9,850. B. 19,700.
C. 29,550. D. 14,775.
Câu 20: Cacbon phản ứng với tất cả các chất nào sau đây?
A. Al, HNO3 đặc, KClO3
B. Na2O, NaOH, HCl
C. NH4Cl, KOH, AgNO3
D. Ba(OH)2, Na2CO3, CaCO3
Câu 21: Cặp chất nào sau đây tác dụng với nhau đều tạo ra sản phẩm đều là chất khí?
A. CO2 và NaOH
B. C và HNO3 đặc
C. CO và Fe2O3
D. C và CuO
Câu 22: Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
A. 19,2 gam B. 20,1 gam
C. 27,0 gam D. 20,7 gam
Câu 23: Dẫn 2,24 lít khí NH3 (đktc) đi qua ống đựng 32 gam bột CuO nung nóng thu được chất rắn X và khí Y. Thể tích khí Y sinh ra là:
A. 3,36 B. 2,24
C. 1,12 D. 1,344
Câu 24: Cho từ từ khí CO đi qua ống đựng 3,2 gam CuO nung nóng. Khí thoát ra khỏi ống được hấp thụ hoàn toàn vào nước vôi trong dư tạo thành 1 gam kết tủa. Chất rắn còn lại trong ống sứ cho vào cốc đựng 500 ml dung dịch HNO3 0,16M thu được V1 lít khí NO và còn một phần kim loại chưa tan. Thêm tiếp vào cốc 760 ml dung dịch HCl 2/3 M, sau khi phản ứng xong thu thêm V2 lít khí NO. Biết NO là sản phẩm khử duy nhất của N+5, các phản ứng xảy ra hoàn toàn. V2 gần nhất với giá trị nào sau đây
A. 0,037. B. 0,336.
C. 0,112. D. 1,490.
Câu 25: Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
A. 3,0 mol. B. 2,8 mol.
C. 3,2 mol. D. 3,4 mol.
Câu 26: Cho 200 ml dung dịch HNO3 vào 200 ml dung dịch hỗn hợp gồm NaOH 0,2M và KOH 0,3M được 400 ml dung dịch X có pH = a. Cô cạn dung dịch X được 7,66 gam chất rắn khan. Giá trị của a là
A. 1 B. 2
C. 12 D. 13
Câu 27: Hợp chất hữu cơ X có công thức đơn giản nhất CH2O và có tỉ khối so với hiđro là 30. Công thức phân tử của X là (cho nguyên tử khối của các nguyên tố C = 12; H=1; O = 16)
A. CH2O
B. C2H4O2
C. C2H4O
D. C3H8O
Câu 28: Hợp chất hữu cơ là hợp chất của nguyên tố
A. cacbon B. oxi
C. silic D. nitơ
Câu 29: Chất nào sau đây là chất điện li mạnh?
A. HNO2 B. H2CO3
C. CH3COOH D. HCl
Câu 30: Muối amoni là chất điện li thuộc loại:
A. Mạnh.
B. Trung bình.
C. Tùy gốc axit.
D. Yếu.
Câu 31: Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Hiện tượng xảy ra là:
A. Có khí mùi khai bay lên
B. Không có hiện tượng.
C. Có kết tủa trắng
D. Có khí mùi khai bay lên và có kết tủa trắng.
Câu 32: Chất nào sau đây khi tan trong nước tạo thành dung dịch có khả năng dẫn được điện?
A. đường saccarozơ (C12H22O11)
B. muối ăn (NaCl)
C. đường glucozơ (C6H12O6)
D. rượu etylic (C2H5OH)
Lời giải chi tiết
|
1 |
2 |
3 |
4 |
5 |
|
C |
B |
D |
B |
B |
|
6 |
7 |
8 |
9 |
10 |
|
A |
C |
C |
C |
A |
|
11 |
12 |
13 |
14 |
15 |
|
C |
B |
A |
D |
A |
|
16 |
17 |
18 |
19 |
20 |
|
A |
A |
C |
B |
A |
|
21 |
22 |
23 |
24 |
25 |
|
B |
D |
C |
A |
C |
|
26 |
27 |
28 |
29 |
30 |
|
D |
B |
A |
D |
A |
|
31 |
32 |
|
||
|
D |
B |
|||
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 7
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 7)
I. TRẮC NGHIỆM KHÁCH QUAN (5 ĐIỂM)
Câu 1: Chất nào sau đây khi tan trong nước không phân li ra ion?
A. HCl
B. NaOH
C. NaCl
D. C2H5OH (rượu)
Câu 2: Chất điện li mạnh có độ điện li (α)
A. α = 0 B. α = 1
C. 0 < αD. α > 1
Câu 3: Dung dịch X có [H+] = 5.10-4. Dung dịch X có môi trường
A. axit B. bazơ
C. trung tính D. lưỡng tính
Câu 4: Khí N2 tương đối trơ về mặt hóa học ở nhiệt độ thường do nguyên nhân chính là
A. nitơ có bán kính nguyên tử nhỏ.
B. phân tử N2 không phân cực.
C. nitơ có độ âm điện lớn nhất trong nhóm VIA.
D. liên kết trong phân tử N2 là liên kết 3, không phân cực, có năng lượng lớn.
Câu 5: Để nhận biết ion PO43- trong dung dịch muối, người ta dùng thuốc thử là
A. dung dịch AgNO3
B. dung dịch NaOH
C. dung dịch HNO3
D. dung dịch Br2
Câu 6: Thành phần hóa học chính của phân lân supephotphat kép là
A. Ca3(PO4)2
B. Ca(H2PO4)2
C. CaHPO4
D. Ca(H2PO4)2 và CaSO4
Câu 7: Phân bón nào dưới đây có hàm lượng N cao nhất?
A. NH4Cl B. NH4NO3
C. Ca(NO3)2 D. (NH2)2CO
Câu 8: Khi cho 2 mol NaOH tác dụng hoàn toàn với 1 mol H3PO4 thì thu được muối là
A. NaH2PO4 B. Na2HPO4
C. Na3PO4 D. Na2H2PO4
Câu 9: Dung dịch nào sau đây làm quì tím chuyển sang màu đỏ?
A. NH4Cl B. NaOH
C. NaCl D. Na2CO3
Câu 10: Nhiệt phân hoàn toàn AgNO3 thu được sản phẩm là
A. Ag, NO2, O2
B. Ag2O, NO2, O2
C. AgNO2, O2
D. Ag, Ag2O, NO2
II. TỰ LUẬN (5 ĐIỂM)
Bài 1: Trộn 500 ml dung dịch HNO3 0,02M với 500 ml dung dịch NaOH 0,04M thu được dung dịch X. Tính pH của dung dịch X.
Bài 2: Hòa tan hoàn toàn 3,04 gam hỗn hợp X gồm (Fe, Cu) tác dụng hoàn toàn với dung dịch HNO3 loãng dư, sau phản ứng thu được 0,896 lít khí NO (sản phẩm khử duy nhất, ở đktc). Tính khối lượng mỗi kim loại trong hỗn hợp X?
Bài 3: Phản ứng của thuốc nổ đen: 2KNO3 + 3C + S .3CO2 + N2 + K2S; ΔH < 0
Tính phần trăm theo khối lượng các chất trong thuốc nổ đen, biết rằng thuốc nổ đen được trộn theo đúng tỉ lệ phản ứng. Khi đốt 1 kg thuốc nổ đen có thể tạo thành khối khí có thể tích bao nhiêu (ở 2730C và 1 atm).
Biết: Fe = 56, Cu = 64, C = 12, O = 16, N = 14
Lời giải chi tiết
ĐÁP ÁN
|
1. D |
2. B |
3. A |
4. D |
5. A |
|
6. B |
7. D |
8. B |
9. A |
10. A |
II. TỰ LUẬN (5,0 điểm)
Câu 1:
nH+ = nHNO3 = 0,02.0,5 = 0,01 mol
nOH- = nNaOH = 0,04.0,5 = 0,02 mol
H+ + OH– → H2O
Bđ: 0,01 0,02 (mol)
Pư: 0,01→0,01 (mol)
Sau: 0 0,01 (mol)
[OH–] = n/V = 0,01/(0,5 + 0,5) = 0,01M
=> pOH = -log[OH–] = -log(0,01) = 2
=> pH = 14 – pOH = 14 – 2 = 12
Vậy pH của dung dịch thu được sau phản ứng là 12.
Câu 2:
Cách 1: Viết và tính toán theo PTHH
Đặt x, y lần lượt là số mol của Fe và Cu
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
x → x (mol)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
y → 2y/3 (mol)
– Khối lượng hỗn hợp: m hh = 56x + 64y = 3,04 (1)
– Số mol khí NO thu được: nNO = x + 2y/3 = 0,04 (2)
Giải (1) và (2) thu được x = 0,02 mol và y = 0,03 mol
Trong hỗn hợp ban đầu: mFe = 0,02.56 = 1,12 gam và mCu = 0,03.64 = 1,92 gam
Cách 2: Sử dụng định luật bảo toàn electron:
– Khối lượng hỗn hợp: m hh = 56x + 64y = 3,04 (1’)
– Định luật bảo toàn e: 3nFe + 2nCu = 3nNO => 3x + 2y = 3.0,04 (2’)
Giải (1’) và (2’) thu được x = 0,02 mol và y = 0,03 mol
Trong hỗn hợp ban đầu: mFe = 0,02.56 = 1,12 gam và mCu = 0,03.64 = 1,92 gam
Câu 3:
Hỗn hợp thuốc nổ đen gồm KNO3, C, S với tỉ lệ mol tương ứng là 2 : 3 : 1.
* Tính phần trăm theo khối lượng các chất trong thuốc nổ đen:

*Tính thể tích khí sinh ra khi đốt 1 kg thuốc nổ đen:
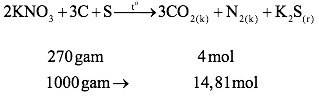
Thể tích khí thu được ở 273oC và p = 1 atm:
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 8
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 8)
I. PHẦN TRẮC NGHIỆM (2,0 điểm)
Câu 1: Dung dịch nào sau đây không tác dụng với dung dịch HCl loãng?
A. KNO3. B. AgNO3.
C. NaOH. D. Na2CO3.
Câu 2: Khí NH3 làm quì tím ẩm chuyển sang màu
A. xanh. B. đỏ.
C. hồng. D. tím.
Câu 3: Cho hỗn hợp gồm 0,1 mol CuO và 0,1 mol Cu tác dụng với dung dịch HNO3 đặc nóng, dư thu được V lít khí NO2 (đktc). Giá trị của V là
A. 3,36. B. 2,24.
C. 4,48. D. 6,72.
Câu 4: Trong các cặp chất cho dưới đây, cặp nào không xảy ra phản ứng với nhau?
A. HCl, Fe(OH)3.
B. KOH, CaCO3.
C. CuCl2, AgNO3.
D. K2SO4, Ba(NO3)2.
Câu 5: Dung dịch nào sau đây có pH = 7?
A. NaOH. B. H2SO4.
C. NaCl. D. HCl.
Câu 6: Chất nào sau đây lưỡng tính?
A. Fe(OH)3. B. Mg(OH)2.
C. NaCl. D. Al(OH)3.
Câu 7: Để phân biệt dung dịch Na3PO4 và dung dịch NaNO3 nên dùng thuốc thử nào sau đây?
A. Dung dịch HCl.
B. Dung dịch KOH.
C. Dung dịch AgNO3.
D. Dung dịch H2SO4.
Câu 8: Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là
A. 3,0M. B. 1,0M.
C. 2,0M. D. 2,5M.
II. PHẦN TỰ LUẬN (8,0 điểm)
Câu 9 (2,0 điểm): Cho 100 ml dung dịch HNO3 1,0 M (dung dịch A) vào 100 ml dung dịch KOH 1,0M (dung dịch B).
a) Viết phương trình điện li của HNO3; KOH.
b) Tính pH của dung dịch A và dung dịch B.
c) Tính pH khi trộn lẫn dung dịch A và dung dịch B.
Câu 10 (2,0 điểm): Thực hiện dãy chuyển hoá sau và ghi rõ điều kiện phản ứng nếu có.
Câu 11 (2,0 điểm):
a) Vào mùa lạnh người ta thường sử dụng than để sưởi ấm, tuy nhiên có nhiều trường hợp bị ngộ độc dẫn đến tử vong. Chất nào gây nên sự ngộ độc trên? Viết phương trình hóa học tạo thành chất đó trong quá trình sử dụng than để sưởi ấm. Nêu biện pháp tránh bị ngộ độc khi sử dụng than để sưởi ấm.
b) Cho 0,56 lít CO2 (đktc) hấp thụ hoàn toàn vào 400 ml dung dịch Ca(OH)2 0,05M. Tính khối lượng kết tủa thu được.
Câu 12 (2,0 điểm): Cho hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X môt thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là bao nhiêu?
Lời giải chi tiết
|
1 |
2 |
3 |
4 |
5 |
|
A |
A |
C |
B |
C |
|
6 |
7 |
8 |
|
|
|
D |
C |
D |
|
|
Bài 9:
a) Phương trình điện li của HNO3 và HCl:
HNO3 → H+ + NO3– (1)
KOH → K+ + OH– (2)
b)
Theo (1): nH+ = nHNO3 = 0,1.1 = 0,1 mol
=> pH = -log[H+] = -log(0,1) = 1
Theo (2): nOH- = nKOH = 0,1.1 = 0,1 mol
=> pOH = -log[OH–] = -log(0,1) = 1
=> pH = 14 – pOH = 13
Vậy pH của dung dịch A là 1 và pH của dung dịch B là 13.
c) Khi trộn dung dịch A và dung dịch B với nhau:
H+ + OH– → H2O
Ta thấy: nH+ = nOH- => Phản ứng vừa đủ
=> Dung dịch sau phản ứng có pH = 7
Bài 10:
(1) NH3 + O2 NO + H2O
(2) 2NO + O2 → 2NO2
(3) 4NO2 + O2 + 2H2O → 4HNO3
(4) HNO3 + NH3 → NH4NO3
Bài 11:
a) Khi đốt than ở trong phòng kín, than cháy trong môi trường thiếu oxi sinh ra khí CO theo phương trình hóa học:
2C + O2 2CO.
Khi đó, CO kết hợp với hemoglobin trong hồng cầu máu người tạo thành hợp chất bền vững, khiến cho hemoglobin không thể kết hợp với oxi dẫn đến tình trạng thiếu oxi trầm trọng và gây tử vong.
Biện pháp: Cung cấp đầy đủ khí O2 cho quá trình đốt than bằng cách đốt than ở nơi thoáng khí, tránh đốt trong các không gian chật hẹp và kín.
b) nCO2 = 0,56 : 22,4 = 0,025 mol; nOH- = 2nCa(OH)2 = 2.0,4.0,05 = 0,04 mol; nCa2+ = nCa(OH)2 = 0,02 mol
Ta có:
=> Tạo muối CO32- và HCO3–
Đặt = x (mol) và = y (mol)
CO2 + 2OH– → CO32- + H2O
x 2x x
CO2 + OH– → HCO3–
y y y
+ nCO2 = x + y = 0,025 (1)
+ nOH- = 2x + y = 0,04 (2)
Giải hệ (1) và (2) thu được x = 0,015 và y = 0,01
Ca2+ + CO32- → CaCO3↓
BĐ: 0,02 0,015 (mol)
PƯ: 0,015←0,015 → 0,015 (mol)
Khối lượng kết tủa thu được là: mCaCO3 = 0,015.100 = 1,5 gam
Bài 12:
Áp dụng phương pháp đường chéo cho hỗn hợp khí X:
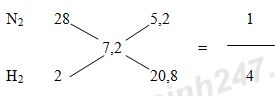
Giả sử hỗn hợp khí X gồm 1 mol N2 và 4 mol H2.
Theo định luật bảo toàn khối lượng ta có: mX = mY => nX.MX = nY.MY
=> n giảm = nX – nY = 5 – 4,5 = 0,5 mol
Hiệu suất của phản ứng (tính theo N2) là:
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 9
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 9)
PHẦN 1: TRẮC NGHIỆM KHÁCH QUAN (5,0 ĐIỂM)
Khoanh tròn đáp án đúng cho từng câu hỏi
Câu 1: Chọn phát biểu đúng.
A. Silic có tính oxi hóa mạnh hơn cacbon.
B. Cacbon có tính oxi hóa mạnh hơn silic.
C. Silic có tính khử yếu hơn cacbon.
D. Silic và cacbon có tính oxi hóa bằng nhau.
Câu 2: Chất có thể dùng làm khô khí NH3 là
A. P2O5. B. CuSO4 khan.
C. H2SO4 đặc. D. CaO.
Câu 3: Cho các hợp chất: CaC2, CO2, HCHO, CH3COOH, C2H5OH, NaCN, CaCO3. Số hợp chất hữu cơ trong các hợp chất đã cho là:
A. 1. B. 2.
C. 4. D. 3.
Câu 4: Trong các chất sau chất nào được gọi là hidrocacbon?
A. CH4. B. C2H6O.
C. CH3Cl. D. C12H22O11.
Câu 5: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
A. C2H5OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3CH3CH2OH, C2H5OH.
D. C4H10, C6H6.
Câu 6: Khi đốt cháy chất hữu cơ X bằng oxi không khí thu được hỗn hợp khí và hơi gồm CO2, H2O, N2. Điều đó chứng tỏ phân tử chất X
A. chắc chắn phải có các nguyên tố C, H, O, N.
B. chắc chắn phải có các nguyên tố C, H, N có thể có nguyên tố O.
C. chỉ có các nguyên tố C, H.
D. chắc chắn phải có các nguyên tố C, O, N.
Câu 7: Thuốc nổ đen là hỗn hợp
A. KNO3, C và S.
B. KNO3 và S.
C. KClO3, C và S.
D. KClO3 và S.
Câu 8: Sự điện li là quá trình
A. hòa tan các chất vào nước.
B. phân li ra ion của các chất trong nước.
C. phân li thành các phân tử hòa tan.
D. phân li của axit trong nước.
Câu 9: Điều khẳng định đúng là:
A. dung dịch có môi trường bazo thì pH>7.
B. dung dịch có môi trường trung tính thì pH<7.
C. dung dịch có môi trường axit thì pH=7.
D. dung dịch có môi trường trung tính thì pH>7.
Câu 10: Trong các chất sau, chất có độ cứng lớn nhất là
A. silic. B. kim cương.
C. than chì. D. thạch anh.
Câu 11: Chất được dùng để chữa bệnh đau dạ dày là
A. CO. B. CO2 tinh thể
C. SiO2. D. NaHCO3.
Câu 12: Những ion có thể cùng tồn tại trong một dung dịch là
A. Na+, Ca2+, HSO4–, CO32-.
B. Na+, Mg2+, OH–, NO3–.
C. Na+, Ba2+, OH–, Cl–.
D. Ag+, H+, Cl–, SO42-.
Câu 13: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
A. các chất phản ứng phải là chất điện li mạnh.
B. một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
C. các chất phản ứng phải là những chất dễ tan.
D. phản ứng phải là thuận nghịch.
Câu 14: Khí N2 tương đối trơ ở nhiệt độ thường là do
A. Phân tử nito có liên kết ba bền vững.
B. Nito có bán kính nguyên tử nhỏ.
C. Nito có độ âm điện lớn.
D. Phân tử nito phân cực.
Câu 15: Cấu hình electron của nguyên tử photpho (Z = 15) là
A. 1s22s22p63s23p5.
B. 1s22s22p3.
C. 1s22s22p63s23p3.
D. 1s22s22p63s23p2.
Câu 16: Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhớm metylen (-CH2-) được gọi là
A. đồng phân. B. đồng vị.
C. đồng đẳng. D. đồng khối.
Câu 17: Chất được dùng để khắc chữ lên thủy tinh là
A. dung dịch H2SO4.
B. dung dịch HNO3.
C. dung dịch HCl.
D. dung dịch HF.
Câu 18: Phản ứng nito thể hiện tính khử là
A. N2 + 6Li → 2Li3N.
B. N2 + 2Al → 2AlN.
C. N2 + O2 → 2NO.
D. N2 + 3H2 → 2NH3.
Câu 19: Trong phản ứng sau: HNO3 + C → CO2 + NO2 + H2O. Cacbon là
A. chất bị khử.
B. chất oxi hóa.
C. chất khử.
D. chất nhận electron.
Câu 20: Công thức phân tử của phân ure là
A. (NH4)2CO3. B. NH2CO.
C. (NH2)2CO3. D. (NH2)2CO.
PHẦN II: TỰ LUẬN (5,0 ĐIỂM)
Câu 1: (1,5 điểm) Viết các phương trình phản ứng hóa học hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện nếu có)

Câu 2: (1,5 điểm) Bằng phương pháp hóa học hãy nhận biết các dung dịch sau, viết các phương trình phản ứng xảy ra trong quá trình nhận biết: HNO3, NaNO3, Ba(OH)2, Na2SO4.
Câu 3: (1,0 điểm) Đốt cháy hoàn toàn 11,6 gam một chất hữu cơ A thu được 13,44 lít CO2 (đktc) và 10,8 gam H2O. Tỉ khối hơi A so với oxi là 1,8125. Lập công thức phân tử của A.
Câu 4: (1,0 điểm) Cho 13,5 gam Al tác dụng vừa đủ với 2,0 lít dung dịch HNO3 thu được hỗn hợp khí A gồm NO và N2 có tỉ khối với hidro là 14,75. Tính thể tích mỗi khí sinh ra (đktc)?
Cho biết: O = 16; H = 1; C = 12; N = 14; Al = 27
Lời giải chi tiết
|
1 |
2 |
3 |
4 |
5 |
|
B |
D |
D |
A |
A |
|
6 |
7 |
8 |
9 |
10 |
|
B |
A |
B |
A |
B |
|
11 |
12 |
13 |
14 |
15 |
|
D |
C |
B |
A |
C |
|
16 |
17 |
18 |
19 |
20 |
|
C |
D |
C |
C |
D |
PHẦN II: TỰ LUẬN (5,0 ĐIỂM)
Câu 1:
Câu 2:
|
Chất Thuốc thử |
HNO3 |
NaNO3 |
Ba(OH)2 |
Na2SO4 |
|
Quỳ tím |
Chuyển đỏ |
Không đổi màu |
Chuyển xanh |
Không đổi màu |
|
Ba(OH)2 |
– |
Không hiện tượng |
– |
Kết tủa trắng |
PTHH: Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
Câu 3:
nCO2 = 13,44 : 22,4 = 0,6 mol; nH2O = 10,8 : 18 = 0,6 mol
Do đốt cháy A thu được CO2 và H2O => A có chứa C, H có thể có O.
BTNT “C”: nC = nCO2 = 0,6 mol
BTNT “H”: nH = 2nH2O = 1,2 mol
BTKL: mO = mA – mC – mH = 11,6 – 0,6.12 – 1,2.1 = 3,2 (g)
=> nO = 3,2 : 16 = 0,2 mol
=> C : H : O = 0,6 : 1,2 : 0,2 = 3 : 6 : 1
Vậy A có dạng (C3H6O)n
Tỉ khối hơi A so với oxi là 1,8125 => MA = 1,8125.32 = 58 => 58n = 58 => n = 1
Vậy công thức phân tử của A là C3H6O
Câu 4:
nAl = 13,5 : 27 = 0,5 mol
Áp dụng phương pháp đường chéo cho hỗn hợp khí A ta có:
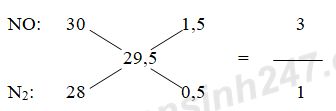
Đặt số mol của NO và N2 lần lượt là 3x và x (mol)
Theo định luật bảo toàn e ta có: 3nAl = 3nNO + 10nN2
=> 3.0,5 = 3.3x + 10x => x = 3/38 (mol)
VNO = 3x.22,4 = 3.(3/38).22,4 = 504/95 lít
VN2 = x.22,4 = (3/38).22,4 = 168/95 lít
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 10
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 10)
I. PHẦN CHUNG CHO TẤT CẢ CÁC HỌC SINH (6 điểm)
Câu 1: (2 điểm) Viết phương trình phản ứng theo sơ đồ chuyển hóa sau: (ghi rõ điều kiện, nếu có)
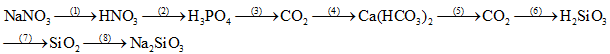
Câu 2: (2 điểm) Bằng phương pháp hóa học hãy phân biệt 4 dung dịch đựng trong các lọ mất nhãn sau: NH4Cl, Na3PO4, K2CO3, NaNO3.Viết phương trình hóa học xảy ra.
Câu 3: (2 điểm) Đốt cháy hoàn toàn 0,44g hợp chất hữu cơ A thu được 448ml khí CO2 (đktc) và 0,36g nước.
a/ Tìm công thức đơn giản nhất của A.
b/ Tìm công thức phân tử A biết tỉ khối của A so với hiđro là 44.
II. PHẦN RIÊNG (4 điểm) Học sinh học chương trình nào phải làm theo chương trình đó.
Câu 4: (2 điểm)
a/ Viết 1 phương trình hóa học chứng minh Silic có tính khử. Xác định số oxi hóa và chỉ rõ vai trò các chất tham gia phản ứng.
b/ Em hãy viết 01 phương trình điều chế cacbon monooxit (CO) bằng phương pháp khí than ướt.
Câu 5: (2 điểm) Hấp thụ hoàn toàn 3,36 lít khí CO2 (ở đktc) vào 100 ml dung dịch KOH 2M.
a/ Cho biết sau phản ứng thu được muối nào ?
b/ Tìm khối lượng muối thu được ?
Dành cho các lớp A
Câu 4: (2 điểm)
a/ Em hãy viết phương trình điều chế phân ure.
b/ Viết 01 phương trình chứng minh tính khử của Photpho, Xác định số oxi hóa và chỉ rõ vai trò các chất tham gia phản ứng.
Câu 5: (2 điểm) Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc) và dung dịch Y. Hãy:
a/ Tìm V.
b/ Cô cạn dd Y, Tính khối lượng muối khan trong Y.
Lời giải chi tiết
I. PHẦN CHUNG CHO TẤT CẢ HỌC SINH (6 điểm)
Câu 1:
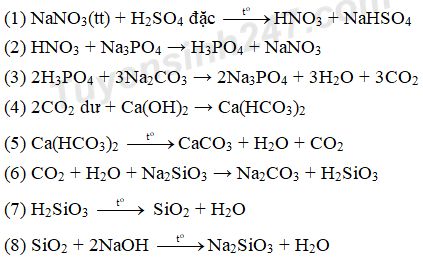
Câu 2:
|
|
NH4Cl |
Na3PO4 |
K2CO3 |
NaNO3 |
|
Dung dịch NaOH |
Khí mùi khai |
– |
– |
– |
|
Dung dịch HCl |
x |
– |
Khí không màu |
– |
|
Dung dịch AgNO3 |
x |
x |
Kết tủa vàng |
– |
NH4Cl + NaOH → NaCl + NH3↑ + H2O
K2CO3 + 2HCl → 2KCl + H2O + CO2↑
Na3PO4 + 3AgNO3 → Ag3PO4↓ + 3NaNO3
Câu 3:
nCO2 = 0,448 : 22,4 = 0,02 mol
=> nC = nCO2 = 0,02 mol => mC = 0,02.12 = 0,24 (g)
nH2O = 0,36 : 18 = 0,02 mol
=> nH = 2nH2O = 0,04 mol => mH = 0,04.1 = 0,04 (g)
mO = mA – mC – mH = 0,44 – 0,24 – 0,04 = 0,16 (g)
=> nO = 0,16 : 16 = 0,01 mol
a/ Gọi công thức phân tử của A là CxHyOz
Ta có: x : y : z = nC : nH : nO = 0,02 : 0,04 : 0,01 = 2 : 4 : 1
Vậy công thức đơn giản nhất của A là C2H4O
b/ Công thức đơn giản nhất của A là C2H4O nên công thức phân tử của A có dạng: (C2H4O)n
dA/H2 = 44 => MA = 44.2 = 88
=> 44n = 88 => n = 2
Vậy công thức phân tử của A là C4H8O2
II. PHẦN RIÊNG: (4 điểm) Học sinh học chương trình nào phải làm theo chương trình đó.
Dành cho các lớp D,T:
Câu 4:

Câu 5:
a/ nCO2 = 3,36 : 22,4 = 0,15 mol, nKOH = 0,1.2 = 0,2 mol
Ta thấy: => tạo 2 muối K2CO3 và KHCO3
b/ Đặt nK2CO3 = x mol; nKHCO3 = y mol
CO2 + 2KOH → K2CO3 + H2O
x 2x x (mol)
CO2 + KOH → KHCO3
y y y (mol)
nCO2 = x + y = 0,15 (1)
nKOH = 2x + y = 0,2 (2)
Giải hệ phương trình (1) và (2):
Khối lượng của các muối thu được là:
mK2CO3 = 0,05.138 = 6,9 gam
mKHCO3 = 0,1.100 = 10 gam
Tổng khối lượng 2 muối 6,9 + 10 = 16,9 gam
Dành cho các lớp A
Câu 4:

Câu 5:
a/ nCO3 2- = 0,1.1,5 = 0,15 mol, nHCO3- = 0,1.1 = 0,1 mol, nH+ = 0,2.1 = 0,2 mol
Khi nhỏ từ từ H+ vào dung dịch hỗn hợp CO32- và HCO3– thì thứ tự phản ứng là:
H+ + CO32- → HCO3–
0,15dư 0,05 ← 0,15 → 0,15 (mol)
H+ + HCO3– → H2O + CO2
0,05 → 0,05 → 0,05 (mol)
nHCO3- sau phản ứng = 0,1 + 0,15 – 0,05 = 0,2 mol
a/ VCO2 = 0,05.22,4 = 1,12 lít
b/ Dung dịch thu được chứa:
Khi cô cạn HCO3– bị phân hủy:
Hỗn hợp muối sau khi cô cạn gồm:
m muối = 0,3.23 + 0,1.39 + 0,1.60 + 0,2.35,5 = 23,9 gam
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 11
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 11)
Câu 1 (3,5 điểm):
a) Viết phương trình điện li của các chất sau khi hòa tan trong nước:
HCl, NaOH, CH3COOH, AlCl3, Fe2(SO4)3.
b) Bằng phương pháp hóa học hãy nhận biết các dung dịch đựng trong các lọ riêng biệt mất nhãn sau: Na3PO4, NaNO3, Na2CO3, NH4NO3.
Câu 2 (2,5 điểm):
Hoàn thành các phương trình phản ứng giữa các cặp chất sau, ghi rõ điều kiện cần thiết nếu có?
a) P + Mg →
b) P + HNO3 (đặc) →
c) Si + NaOH + H2O →
d) C + O2 (dư) →
e) CO + CuO →
Câu 3 (3 điểm):
a) + Tính pH của dung dịch chứa 2,92 gam HCl trong 800 ml?
+ Tính pH của dung dịch chứa 0,8 gam NaOH trong 200 ml?
b) Hòa tan hoàn toàn 10,35 gam hỗn hợp X gồm 2 kim loại Mg và Al bằng dung dịch HNO3 (loãng) dư sau phản ứng thu được dung dịch A và 7,84 lít khí không màu hóa nâu trong không khí (ở đktc, là sản phẩm khử duy nhất).
– Tính % khối lượng mỗi kim loại trong hỗn hợp X?
– Tính tổng khối lượng muối khan thu được khi cô cạn dung dịch A?
Câu 4 (1 điểm):
Cho 0,448 lít khí CO2 (ở đktc) hấp thụ hết vào 100 ml dung dịch chứa hỗn hợp NaOH và 0,06M và Ba(OH)2 0,12M, thu được m gam kết tủa. Xác định giá trị của m?
Lời giải chi tiết
Câu 1:
a)
HCl → H+ + Cl–
NaOH → Na+ + OH–
CH3COOH CH3COO– + H+
AlCl3 → Al3+ + 3Cl–
Fe2(SO4)3 → 2Fe3+ + 3SO42-
b)
|
Chất Thuốc thử |
Na3PO4 |
NaNO3 |
Na2CO3 |
NH4NO3 |
|
Dung dịch NaOH |
– |
– |
– |
Khí mùi khai |
|
Dung dịch HCl |
– |
– |
Khí không màu |
x |
|
Dung dịch AgNO3 |
Kết tủa vàng |
– |
x |
x |
PTHH:
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
Na2CO3 + HCl → NaCl + CO2↑ + H2O
Na3PO4 + AgNO3 → NaNO3 + Ag3PO4↓
Câu 2:
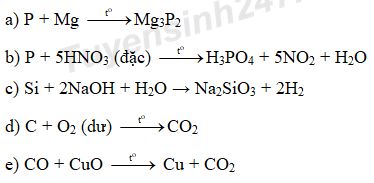
Câu 3:
a)
+ nHCl = 2,92 : 36,5 = 0,08 mol => nH+ = 0,08 mol
=> [H+] = 0,08 : 0,8 = 0,1 M
=> pH = -log[H+] = -log(0,1) = 1
+ nNaOH = 0,8 : 40 = 0,02 mol => nOH- = 0,02 mol
=> [OH–] = 0,02 : 0,2 = 0,1M
=> [H+] = 10-14 : [OH–] = 10-13 M
=> pH = -log[H+] = -log(10-13) = 13
b) nNO = 7,84 : 22,4 = 0,35 mol
Đặt nMg = x mol; nAl = y mol
– Khối lượng hỗn hợp X: 24x + 27y = 10,35 (1)
– Bảo toàn electron: 2nMg + 3nAl = 3nNO => 2x + 3y = 3.0,35 (2)
Từ (1) và (2) ta có:
– Phần trăm mỗi kim loại:
– Khối lượng muối khan:
BTNT “Mg”: nMg(NO3)2 = nMg = 0,15 mol
BTNT “Al”: nAl(NO3)3 = nAl = 0,25 mol
=> m muối = 0,15.148 + 0,25.213 = 75,45 gam
Câu 4:
nNaOH = 0,006 mol; nBa(OH)2 = 0,012 mol
nCO2 = 0,448 : 22,4 = 0,02 mol
nOH- = nNaOH + 2nBa(OH)2 = 0,06.0,1 + 2.0,12.0,1 = 0,03 mol
Ta thấy:
=> tạo muối CO32-, HCO3–
Đặt = a mol và = b mol
PTHH:
CO2 + 2OH– → CO32- + H2O
a ← 2a ← a (mol)
CO2 + OH– → HCO3–
b ← 2b ← b (mol)
Theo đề bài ta có:
nCO2 = a + b = 0,02 (1)
nOH- = 2a + b = 0,03 (2)
=> CO32- hết, Ba2+ dư =>
=> m = mBaCO3 = 0,01.197 = 1,97 gam
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 12
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 12)
I. PHẦN CHUNG: (8,0 điểm) Dành cho tất cả các thí sinh
Câu 1: (2,0 điểm)
Hoàn thành các phương trình hóa học sau dưới dạng phân tử và phương trình ion rút gọn:
a) KOH + HCl →
b) Ca(NO3)2 + Na2CO3 →
Câu 2: (2,0 điểm)
Bằng phương pháp hóa học hãy phân biệt các dung dịch bị mất nhãn sau: Ba(NO3)2, Na3PO4, KCl, NaNO3
Câu 3: (2,0 điểm)
Viết các phương trình phản ứng hóa học thực hiện chuỗi phản ứng sau:

Câu 4: (2,0 điểm)
Cho 1,2 gam hỗn hợp X gồm Mg và MgO tác dụng hoàn toàn với 39,4 gam dung dịch HNO3 loãng thì thu được 0,448 lít khí NO (đktc) (sản phẩm khử duy nhất) và dung dịch A.
a) Tính thành phần phần trăm theo khối lượng mỗi chất có trong 1,2 gam hỗn hợp X.
A. 70% và 30%. B. 60% và 40%.
C. 50% và 50%. D. 20% và 80%.
b) Tính nồng độ phần trăm của muối có trong dung dịch A.
A. 14,54% B. 16,54%
C. 14,45% D. 15,54%
II. PHẦN TỰ CHỌN: (2,0 điểm) Thí sinh chỉ được chọn một trong hai câu: Câu 5A hoặc Câu 5B để làm bài
Câu 5A: (2,0 điểm) Theo chương trình chuẩn
Đốt cháy hoàn toàn 1,48 gam một hợp chất hữu cơ sau phản ứng thu được 3,52 gam CO2 và 1,8 gam H2O
a) Tìm công thức đơn giản nhất của hợp chất hữu cơ.
A. C4H10O. B. C2H5O.
C. CH4O. D. C2H4O.
b) Tìm công thức phân tử của hợp chất hữu cơ biết khi hóa hơi 7,4 gam hợp chất hữu cơ có thể tích đúng bằng thể tích của 3,2 gam oxi (đo ở cùng điều kiện nhiệt độ, áp suất)
A. C2H6O. B. C2H4O.
C. C4H10O. D. C3H6O2.
Câu 5B: (2,0 điểm) Theo chương trình nâng cao
Cho dung dịch X có chứa axit HCOOH 0,1M có hằng số phân li là Ka = 1,6.10-4 (Bỏ qua sự điện li của H2O)
a) Tính pH của dung dịch X.
A. 2,4. B. 2,2.
C. 2,6. D. 2,3.
b) Tính độ điện li của HCOOH.
A. 3,29%. B. 3,92%.
C. 2,93%. D. 2,39%.
c) Khi cho 5,85 gam NaCl vào dung dịch X thì độ điện li của HCOOH như thế nào? Giải thích?
A. Tăng.
B. Giảm.
C. Tăng sau đó giảm dần.
D. Không đổi.
Lời giải chi tiết
Câu 1:
a) Phương trình phân tử: KOH + HCl → KCl + H2O
Phương trình ion rút gọn: OH– + H+ → H2O
b) Phương trình phân tử: Ca(NO3)2 + Na2CO3 → CaCO3↓ + 2NaNO3
Phương trình ion rút gọn: Ca2+ + CO32- → CaCO3↓
Câu 2:
|
Chất thử Thuốc thử |
Ba(NO3)2 |
Na3PO4 |
KCl |
NaNO3 |
|
AgNO3 |
Không hiện tượng |
↓ vàng |
↓ trắng |
Không hiện tượng |
|
Na2SO4 |
↓ trắng |
– |
– |
Không hiện tượng |
PTHH:
Na3PO4 + 3AgNO3 → Ag3PO4↓ vàng+ 3NaNO3
KCl + AgNO3 → KNO3 + AgCl↓ trắng
Ba(NO3)2 + Na2SO4 → 2NaNO3 + BaSO4↓ trắng
Câu 3:
Câu 4:
a) Đáp án B
b) Đáp án D
Câu 5A:
a) Đáp án A
b) Đáp án C
Câu 5B:
a) Đáp án A
b) Đáp án B
c) Đáp án D
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 13
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 13)
Câu 1 (2 điểm): Hoàn thành sơ đồ chuỗi phản ứng sau (ghi rõ điều kiện phản ứng, nếu có)

Câu 2 (2 điểm): Bằng phương pháp hóa học hãy phân biệt các dung dịch đựng trong lọ mất nhãn sau. Na2SiO3, BaCl2, K3PO4, Na2CO3, NaNO3
Viết phương trình hóa học các phản ứng minh họa.
Câu 3 (1 điểm): Viết phương trình hóa học các phản ứng:
a. Chứng minh cacbon vừa có tính khử, vừa có tính oxi hóa.
b. Chứng minh Al(OH)3 có tính lưỡng tính.
Câu 4 (1 điểm): Nêu hiện tượng, viết phương trình phản ứng minh họa
a. Cho từ từ dung dịch H2SO4 đến dư vào dung dịch Ba(HCO3)2.
b. Cho dung dịch NaOH vào dung dịch Ca(HCO3)2.
Câu 5 (2 điểm): Nicotin là một hợp chất hóa học có trong thuốc lá, đó là chất gây nghiện tương tự như heroin hay cocain. Đốt cháy hoàn toàn 8,1 gam nicotin bằng oxi (dư) thì thu được 11,2 lít CO2, 6,3 gam H2O và 1,12 lít N2. Các thể tích khí đo ở điều kiện tiêu chuẩn.
a. Lập công thức đơn giản nhất của nicotin.
b. Xác định công thức phân tử của nicotin. Tính khối lượng phân tử. Biết nicotin có công thức cấu tạo như hình bên cạnh.
Câu 6 (2 điểm): Hòa tan hết 4,38 gam hỗn hợp X gồm Cu và Al trong dung dịch HNO3 loãng, dư thu được 1,344 lít khí NO (sản phẩm khử duy nhất, đktc).
a. Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b. Thay Cu (giữ nguyên lượng khối lượng hỗn hợp X) bằng Mg thì thu được hỗn hợp Y. Cho Y tác dụng hết với dung dịch HNO3 loãng, dư thì thu được dung dịch Z chứa m gam muối và 0,896 lít N2O (đktc). Tính m
Lời giải chi tiết
Câu 1:

Câu 2:
|
Chất thử
Thuốc thử |
Na2SiO3 |
BaCl2 |
K3PO4 |
Na2CO3 |
NaNO3 |
|
HCl |
↓ keo |
Không hiện tượng |
Không hiện tượng |
↑ không màu |
Không hiện tượng |
|
AgNO3 |
– |
↓ trắng |
↓ vàng |
– |
Không hiện tượng |
PTHH:
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓ keo
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓ trắng
K3PO4 + 3AgNO3 → 3KNO3 + Ag3PO4↓ vàng
Câu 3:
a. PTHH chứng minh C vừa có tính khử và tính oxi hóa:
Tính khử: C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O
Tính oxi hóa: 2C + Ca CaC2
b. PTHH chứng minh Al(OH)3 có tính lưỡng tính:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Câu 4:
a. Cho từ từ dung dịch H2SO4 đến dư vào dung dịch Ba(HCO3)2.
– Hiện tượng: Xuất hiện kết tủa trắng không tan trong axit dư và có sủi bọt khí không màu.
– PTHH: H2SO4 + Ba(HCO3)2 → BaSO4↓ + 2CO2↑ + 2H2O
b. Cho dung dịch NaOH vào dung dịch Ca(HCO3)2.
– Hiện tượng: Xuất hiện kết tủa trắng
– PTHH: 2NaOH + Ca(HCO3)2 → CaCO3↓ + Na2CO3 + 2H2O
Câu 5:
a. Đốt cháy nicotin thu được CO2, H2O và N2 => Nicotin có chứa C, H, N và có thể có O.
BTNT “C”: nC = nCO2 = 0,5 mol
BTNT “H”: nH = 2nH2O = 0,7 mol
BTNT “N”: nN = 2nN2 = 0,1 mol
BTKL: mO = mHCHC – mC – mH – mN = 8,1 – 0,5.12 – 0,7.1 – 0,1.14 = 0 gam => Nicotin không chứa O
Ta có: C : H : N = 0,5 : 0,7 : 0,1 = 5 : 7 : 1
Vậy công thức đơn giản nhất của nicotin là C5H7N
b. Công thức phân tử của nicotin có dạng (C5H7N)n
Từ công thức cấu tạo ta thấy phân tử nicotin chứa 2 nguyên tử N => n = 2
Vậy công thức phân tử của nicotin là C10H14N2
Phân tử khối của nicotin là: 12.10 + 14.1 + 14.2 = 162 đvC
Câu 6:
nNO = 1,344 : 22,4 = 0,06 mol
a. Đặt số mol của Cu và Al lần lượt là x và y (mol)
– Khối lượng hỗn hợp: 64x + 27y = 4,38 (1)
– Áp dụng định luật bảo toàn e: 2nCu + 3nAl = 3nNO => 2x + 3y = 3.0,06 (2)
Giải (1) và (2) thu được: x = 0,06 và y = 0,02
b. Do giữ nguyên khối lượng của hỗn hợp và Al nên ta có:
mMg = mCu = 3,84 gam => nMg = 3,84 : 24 = 0,16 mol
Nhận thấy: 2nMg + 3nAl (= 0,38 mol) > 8nN2O (= 0,32 mol)
Vậy sản phẩm khử còn có chứa NH4+
Áp dụng định luật bảo toàn e ta có: 2nMg + 3nAl = 8nN2O + 8nNH4+
=> 0,16.2 + 0,02.3 = 0,04.8 + 8.nNH4+ => nNH4+ = 0,0075 mol
Vậy dung dịch muối Z gồm có: Mg2+ (0,16 mol); Al3+ (0,02 mol); NH4+ (0,0075 mol) và NO3–
Áp dụng định luật bảo toàn điện tích cho dung dịch Z:
nNO3- = 2nMg2+ + 3nAl3+ + nNH4+ = 2.0,16 + 3.0,02 + 0,0075 = 0,3875 mol
Khối lượng muối trong dung dịch Z là:
m = mMg2+ + mAl3+ + mNH4+ + mNO3- = 0,16.24 + 0,02.27 + 0,0075.18 + 0,3875.62 = 28,54 gam
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 14
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 14)
I. PHẦN TRẮC NGHIỆM
Câu 1. Nếu lấy 2 dung dịch NaOH và CH3COONa có cùng giá trị pH thì phép so sánh nồng độ CM của hai dung dịch trên đúng là:
Câu 2. Dãy chất và ion nào sau đây là lưỡng tính rheo Bronstest?
Câu 3. Một dung dịch bazo mạnh Ba(OH)2 có nồng độ mol/l. Giá trị pH của dung dịch trên là:
A.10 B.9
C.8 D.7
Câu 4. Để điều chế khí N2 từ dung dịch NaNO2 và NH4Cl bão hòa thì người ta đun nóng bình cầu như thế nào?
A.Ban đầu đun nhẹ, sau đó đun mạnh dần.
B.Ban đầu đun mạnh, sau đó đun yếu dần.
C.Đun mạnh liên tục cho đến khi phản ứng xảy ra hoàn toàn.
D.Ban đầu đun nhẹ, khi có bọt khí thoát ra thì ngừng đun.
Câu 5. Phản ứng nhiệt phân muối nitrat nào sau đây là không đúng?
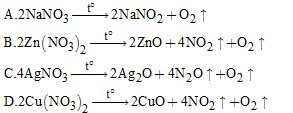
Câu 6. Khi cho Fe tác dụng với dung dịch hỗn hợp muối gồm AgNO3, Cu(NO3)2, Pb(NO3)2 thì Fe khử các ion kim loại theo thứ tự là?
Câu 7. Dẫn 2,24 lít khí CO2 (đktc) vào 100ml dung dịch KOH 1,5M. Dung dịch thu được chứa những chất nào sau đây?
A.KHCO3 và K2CO3
B.K2CO3
C.KHCO3
D.K2CO3 và KOH
Câu 8. Cho 0,53 gam muối cacbonat (X) của hai kim loại hóa trị I tác dụng với dung dịch HCl dư thu được 112ml khí CO2 (đktc). Công thức muối (X) là:
A.KHCO3 B.Na2CO3
C.K2CO3 D.NaHCO3
Câu 9. Cho bột than dư vào hỗn hợp gồm Fe2O3 và CuO nung nóng để phản ứng xảy ra hoàn toàn thu được 2 gam hỗn hợp kim loại và 2,24 lít khí (đktc). Khối lượng hỗn hợp oxit ban đầu là:
A.5,00 gam B.5,15 gam
C.5,20 gam D.5,30 gam
Câu 10. Đốt cháy hoàn toàn 4,5 gam hỗn hợp chất hữu cơ (X) thu được 13,2 gam CO2 và 8,1 gam H2O. Công thức phân tử của (X) là:
A.CH4O B.CH4
C.C2H6 D.C2H6O
Câu 11. Dẫn toàn bộ sản phẩm khi đốt cháy hoàn toàn 1,48 gam chất hữu cơ (X) lần lượt vào bình (I) chứa H2SO4 đặc và bình (II) chứa KOH đặc thì thấy khối lượng bình (I) tăng 1,8 gam và bình (II) tăng 3,52 gam. Công thức phân tử của (X) là:
A.C3H8 B.C5H12
C.C4H8 D.C4H10O
Câu 12. Đốt cháy hoàn toàn a gam một hiđrocacbon. Dẫn toàn bộ sản phẩm vào bình nước vôi trong dư, thấy khối lượng của bình tăng 7,44 gam và thu được 12 gam kết tủa. Giá trị của a là:
A.1,68 gam B.1,50 gam
C.0,12 gam D.0,24 gam
II. PHẦN TỰ LUẬN
Câu 13. Biết dung dịch axit CH3COOH có Tính độ điện li của CH3COOH 0,1M đã cho ở trên.
Câu 14. Một bình kín dung tích 0,5 lít có chứa 0,5 mol H2 và 0,5 mol N2. Khi phản ứng đạt trạng thái cân bằng thấy có 0,02 mol NH3. Xác định hằng số cân bằng của phản ứng tổng hợp NH3 ở trên.
Câu 15. Cho 8,9 gam hỗn hợp muối cacbonat của hai kim loại kiềm thuộc hai chu kì kế tiếp nhau tác dụng hết với dung dịch HCl thu được 2,24 lít khí CO2 (đktc). Xác định khối lượng muối thu được sau phản ứng.
Câu 16. Cho biết độ tan của CaSO4 là 0,2 gam trong 100ml nước (ở ) và khối lượng riêng của dung dịch bão hòa là D = 1 g/ml. Hỏi khi trộn 50ml dung dịch CaCl2 0,012M với 150ml dung dịch Na2SO4 0,04M (ở ), có xuất hiện kết tủa hay không?
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
B |
B |
A |
D |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
C |
B |
A |
B |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
C |
C |
D |
A |
II. PHẦN TỰ LUẬN
Câu 13.
Ta có:
Giả sử
Vậy:
Câu 14.
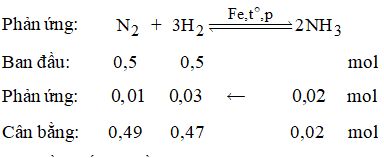
Vậy hằng số cân bằng là:
Câu 15.
Gọi công thức tương đương của hai muối có dạng
Ta có:
Phản ứng:
Từ (1)
Vậy mmuối .
Câu 16.
Ta có:
Và
Nếu 2 chất đó phản ứng hoàn toàn ta được:
Từ (1)
Trong 200ml dung dịch CaSO4 bão hòa có:
Vì 0,0815 (gam) < 0,4 (gam): nên dung dịch trên chưa bão hòa và sẽ không có kết tủa CaSO4.
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 15
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 15)
I. PHẦN TRẮC NGHIỆM
Câu 1. Trong ống nghiệm chứa 4 dung dịch trong suốt mỗi dung dịch chỉ chứa một loại cation và một anion. Các loại ion trong cả 4 dung dịch gồm: Bốn ống nghiệm đó đựng 4 dung dịch nào sau đây?
Câu 2. Dung dịch nước của chất nào sau đây có pH > 7?
A.NH4Cl B.KNO3
C.K3PO4 D.(NH4)2SO4
Câu 3. Cho a mol CO2 vào dung dịch chứa 2a mol KOH thu được dung dịch (X). Cho (X) vào dung dịch Al(NO3)3 thì có hiện tượng nào sau đây?
A.Chỉ có khí không màu bay ra.
B.Vừa có khí không màu bay ra vừa có kết tủa trắng.
C.Ban đầu có kết ít, sau đó kết tủa nhiều dần rồi tan ra.
D.Lúc đầu khí bay ra ít, sau đó nhiều hơn, đồng thời kết tủa màu xanh xuất hiện rồi tan hết.
Câu 4. Cho 19,2 gam một kim loại R tác dụng hết với dung dịch HNO3 thu được 4,48 lít NO (đktc). Tên kim loại đem dùng là:
A.Đồng B.Sắt
C.Kẽm D.Bari
Câu 5. Cho 6 gam P2O5 vào 150ml dung dịch H3PO4 6% (D = 103 g/ml). Nồng độ phần trăm của dung dịch H3PO4 thu được là:
A. 40%. B. 41% C. 42% D. 43%
Câu 6. Nếu trộn 5 lít khí N2 với 4 lít khí H2 trong bình kín ở nhiệt độ cao . Sau khi phản ứng kết thúc thu được 7,8 lít hỗn hợp, biết các khí đo ở cùng điều kiện. Thể tích khí NH3 tạo thành là:
A.1,2 lít B.0,8 lít
C.1,5 lít D.0,4 lít
Câu 7. Thổi khí CO qua ống sứ đựng a gam hỗn hợp gồm Al2O3, MgO, Fe2O3, FeO và CuO nung nóng. Dẫn khí thoát ra vào nước vôi trong dư thu được 15 gam kết tủa và chất rắn sau phản ứng là 200 gam. Giá trị của a là:
A.197,6 gam
B.210,8 gam
C.202,4 gam
D.189,2 gam
Câu 8. Hòa tan 28,1 gam hỗn hợp gồm MgCO3 và BaCO3 có thành phần phần trăm theo khối lượng thay đổi (trong đó chứa a% MgCO3) vào dung dịch HCl dư thu được khí (X). Dẫn hết khí (X) vào 100ml dung dịch Ca(OH)2 2M thu được kết tủa (Y). Giá trị của a là bao nhiêu để kết tủa (Y) đạt giá trị lớn nhất?
A.30
B.45
C.50
D.100
Câu 9. Cho 7 gam hỗn hợp hai muối cacbonat của kim loại hóa trị II tác dụng với dung dịch HCl, thu được V lít khí CO2 (đktc) và dung dịch (X). Cô cạn dung dịch (X) thu được 9,2 gam muối khan. Giá trị của V là:
A.2,24 lít B.3,36 lít
C.4,48 lít D.6,72 lít
Câu 10. Khối lượng riêng của một chất hữu cơ (X) ở thể khí (đktc) là 2,5 g/l. Phân tử khối của (X) là:
A.30 u B.42 u
C.56 u D.70 u
Câu 11. Công thức cấu tạo nào sau đây ứng với công thức phân tử là C2H6O?
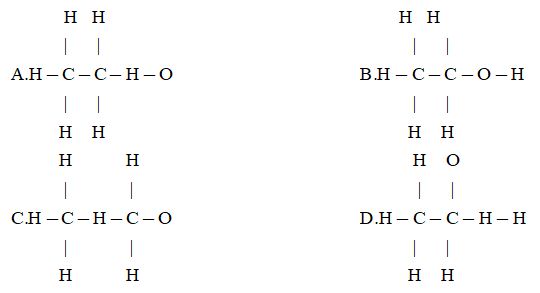
Câu 12. Để xác định phân tử khối của các chất khó bay hơi hoặc không bay hơi, người ta sử dụng phương pháp nào sau đây?
A.Phương pháp nghiệm lạnh.
B.Phương pháp nghiệm sôi.
C.Dựa vào tỉ khối hơi của oxi và nitơ.
D.Kết hợp cả A và B.
II. PHẦN TỰ LUẬN
Câu 13. Hãy xác định khối lượng anhiđrit axetic cần hòa tan trong 949 gam nước để điều chế được dung dịch axit axetic 6%.
Câu 14. Cần bao nhiêu lít N2 và H2 (đktc) để điều chế được 102 gam NH3. Biết hiệu suất phản ứng là 20%.
Câu 15. Một hiđrocacbon Y mạch hở, ở thể khí, khối lượng của V lít khí này bằng 2 lần khối lượng của V lít N2 đo ở cùng điều kiện nhiệt độ và áp suất. Xác định công thức phân tử của hiđrocacbon Y đem dùng.
Câu 16. Cho 5,04 lít khí CO2 (đktc) hấp thụ hoàn toàn bởi 270ml dung dịch NaOH 1M. Dung dịch thu được chứa muối nào và bao nhiêu mol?
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
B |
C |
B |
A |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
D |
A |
C |
D |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
C |
C |
B |
D |
II. PHẦN TỰ LUẬN
Câu 13.
Gọi x là khối lượng CH3COOH thu được sau phản ứng
Mà
Từ (1)
đem dùng
Câu 14.
Cách 1. Ta có:
Phản ứng:
Từ (1)
(lít)
và
(lít)
Vì hiệu suất H = 20% nên lượng N2 và H2 thực tế đem dùng là:
cần dùng = (lít)
cần dùng = (lít).
Cách 2.

Từ (1) suy ra thể tích H2 tham gia phản ứng là:
(lít)
Và thể tích N2 phản ứng là:
(lít)
Vì H = 20% nên:
cần dùng = (lít)
cần dùng = (lít).
Câu 15.
Theo đề bài, ta có:
Gọi công thức tổng quát của hiđrocacbon: CxHy
nghiệm hợp lí: .
Câu 16.
Ta có:
Và
Lập tỉ số:
Tạo 2 muối: NaHCO3 và Na2CO3
Theo đề bài, ta có hệ phương trình:
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 16
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 16)
I. PHẦN TRẮC NGHIỆM
Câu 1. Nồng độ của ion H+ trong dung dịch CH3COOH 0,1M là 0,025M. Độ điện li của dung dịch trên là:
A.2,5% B.25%
C.1,25% D.5%
Câu 2. Xét quá trình sau: Trong đó nước đóng vai trò như là:
A. một tác nhân oxi hóa.
B. một axit theo Bronstet.
C. một bazơ theo Bronstet.
D. một axit theo Areniut.
Câu 3. Cho các ion: Có bao nhiêu ion mang tính bazơ theo định nghĩa axit – bazơ của Bronstet?
A.2 B.3
C.5 D.4
Câu 4. Dẫn 8,96 lít khí NH3 (đktc) qua ống nghiệm chứa 60 gam bột CuO và nung nóng. Biết hiệu suất phản ứng đạt 75%. Thể tích khí N2 thu được ở (đktc) là:
A.6,72 lít B.4,48 lít
C.3,36 lít D.21,2 lít
Câu 5. Xét phản ứng oxi hóa – khử sau:
Nếu tỉ lệ thì hệ số của các chất phản ứng lần lượt là:
A. (a + 3b); (6a + 12b)
B. (3a + b); (3a + 3b)
C. (a + 3b); (2a + 5b)
D. (3a + 5b); (2a + 2b)
Câu 6. Cho a gam bột nhôm tác dụng với dung dịch HNO3 loãng, dư, thu được hỗn hợp khí gồm 224ml khí NO (đktc) và 336 lít khí N2O (đktc). Giá trị của a là:
A.2,50 gam B.1,50 gam
C.1,75 gam D.1,35 gam.
Câu 7. Cho 50ml dung dịch K2CO3 0,2M hấp thụ với 112ml khí CO2 (đktc). Khối lượng các chất trong dung dịch sau phản ứng là:
A.0,96 gam K2CO3 và 1 gam KHCO3
B.0,75 gam K2CO3 và 2,1 gam KHCO3
C.1 gam KHCO3
D.2,5 gam K2CO3 và 1,25 gam KHCO3
Câu 8. Dùng CO khử hoàn toàn một oxit kim loại có dạng RxOy (R chiếm 72,41% khối lượng) thu được 16,8 gam kim loại R. Công thức của oxit đem dùng là:
A.Al2O3 B.Cr2O3
C.Fe2O3 D.Fe3O4
Câu 9. Thổi khí CO dư qua ống đựng bột một oxit sắt ở nhiệt độ cao. Sau khi phản ứng kết thúc thu được 0,84 gam sắt và dẫn khí sinh ra vào nước vôi trong dư thu được 2 gam kết tủa. Công thức oxit sắt đem dùng là:
A.Fe2O3 B.Fe3O4
C.FeO D.Fe3O2
Câu 10. Hai hợp chất (X) và (Y) là đồng phân của nhau. Điểm khác nhau giữa (X) và (Y) là:
A. số nguyên tử cacbon.
B. số nguyên tử hiđro.
C. công thức cấu tạo.
D. công thức phân tử.
Câu 11. Đốt cháy hoàn toàn a gam chất hữu cơ (X) chứa C, H, O phải dùng vừa hết 0,15 mol O2 (đktc) thu được 2,24 lít khí CO2 (đktc) và 2,7 gam H2O. Công thức phân tử của (X) là:
A.CH4O B.C2H6O
C.C3H8O D.C4H10O
Câu 12. Số đồng phân của hợp chất ứng với công thức phân tử C5H12 là:
A.3 B.4
C.5 D.6
II. PHẦN TỰ LUẬN
Câu 13. Cho 300ml dung dịch axit CH3COOH 0,2M . Để độ điện li tăng gấp đôi, thì thể tích (ml) nước cất cần thêm vào là bao nhiêu?
Câu 14. Khi hòa tan 2,5 gam hợp kim đồng, sắt và vàng vào axit nitric loãng thì tạo thành 672ml khí nitơ monooxit (đktc) và 0,02 gam chất rắn không tan. Xác định thành phần phần trăm các kim loại trong hợp kim.
Câu 15. Đốt cháy 200ml hơi một chất hữu cơ A chứa C, H và O trong 900ml O2. Thể tích của hỗn hợp khí thu được là 1,3 lít. Sau khi cho hơi nước ngưng tụ chỉ còn 700ml. Tiếp theo cho qua dung dịch KOH đặc, chỉ còn 100ml (các thể tích khí đều đo ở cùng diều kiện). Xác định công thức phân tử của A.
Câu 16. Cho một dung dịch (X) có nồng độ H+ bằng 0,001M. Tính giá trị pH và của dung dịch đã cho.
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
B |
C |
B |
C |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
A |
D |
A |
D |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
B |
C |
B |
A |
II. PHẦN TỰ LUẬN
Câu 13.
Ta có:
Khi pha loãng độ điện li của axit là: 18,974.10-3 ứng với nồng độ:
Vậy pha loãng 0,2 : 0,05 = 4 lần, tức phải thêm 900ml nước vào 300ml dung dịch CH3COOH 0,2M để được 1,2 lít dung dịch CH3COOH mới nồng độ 0,05M.
Câu 14.
Ta có:
Gọi x là số mol NO sinh ra trong phản ứng (1)
Số mol NO sinh ra trong phản ứng (2) là (0,03 – x)

Theo đề bài, ta có phương trình:
Suy ra:
Câu 15.
Sơ đồ phân tích đề bài:

Dựa vào sơ đồ, ta tính được:
phản ứng
phản ứng
Vậy công thức phân tử của A: C3H6O.
Câu 16.
Ta có:
Mà:
.
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 17
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 17)
Câu 1. Cho các dung dịch sau: Số dung dịch có pH>7 là:
A.3 B.2
C.1 D.Không xác định
Câu 2. Xét cân bằng: Trong đó ion C2H5O– đóng vai trò là:
A.một tác nhân oxi hóa.
B.một axit theo Bronstet.
C.một bazơ theo Bronstet.
D.một axit theo Areniut.
Câu 3. Trong dung dịch Fe2(SO4)3 loãng chứa 0,9 mol ion thì dung dịch có chứa:
A.0,9 mol Fe2(SO4)3
B.0,6 mol Fe2(SO4)3
C.0,3 mol Fe2(SO4)3
D.Cả B, C đều đúng.
Câu 4.Cho một lượng dung dịch X gồm NaNO3, KNO3 và Ba(NO3)2. Ban đầu thêm một ít bột kẽm vào X thì không có hiện tượng gì. Sau đó nhỏ tiếp một ít dung dịch NaOH vào thì hiện tượng nào mô tả sau đây la đúng?
A.Có khí mùi khai thoát ra.
B.Có kết tủa trắng.
C.Có khí màu nâu đỏ bay ra.
D.Có khí không màu bay ra và hóa nâu trong không khí.
Câu 5. Để điều chế 300 gam dung dịch HNO3 6,3% từ NaNO3 chứa 10% tạp chất và axit H2SO4 đặc với hiệu suất phản ứng là 90% thì khối lượng NaNO3 đem dùng là:
A.30,48 gam B.31,48 gam
C.52,10 gam D.40,48 gam
Câu 6. Cho 12,9 gam hỗn hợp gồm Al và Mg phản ứng với 100ml dung dịch hỗn hợp gồm HNO3 4M và H2SO4 7M (đậm đặc) thu được 0,1 mol mỗi khí SO2, NO và N2O. Số mol của mỗi kim loại trong hỗn hợp ban đầu lần lượt là:
A. 0,3 mol và 0,4 mol
B. 0,1 mol và 0,7 mol
C. 0,3 mol và 0,2 mol
D. 0,5 mol và 0,2 mol
Câu 7. Dẫn khí CO qua ống sứ đựng a gam Fe2O3 ở nhiệt độ cao một gian, thu được 6,72 gam hỗn hợp gồm 4 chất rắn. Đem hòa tan hỗn hợp này vào dung dịch HNO3 dư tạo thành 0,448 lít khí NO. Giá trị của a là:
A.6,50 gam B.7,20 gam
C.9,50 gam D.12,25 gam.
Câu 8. Dãy muối nào sau đây không bị nhiệt phân hủy?
Câu 8. Dẫn V lít khí CO2 (đktc) hấp thụ hoàn toàn bởi 2 lít dung dịch Ba(OH)2 0,0225 mol/l, thu được 2,955 gam kết tủa. Giá trị của V là:
A. 2,24 lít hoặc 10,0 lít.
B. 4,48 lít hoặc 6,72 lít.
C. 1,68 lít hoặc 1,12 lít.
D. 0,336 lít hoặc 1,68 lít.
Câu 10. Số đồng phân chứa nhóm OH của hợp chất phản ứng với công thức phân tử C4H10O là:
A.2 B.3
C.4 D.5
Câu 11. Hợp chất hữu cơ nào sau đây có đồng phân cis – trants?
A.CH3CH=CHCH3
B.
C.CH3CH=CHC2H5
D. Cả A và C đều đúng.
Câu 12. Số đồng phân ứng với công thức phân tử C3H6Cl2 là:
A.4 B.3
C.2 D.5
II. PHẦN TỰ LUẬN
Câu 13. Xác định khối lượng nước cần hòa tan 188 gam kali oxit để thu được dung dịch KOH 5,6%.
Câu 14. Hòa tan a gam nhôm vào dung dịch HNO3 dư, thu được 10,08 lít khí NO2 (đktc). Tính khối lượng kim loại nhôm đã dùng.
Câu 15. Chất hữu cơ B có tỉ khối hơi đối với etan là 2. Hãy xác định công thức phân tử của B, biết B chỉ chứa C, H, O.
Câu 16. Lấy 2,5ml dung dịch CH3COOH 4M rồi pha loãng với nước thành 1 lít dung dịch A. Hãy tính độ điện li của axit axetic và pH của dung dịch A, biết rằng trong 1ml A có 6,28.1018 ion và phân tử axit khong phân li.
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
A |
C |
D |
A |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
C |
B |
C |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
D |
C |
D |
A |
II. PHẦN TỰ LUẬN
Câu 13. Cách 1:
Ta có:
Từ (1)
Mà:
Cách 2: Gọi x là khối lượng của nước cần dùng
Suy ra khối lượng dung dịch thu được: (188 + x) gam
Ta có:
Từ (2)
Mà:
Câu 14.
Ta có:
Từ (1)
Câu 15.
Gọi công thức tổng quát của B: CxHyOz (với x, y, z )
Ta có:
Từ (1)
+) Khi
(2)
Cách 1.
Vì
Từ (2)
Vậy nghiệm duy nhất: CTPT (B): C3H8O.
Cách 2.Lập bảng biện luận (với nguyên dương). Biện luận phương trình: y = 44 – 12x
Bảng biện luận:
Bảng biện luận:
|
x |
1 |
2 |
3 |
4 |
|
y |
32 |
20 |
8 |
< 0 |
Vậy công thức phân tử của B: C3H8O.
+) Khi
(3)
Cách 1.
Vì
và từ (3)
Suy ra
Vậy:
CTPT (B): C2H4O2.
Cách 2.
Lập bảng biện luận ( với nguyên dương).
Biện luận phương trình (3).
Vậy công thức phân tử của B: C2H4O2.
+) Khi (loại).
Câu 16.
Số mol CH3COOH là:
Trong 1 lít dung dịch sau khi pha loãng có 6,28.108.103 = 6,28.1021 hạt vi mô (ion và phân tử axit không phân li).
Phương trình phân li:

Trong 1 lít dung dịch có:
Mà tổng số mol sau khi cân bằng: 0,01 + x (mol)
Vậy:
Và
Đề thi Học kì 1 Hóa học lớp 11 có đáp án năm 2022 (20 đề) – Đề 18
Phòng Giáo dục và Đào tạo …
Đề thi Học kì 1
Năm học 2022 – 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 18)
I. PHẦN TRẮC NGHIỆM
Câu 1. Dung dịch KOH 0,001M cần pha loãng bằng nước bao nhiều lầm để được dung dịch có pH=9?
A.80 lần B.90 lần
C.100 lần D.110 lần
Câu 2. Biết độ điện li của dung dịch axit CH3COOH 1,2M là 1,5%. Nồng độ mol/l của ion CH3COO– trong dung dịch trên là:
A. 0,018M B. 0,015M
C. 0,012 M D. 0,014M.
Câu 3. Sau khi trộn 100ml dung dịch HCl 1M với 400ml dung dịch NaOH 0,375M thì pH dung dịch sau khi pha trộn là:
A.11,0 B.11,5
C.13,0 D.14,0
Câu 4. Cho 1,92 gam Cu tác dụng vừa hết với V lít dung dịch HNO3 0,1M loãng. Giá trị của V là:
A. 0,80 lít B. 0,85 lít
C. 0,90 lít. D. 0,95 lít.
Câu 5. Ngâm một vật bằng đồng có khối lượng 10 gam vào 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Khối lượng của vật sau phản ứng là:
A. 10,50 gam B. 11,25 gam
C. 10,76 gam D. 9,50 gam.
Câu 6. Cho 12,8 gam đồng tác dụng hết với dung dịch HNO3 thu được hỗn hợp khí gồm NO và NO2,
có tỉ khối hơi đối với H là 18,5. Thể tích hỗn hợp khí thu được (ở đktc) là:
A. 3,36 lít B. 2,24 lít
C. 6,72 lít D. 4,48 lít.
Câu 7. Cho 0,15 mol hỗn hợp NaHCO3 và MgCO3 tác dụng hết với dung dịch HCl. Khí thoát ra được dẫn vào dung dịch Ca(OH)2 dư thu được kết tủa có khối lượng là:
A. 8 gam B. 15 gam
C. 20 gam D. 34 gam.
Câu 8. Khử 32 gam Fe2O3 bằng khí CO dư ở nhiệt độ cao. Dẫn sản phẩm sinh ra vào bình Ca(OH)2 dư, thu được a gam kết tủa. Giá trị của a là:
A. 57,3 gam B. 58,2 gam
C. 59,0 gam D. 60,0 gam.
Câu 9. Cho 24,4 gam hỗn hợp gồm Na2CO3 và K2CO3 tác dụng vừa đủ với dung dịch BaCl2, sau phản ứng thu được 39,4 gam kết tủa. Cô cạn dung dịch sau khi tách bỏ kết tủa, thu được a gam muối clorua khan. Giá trị của a là:
A. 26,6 gam B. 16,9 gam
C. 20,5 gam D. 18,5 gam
Câu 10. Trong phân tử của hợp chất nào sau đây, các nguyên tử cacbon cùng nằm trên một đượng thẳng?
A. CH3 – CH=CH2.
B. CH3 – CH2 –CH2 –CH3
C. CH3 –CH2 –CH3
D. .
Câu 11. Cho các hợp chất: Hợp chất nào sau đây có hàm lượng cacbon cao nhất?
A. C2H6 B. C2H2
C. C6H12O6 D. C2H4O2
Câu 12. Đốt cháy hoàn toàn một hiđrocacbon (X) thu được Vậy X là:
A. C2H6 B. C3H6
C. CH4 D. C2H4
II. PHẦN TỰ LUẬN
Câu 13. Tính độ điện li của axit axetic trong dung dịch 0,01M; nếu trong 500ml dung dịch có 3,13.1021 phân tử và ion. Lấy số Avogađro = 6,02.1023.
Câu 14. Hòa tan 1,76 gam hỗn hợp magie và magie oxit bằng dung dịch axit clohiđric. Sau đó làm kết tủa ion Mg2+ dưới dạng muối kép MgNH4PO4 bằng hỗn hợp natri hiđrophotphat và amoniac. Sau đó đem nung kết tủa thì thu được 6,66 gam mgie điphotphat Mg2P2O7. Tính khối lượng magie và magie oxit trong hỗn hợp ban đầu.
Câu 15. Một dung dịch CH3COOH 0,1M có độ điện li là 1,32%. Xác định hằng số phân li của axit ở trên?
Câu 16. Phải trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào để thu được dung dịch có pH = 6?
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
C |
A |
C |
A |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
C |
D |
B |
D |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
A |
D |
B |
C |
II. PHẦN TỰ LUẬN
Câu 13. Cách 1:
Trong 1 lít dung dịch CH3COOH có 6,26.1021 hạt.
Trong 0,01M có 6,02.1021 phân tử.
Phương trình điện li:
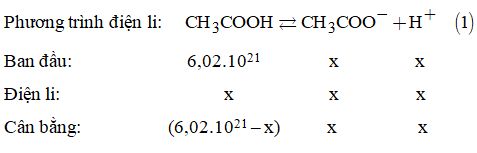
Ta có:
Vậy độ điện li:
Cách 2.
Phương trình điện li của axit axetic:

Vậy độ điện li:
Câu 14.
Các phản ứng hòa tan Mg và MgO
Phản ứng tạo kết tủa:
Phản ứng phân hủy khi nung:
Để giải bài toán trên, ta không cần đến các phản ứng mà chú ý đến hai sơ đồ:
Gọi a và b là số mol của Mg và MgO
Ta có: mhỗn hợp =24a + 40b = 1,76 (1)
Theo sơ đồ trên, ta thấy: số mol của Mg và số mol của MgO gấp 2 lần số mol Mg2P2O7. Do đó:
Giải hệ phương trình (1) và (2), ta được:
Vậy:
Khối lượng của Mg là:
Khối lượng của MgO là:
Câu 15.
Phương trình điện li:
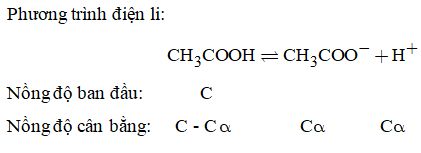
vì axit yếu nên
Do đó,
Câu 16.
Gọi thể tích của axit là V1 và thể tích của kiềm là V2.
Vì sau khi trộn axit dư nên số mol axit dư là: (V1 – V2).10-5 mol.