Lý thuyết Hóa học lớp 10 Bài 10: Liên kết cộng hóa trị
A. Lý thuyết Liên kết cộng hóa trị
I. Sự hình thành liên kết cộng hóa trị
1. Sự hình thành liên kết cộng hóa trị
– Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
– Liên kết cộng hóa trị được hình thành giữa các nguyên tử của cùng một nguyên tố hoặc giữa các nguyên tử của các nguyên tố không khác nhau nhiều về độ âm điện.
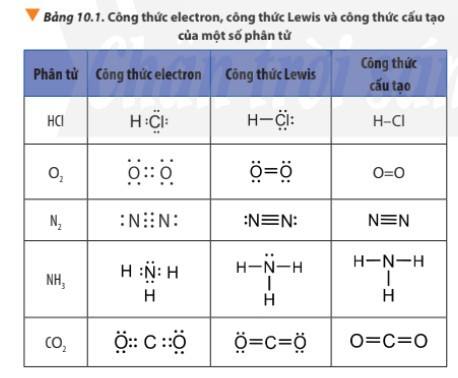
Ví dụ 1: Sự hình thành liên kết cộng hóa trị trong phân tử hydrogen chloride
+ Nguyên tử H có 1 electron ở lớp ngoài cùng, nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để đạt được cấu hình electron của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron để tạo nên 1 cặp electron chung cho cả 2 nguyên tử.
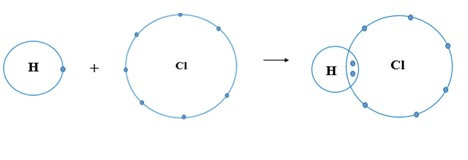
+ Cặp electron chung giữa 2 nguyên tử H và Cl được biểu diễn bằng 1 gạch nối “–”, đó là liên kết đơn. Do đó, liên kết trong phân tử HCl còn được biểu diễn là H – Cl.
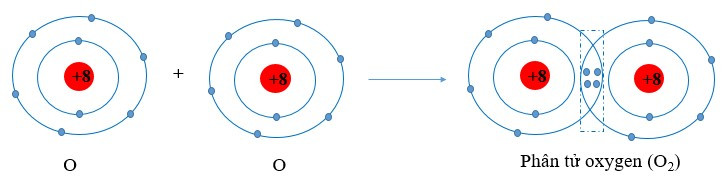
Ví dụ 2: Sự hình thành liên kết cộng hóa trị trong phân tử oxygen (O2)
Nguyên tử oxygen (O) có cấu hình electron là 1s22s22p4. Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử O đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử O cùng góp 2 electron để tạo nên 2 cặp electron dùng chung cho cả hai nguyên tử.
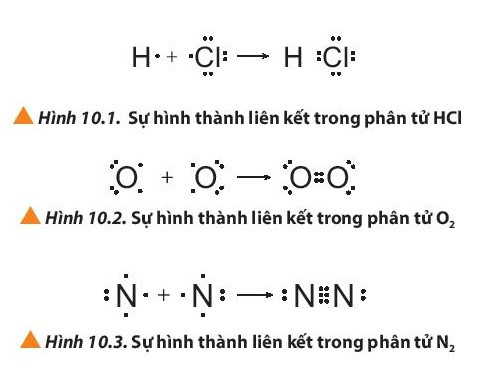
+ Giữa hai nguyên tử oxygen trong phân tử O2 có hai cặp electron chung, được biểu diễn bằng hai gạch nối “=”, đó là liên kết đôi. Do đó liên kết trong phân tử O2 được biểu diễn là O=O.
Ví dụ 3: Sự hình thành liên kết cộng hóa trị trong phân tử nitrogen.
+ Mỗi nguyên tử N có 5 electron ở lớp ngoài cùng. Để đạt được cấu hình electron của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 3 electron. Vì vậy, mỗi nguyên tử N cùng góp 3 electron để tạo nên 3 cặp electron chung cho cả 2 nguyên tử.
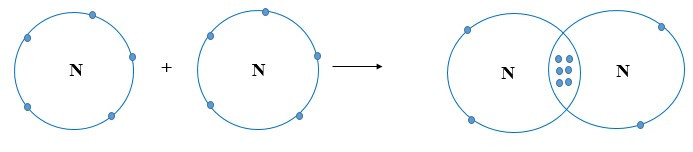

+ Ba cặp electron chung giữa 2 nguyên tử N được biểu diễn bằng ba gạch nối “≡”, đó là liên kết ba. Do đó, liên kết trong phân tử N2 còn được biểu diễn là N ≡ N.
Chú ý:
+ Các công thức H – Cl; O = O; N ≡ N gọi là công thức cấu tạo của HCl; O2; N2.
+ Liên kết đơn là liên kết được tạo bởi 1 cặp electron dùng chung giữa hai nguyên tử, biểu diễn bằng một gạch nối “–”
+ Liên kết đôi là liên kết được tạo bởi 2 cặp electron dùng chung giữa hai nguyên tử, biểu diễn bằng hai gạch nối “=”
+ Liên kết ba là liên kết được tạo bởi 3 cặp electron dùng chung giữa hai nguyên tử, biểu diễn bằng ba gạch nối “≡”
2. Tìm hiểu cách viết công thức Lewis
– Công thức Lewis biểu diễn sự hình thành liên kết hóa học giữa các nguyên tử trong một phân tử.
– Công thức Lewis của một phân tử được xây dựng từ công thức electron của phân tử, trong đó mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “–”.
II. Liên kết cho – nhận
– Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hóa trị, trong đó cặp electron chung chỉ do một nguyên tử đóng góp.
– Nguyên tử “cho” là nguyên tử đóng góp cặp electron chung, nguyên tử đó phải còn cặp electron chưa liên kết.
– Nguyên tử “nhận” là nguyên tử không đóng góp electron, nguyên tử đó phải còn orbital trống, không chứa electron.
– Để biễu diễn liên kết cho – nhận, một mũi tên được hướng từ nguyên tử cho sang nguyên tử nhận để phân biệt với các liên kết còn lại.
Ví dụ: Sự tạo thành liên kết cho – nhận trong ion NH4+
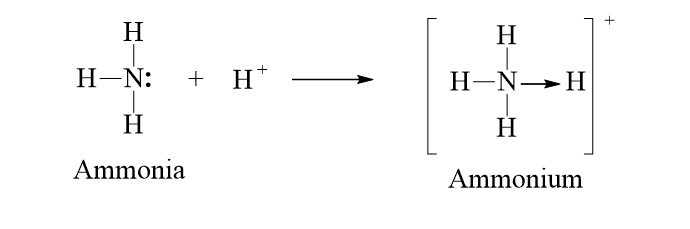
+ Trong phân tử NH3, nguyên tử N còn 1 cặp electron chưa tham gia liên kết, ion H+ có orbital trống, không chứa electron. Khi cho NH3 kết hợp với ion H+, nguyên tử N sử dụng một cặp electron chưa liên kết làm cặp electron chung với ion H+ tạo thành ion NH4+.
+ Nguyên tử N đóng góp cặp electron chung nên là nguyên tử cho.
+ Ion H+ không đóng góp electron, đóng vai trò nhận electron.
III. Phân biệt các loại liên kết dựa theo độ âm điện
1. Phân biệt liên kết cộng hóa trị phân cực và không phân cực
– Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị trong đó cặp electron chung không lệch về phía nguyên tử nào.
Ví dụ: Liên kết cộng hóa trị trong các phân tử H2, Br2 là liên kết cộng hóa trị không phân cực.
![]()
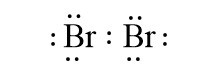
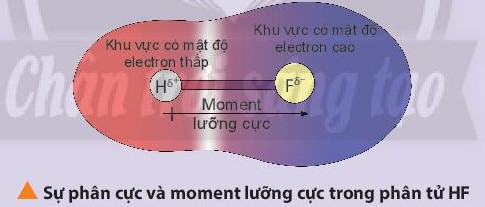
– Liên kết cộng hóa trị phân cực là liên kết cộng hóa trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
Ví dụ: Liên kết cộng hóa trị trong các phân tử HBr, H2O là liên kết cộng hóa trị phân cực.
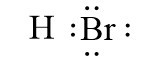
![]()
2. Phân biệt loại liên kết trong phân tử dựa trên giá trị hiệu độ âm điện
– Có thể dựa vào hiệu độ âm điện (∆χ) giữa hai nguyên tử tham gia liên kết để dự đoán loại liên kết giữa chúng.
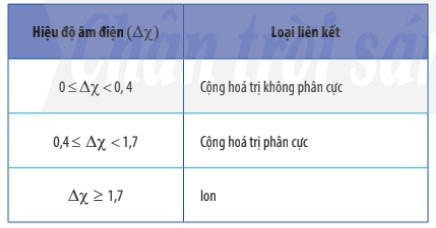
Ví dụ:
+ Trong phân tử MgCl2
![]()
⇒ Liên kết Mg-Cl trong phân tử MgCl2 là liên kết ion.
+ Trong phân tử CO2
![]()
⇒ Liên kết C=O trong phân tử CO2 là liên kết cộng hóa trị phân cực.
+ Trong phân tử C2H4
![]()
⇒ Liên kết C-H trong phân tử C2H4 là liên kết cộng hóa trị không phân cực.
IV. Sự hình thành liên kết ?, ? và năng lượng liên kết
1. Tìm hiểu sự hình thành liên kết ? và liên kết ?
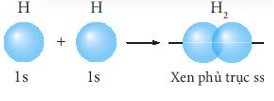
– Liên kết σ là loại liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử.
Ví dụ:
+ Sự xen phủ trục giữa 2 AO 1s của hai nguyên tử hydrogen hình thành liên kết σ trong phân tử H2.
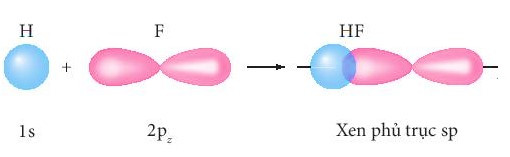
+ Sự xen phủ giữa AO 1s của nguyên tử H và AO 2p của nguyên tử F hình thành liên kết σ trong phân tử HF.
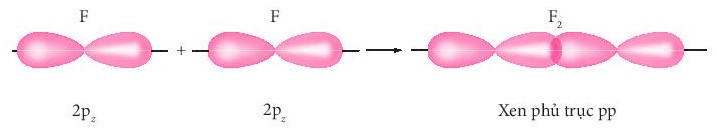
+ Sự xen phủ giữa hai AO 2p của hai nguyên tử fluorine hình thành liên kết σ trong phân tử fluorine.
– Liên kết π là loại liên kết cộng hóa trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ nằm hai bên đường nối tâm hai nguyên tử.
Ví dụ:
Sự xen phủ các AO hình thành liên kết σ và liên kết π trong phân tử oxygen.
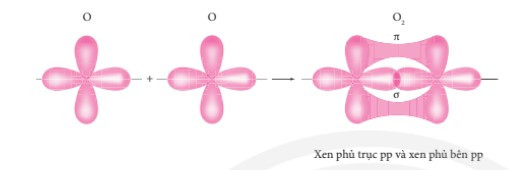
Chú ý:
– Liên kết đơn gồm 1 liên kết σ.
– Liên kết đôi gồm 1 liên kết σ và 1 liên kết π.
– Liên kết ba gồm 1 liên kết σ và hai liên kết π.
– Liên kết σ bền vững hơn liên kết π.
2. Tìm hiểu khái niệm năng lượng liên kết (Eb)
– Năng lượng liên kết của một liên kết hóa học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí, tạo thành các nguyên tử ở thể khí.
– Năng lượng liên kết đặc trưng cho độ bền liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và ngược lại.
Ví dụ:
N2(g) → 2N(g) Eb = 945 kJ/ mol
Ta nói năng lượng liên kết trong phân ử N2 là 945 kJ/ mol. Điều này có nghĩa cần cung cấp 945 kJ để phá vỡ 1 mol khí N2 thành các nguyên tử ở thể khí.
– Đối với các phân tử nhiều nguyên tử, tổng năng lượng liên kết trong phân tử bằng năng lượng cần cung cấp để phá vỡ hoàn toàn 1 mol phân tử đó ở thể khí thành các nguyên tử ở thể khí.
Ví dụ:
Tổng năng lượng liên kết trong phân tử CH4 là 1660 kJ/ mol.
CH4 (g) → C(g) + 4H(g) Eb = 1660 kJ/ mol
Do đó, năng lượng liên kết trung bình của một liên kết C – H là:
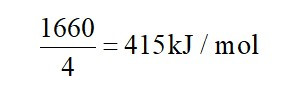
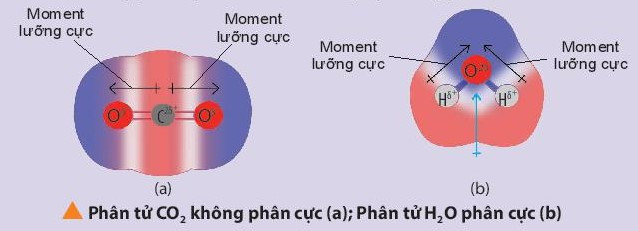
Chú ý: Nhận biết phân tử phân cực và phân tử không phân cực:
+ Phân tử phân cực là phân tử có tổng tất cả moment lưỡng cực trong phân tử khác không. Các phân tử phân cực thường tan tốt trong nước và các dung môi phân cực khác.
+ Phân tử không phân cực là phân tử có tổng tất cả các moment lưỡng cực trong phân tử bằng không. Phân tử không phân cực thường hòa tan tốt trong các dung môi không phân cực.
B. Trắc nghiệm Liên kết cộng hóa trị
Câu 1. Cho công thức Lewis của phân tử NH3 dưới đây. Số electron dùng chung của N là
A. 2 electron dùng chung
B. 3 electron dùng chung
C. 6 electron dùng chung
D. 5 electron dùng chung
Hướng dẫn giải
Đáp án đúng là: C
Xung quanh nguyên tử N có tổng cộng 3 nối đơn (−) mà mỗi nối đơn biểu diễn 1 cặp electron dùng chung ⇒ có 6 electron dùng chung.
Câu 2. Công thức biểu diễn cấu tạo nguyên tử qua các liên kết và các electron hóa trị riêng là
A. công thức phân tử
B. công thức electron
C. công thức Lewis
D. công thức đơn giản nhất
Hướng dẫn giải
Đáp án đúng là: C
Công thức biểu diễn cấu tạo nguyên tử qua các liên kết (cặp electron dùng chung) và các electron hóa trị riêng là công thức Lewis.
Câu 3. Trong một phân tử CO2 có số cặp electron chung là
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Đáp án đúng là: D
O (Z = 8): [He]2s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron bền vững ⇒ góp 2 electron.
C (Z = 6): [He]2s22p2 ⇒ có 4 electron lớp ngoài cùng ⇒ xu hướng nhận 4 electron để đạt cấu hình electron bền vững ⇒ góp 4 electron tạo 4 cặp electron dùng chung với O.
Sự hình thành liên kết cộng hóa trị trong phân tử CO2:
Vậy trong một phân tử CO2 có 4 cặp electron chung.
Câu 4. Công thức electron của phân tử H2O là
A.
B.
C.
D.
Hướng dẫn giải
Đáp án đúng là: A
H (Z = 1): 1s1 ⇒ có 1 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron bền vững của khí hiếm He ⇒ góp 1 electron.
O (Z = 8): [He]2s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron bền vững ⇒ góp 2 electron tạo hai cặp electron dùng chung với H.
Công thức electron của phân tử H2O là:
Câu 5. Liên kết trong phân tử nào dưới đây là liên kết đôi?
A. NH3
B. HCl
C. O2
D. N2
Hướng dẫn giải
Đáp án đúng là: C
O (Z = 8): [He]2s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron bền vững ⇒ góp 2 electron.
Công thức electron của phân tử O2 là:
Công thức cấu tạo là: O = O
Vậy liên kết trong phân tử O2 là liên kết đôi.
Câu 6. Liên kết cộng hóa trị là liên kết hình thành giữa hai nguyên tử bằng
A. lực hút tĩnh điện giữa các ion mang điện tích trái dấu
B. một cặp electron chung
C. một hay nhiều cặp electron chung
D. các electron hóa trị riêng
Hướng dẫn giải
Đáp án đúng là: C
Liên kết cộng hóa trị là liên kết hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
Câu 7. Liên kết giữa hai nguyên tử được hình thành bởi một cặp electron chung được gọi là
A. liên kết bội
B. liên kết đơn
C. liên kết đôi
D. liên kết ba
Hướng dẫn giải
Đáp án đúng là: B
Liên kết giữa hai nguyên tử được hình thành bởi một cặp electron chung được gọi là liên kết đơn và được biểu diễn bằng một gạch nối “−”.
Câu 8. Dựa vào số cặp electron chung, liên kết cộng hóa trị được chia thành mấy loại?
A. 2 loại: liên kết σ và liên kết π
B. 2 loại: liên kết cộng hóa trị không phân cực và liên kết cộng hóa trị phân cực
C. 3 loại: liên kết đơn, liên kết đôi và liên kết ba
D. 2 loại: liên kết đơn và liên kết đôi
Hướng dẫn giải
Đáp án đúng là: C
Dựa vào số cặp electron chung, liên kết cộng hóa trị được chia thành 3 loại:
+ Liên kết đơn (1 cặp electron chung)
+ Liên kết đôi (2 cặp electron chung)
+ Liên kết ba (3 cặp electron chung).
Câu 9. Liên kết cộng hóa trị được chia thành liên kết cộng hóa trị không phân cực và phân cực dựa vào
A. số cặp electron chung
B. sự xen phủ các orbital
C. vị trí của các cặp electron chung
D. vị trí của các electron hóa trị riêng
Hướng dẫn giải
Đáp án đúng là: C
Liên kết cộng hóa trị được chia thành liên kết cộng hóa trị không phân cực và phân cực dựa vào vị trí của các cặp electron chung.
+ Liên kết cộng hóa trị không phân cực: cặp electron chung không lệch về phía nguyên tử nào.
+ Liên kết cộng hóa trị phân cực: cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
Câu 10. Trong phân tử N2, mỗi nguyên tử N đã góp 3 electron để tạo cặp electron chung. Nhờ đó mỗi nguyên tử N đã đạt cấu hình electron bền vững của khí hiếm
A. Xe
B. Ne
C. Ar
D. Kr
Hướng dẫn giải
Đáp án đúng là: B
N (Z = 7): 1s22s22p3 có 5 electron lớp ngoài cùng ⇒ mỗi nguyên tử N góp 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
Câu 11. Dựa vào giá trị độ âm điện, liên kết giữa nguyên tử H và Cl thuộc loại
A. liên kết ion
B. liên kết cộng hóa trị có cực
C. liên kết cộng hóa trị không cực
D. liên kết đơn
Hướng dẫn giải
Đáp án đúng là: B
Có χ(H) = 2,2 và χ(Cl) = 3,16
Nên ∆χ = χ(Cl) – χ(H) = 3,16 – 2,2 = 0,96
Mà 0,4 < 0,96 < 1,7 ⇒ liên kết giữa nguyên tử H và Cl thuộc loại liên kết cộng hóa trị có cực.
Câu 12. Dựa vào độ âm điện, liên kết trong phân tử nào dưới đây là liên kết cộng hóa trị không cực?
A. NaCl
B. CH4
C. H2O
D. HCl
Hướng dẫn giải
Đáp án đúng là: B
∆χ = χ(Cl) – χ(Na) = 3,16 – 0,93 = 2,23 ≥ 1,7 ⇒ Liên kết trong phân tử NaCl là liên kết ion.
∆χ = χ(C) – χ(H) = 2,55 – 2,2 = 0,35 < 0,4 ⇒ Liên kết trong phân tử CH4 là liên kết cộng hóa trị không cực.
∆χ = χ(O) – χ(H) = 3,44 – 2,2 = 1,24 mà 0,4 < 1,24 < 1,7 ⇒ Liên kết trong phân tử H2O là liên kết cộng hóa trị có cực.
∆χ = χ(Cl) – χ(H) = 3,16 – 2,2 = 0,96 mà 0,4 < 0,96 < 1,7 ⇒ Liên kết trong phân tử HCl là liên kết cộng hóa trị có cực.
Câu 13. Khẳng định sai là
A. Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết σ
B. Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi π
C. Liên kết đơn còn gọi là liên kết π
D. Liên kết đôi gồm một liên kết σ và một liên kết π, liên kết ba gồm một liên kết σ và hai liên kết π
Hướng dẫn giải
Đáp án đúng là: C
Liên kết đơn còn gọi là liên kết π là khẳng định sai.
Sửa lại: Liên kết đơn còn gọi là liên kết σ.
Câu 14. Các AO xen phủ tạo liên kết đơn trong phân tử Cl2 là
A. 2 AO s xen phủ trục tạo liên kết đơn
B. 1 AO s và 1 AO p xen phủ trục tạo liên kết đơn
C. 2 AO p xen phủ trục tạo liên kết đơn
D. 2 AO ps xen phủ bên tạo liên kết đơn
Hướng dẫn giải
Đáp án đúng là: C
Cl (Z = 17): [Ne]3s23p5
Ô orbital của lớp electron ngoài cùng:
Có 1 AO p chứa electron độc thân.
Do đó liên kết đơn giữa 2 nguyên tử Cl trong phân tử Cl2 được tạo nên từ sự xen phủ trục của 2 AO p.
Câu 15. Cho các phân tử HF, HBr, HI, HCl. Sắp xếp theo chiều tăng dần độ bền liên kết là
A. HF, HBr, HI, HCl
B. HI, HBr, HCl, HF
C. HF, HCl, HBr, HI
D. HBr, HI, HF, HCl
Hướng dẫn giải
Đáp án đúng là: B
Năng lượng liên kết của liên kết H – F trong phân tử HF là 565 kJ mol-1.
Năng lượng liên kết của liên kết H – Cl trong phân tử HCl là 431 kJ mol-1.
Năng lượng liên kết của liên kết H – Br trong phân tử HBr là 364 kJ mol-1.
Năng lượng liên kết của liên kết H – I trong phân tử HI là 297 kJ mol-1.
Do đó, năng lượng liên kết của liên kết trong HF > HCl > HBr > HI.
Giá trị năng lượng liên kết là thức đo độ bền liên kết nên năng lượng liên kết càng lớn thì liên kết càng bền.
Vậy sắp xếp theo chiều tăng dần độ bền liên kết là HI, HBr, HCl, HF.
Bài giảng Hóa học 10 Bài 10: Liên kết cộng hóa trị – Chân trời sáng tạo
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 9: Liên kết ion
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học