Lý thuyết Hóa học lớp 10 Bài 23: Ôn tập Chương 7
A. Lý thuyết Hóa học 10 Chương 7: Nguyên tố nhóm halogen
1. Nguyên tử halogen
Cấu hình lớp electron ngoài cùng của các nguyên tử halogen có dạng: ns2np5 (có 7 electron ở lớp ngoài cùng).
Xu hướng: dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
X + 1e X–
2. Đơn chất halogen
– Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
+ Tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng.
– Tính oxi hóa giảm dần từ fluorine đến iodine.
– Các phản ứng hóa học được sử dụng để diều chế chlorine:
+ Trong công nghiệp:
2NaCl + 2H2O 2NaCl + H2 + Cl2.
+ Trong phòng thí nghiệm:
MnO2 + 4HCl(đặc) MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl(đặc) → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3. Hydrogen halide
– Nhiệt độ sôi của các hydrogen halide
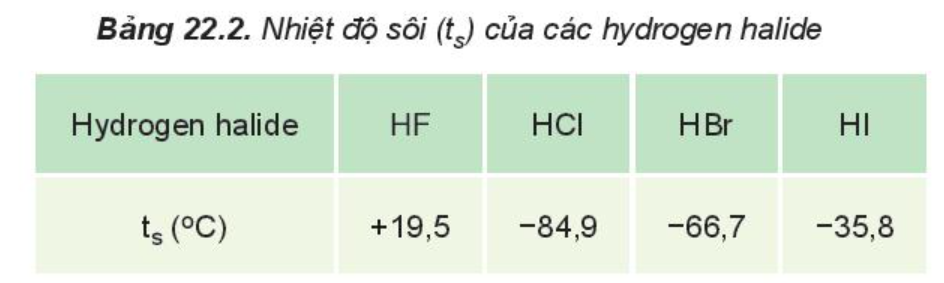
Giải thích:
HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen: .
Từ HCl đến HI, nhiệt độ sôi tăng do:
– Lực tương tác van der Waals giữa các phân tử tăng.
– Khối lượng phân tử tăng.
– Xu hướng biến đổi tính acid:
Trong dãy hydrohalic acid, tính acid tăng từ hydrofluoric acid (yếu) đến hydroiodic acid (rất mạnh).
4. Muối halide
– Phân biệt các ion F–, Cl–, Br–, I– trong dung dịch muối và acid:
Dùng dung dịch silver nitrate (AgNO3) để phân biệt các ion halide (X–).
Trong đó:
+ Khi X– là F– thì không thấy sự biến đổi, do không có phản ứng hóa học xảy ra.
+ Khi X– là Cl– thì xuất hiện kết tủa trắng silver chloride (AgCl).
+ Khi X– là Br– thì xuất hiện kết tủa màu vàng nhạt silver bromide (AgBr).
+ Khi X– là I– thì xuất hiện kết tủa màu vàng silver iodide (AgI).
Ví dụ: Phân biệt các dung dịch: NaF, NaCl, NaBr, NaI.
Dùng dung dịch AgNO3.
+ Không có hiện tượng gì là dung dịch NaF.
+ Xuất hiện kết tủa màu trắng là dung dịch NaCl.
NaCl + AgNO3 NaNO3 + AgCl¯
+ Xuất hiện kết tủa màu vàng nhạt là dung dịch NaBr.
NaBr + AgNO3 NaNO3 + AgBr¯
+ Xuất hiện kết tủa màu vàng là dung dịch NaI.
NaI + AgNO3 NaNO3 + AgI¯
– Tính khử của các ion halide tăng dần theo thứ tự Cl– < Br– < I–.
B. Trắc nghiệm Hóa học 10 Chương 7: Nguyên tố nhóm halogen
Câu 1. Ở điều kiện thường, các halogen
A. ít tan trong nước và trong dung môi hữu cơ như alcohol, benzene.
B. tan nhiều trong nước và trong dung môi hữu cơ như alcohol, benzene.
C. tan nhiều trong nước nhưng tan ít trong dung môi hữu cơ như alcohol, benzene.
D. ít tan trong nước nhưng tan nhiều trong dung môi hữu cơ như alcohol, benzene.
Đáp án: D
Giải thích:
Ở điều kiện thường, các halogen ít tan trong nước nhưng tan nhiều trong dung môi hữu cơ như alcohol, benzene.
Câu 2. Đi từ fluorine đến iodine, tính oxi hóa
A. giảm dần.
B. tăng dần.
C. tăng sau đó giảm dần.
D. giảm sau đó tăng dần.
Đáp án: A
Giải thích:
Halogen là các phi kim điển hình, có tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
Câu 3. Đơn chất halogen nào sau đây phản ứng mạnh với nước ngay ở nhiệt độ thường, giải phóng khí O2?
A. F2.
B. Cl2.
C. Br2.
D. I2.
Đáp án: A
Giải thích:
F2 phản ứng mạnh với nước ngay ở nhiệt độ thường, giải phóng khí O2:
2F2 + 2H2O ® 4HF + O2
Các halogen Cl2, Br2 và I2 phản ứng chậm với nước và mức độ phản ứng giảm dần từ Cl2 đến I2.
Câu 4. Nước Javel được dùng làm chất tẩy rửa, khử trùng. Nước Javel chứa
A. HClO và HCl.
B. NaClO, NaCl và một phần NaOH dư.
C. NaClO và một phần NaOH dư.
D. NaCl và một phần NaOH dư.
Đáp án: B
Giải thích:
Chlorine phản ứng với dung dịch sodium hydroxide ở điều kiện thường, tạo thành nước Javel (Gia-ven):
Cl2 + 2NaOH ® NaCl + NaClO + H2O
Nước Javel (chứa NaClO (sodium hypochlorite), NaCl và một phần NaOH dư) được dùng làm chất tẩy rửa, khử trùng.
Câu 5. Đơn chất Br2 có thể tác dụng với dung dịch
A. NaF.
B. NaCl.
C. NaBr.
D. NaI.
Đáp án: D
Giải thích:
Bromine có thể oxi hóa ion I– trong dung dịch muối iodine.
Br2 + 2NaI ® 2NaBr + I2
Câu 6. Rong biển chứa nhiều nguyên tố
A. iodine.
B. chlorine.
C. fluorine.
D. bromine.
Đáp án: A
Giải thích:
Rong biển chứa nguyên tố iodine.
Câu 7. Các nguyên tử halogen
A. dễ nhường đi 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất.
B. dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất.
C. dễ nhường đi 2 electron để đạt được cấu hình electron bền của khí hiếm gần nhất.
D. dễ nhận thêm 2 electron để đạt được cấu hình electron bền của khí hiếm gần nhất.
Đáp án: B
Giải thích:
Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
ns2np5 + 1e ns2np6
Câu 8. Nguyên tố halogen nào sau đây luôn có số oxi hóa –1 trong mọi hợp chất?
A. Iodine.
B. Bromine.
C. Fluorine.
D. Chlorine.
Đáp án: C
Giải thích:
Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
ns2np5 + 1e ® ns2np6
Do vậy, số oxi hóa đặc trưng của các halogen trong hợp chất là –1.
Khi liên kết với các nguyên tố có độ âm điện lớn, các halogen có thể có các số oxi hóa dương: +1, +3, +5, +7. Tuy nhiên, fluorine có độ âm điện lớn nhất, nên fluorine luôn có số oxi hóa bằng –1 trong mọi hợp chất.
Câu 9. Ở điều kiện thường, đơn chất halogen tồn tại ở dạng phân tử hai nguyên tử, được kí hiệu chung là X2, liên kết hóa học trong phân tử X2 là
A. liên kết ion.
B. liên kết cộng hóa trị không cực.
C. liên kết cộng hóa trị phân cực.
D. liên kết cho – nhận.
Đáp án: B
Giải thích:
Ở điều kiện thường, đơn chất halogen tồn tại ở dạng phân tử hai nguyên tử, được kí hiệu chung là X2, liên kết hóa học trong phân tử X2 là liên kết cộng hóa trị không phân cực.
Câu 10. Ở điều kiện thường, đơn chất chlorine
A. ở thể khí, màu lục nhạt.
B. ở thể lỏng, màu lục nhạt.
C. ở thể khí, màu vàng lục.
D. ở thể lỏng, màu vàng lục.
Đáp án: C
Giải thích:
Ở điều kiện thường, đơn chất chlorine (Cl2) ở thể khí, màu vàng lục.
Câu 11. Trong phòng thí nghiệm, để điều chế chlorine, ta có thể
A. cho kim loại mạnh tác dụng với hydrochloric acid đặc (HCl).
B. cho quặng pyrolusite (MnO2) tác dụng với hydrochloric acid đặc (HCl).
C. điện phân dung dịch muối ăn bão hòa, có màng ngăn giữa các điện cực.
D. điện phân dung dịch HCl.
Đáp án: B
Giải thích:
Điều chế chlorine (Cl2) trong phòng thí nghiệm:
Cho quặng pyrolusite (MnO2) tác dụng với hydrochloric acid đặc:
MnO2 + 4HCl(đặc) ![]() MnCl2 + Cl2 + 2H2O
MnCl2 + Cl2 + 2H2O
Ngoài ra, còn có thể thay MnO2 bằng KMnO4 rắn để điều chế khí Cl2:
2KMnO4 + 16HCl(đặc) ![]() 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2KCl + 2MnCl2 + 5Cl2 + 8H2O
Câu 12. Hydrogen halide nào sau đây có nhiệt độ sôi cao bất thường so với các hydrogen halide còn lại?
A. HF.
B. HCl.
C. HBr.
D. HI.
Đáp án: A
Giải thích:
HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen:
![]()
Câu 13. Trong dãy hydrohalic acid, từ HF đến HI, tính acid
A. giảm dần.
B. tăng dần.
C. không thay đổi.
D. tăng sau đó giảm.
Đáp án: B
Giải thích:
Trong dãy hydrohalic acid, tính acid tăng từ hydrofluoric acid (yếu) đến hydroiodic acid (rất mạnh).
Câu 14. Hydrogen halide nào sau đây được sử dụng trong quá trình sản xuất teflon (dùng làm chất chống dính ở nồi, chảo)?
A. HF.
B. HCl.
C. HBr.
D. HI.
Đáp án: A
Giải thích:
Hydrogen fluoride được sử dụng trong quá trình sản xuất teflon (dùng làm chất chống dính ở nồi, chảo) theo sơ đồ:
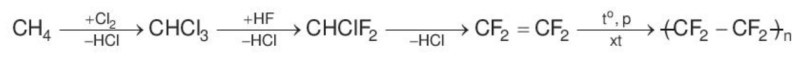
Câu 15. Để phân biệt các dung dịch: NaF, NaCl, NaBr, NaI, ta dùng
A. dung dịch HCl.
B. dung dịch BaCl2.
C. dung dịch Ba(OH)2.
D. dung dịch AgNO3.
Đáp án: D
Giải thích:
Phân biệt các dung dịch: NaF, NaCl, NaBr, NaI.
Dùng dung dịch AgNO3.
+ Không có hiện tượng gì là dung dịch NaF.
+ Xuất hiện kết tủa màu trắng là dung dịch NaCl.
NaCl + AgNO3 ® NaNO3 + AgCl¯
+ Xuất hiện kết tủa màu vàng nhạt là dung dịch NaBr.
NaBr + AgNO3 ® NaNO3 + AgBr¯
+ Xuất hiện kết tủa màu vàng là dung dịch NaI.
NaI + AgNO3 ® NaNO3 + AgI¯
Bài giảng Hóa học 10 Bài 23: Ôn tập Chương 7 – Kết nối tri thức
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Bài 19: Tốc độ phản ứng
Chương 6: Tốc độ phản ứng
Bài 21: Nhóm halogen
Bài 22: Hydrogen halide. Muối halide