Lý thuyết Hóa học lớp 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
A. Lý thuyết Biến thiên enthalpy trong các phản ứng hóa học
I. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
 Ví dụ:
Ví dụ:
Khi than, củi cháy, không khí xung quanh ấm hơn do phản ứng tỏa nhiệt.
Pha viên sủi vitamin C vào nước, khi viên sủi tan, thấy nước trong cốc mát hơn, đó là do xảy ra phản ứng thu nhiệt.
Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phản ứng đốt than là phản ứng tỏa nhiệt, phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
II. Biến thiên enthalpy của phản ứng
1. Biến thiên enthalpy
Hầu hết các quá trình hóa học trong thực tế xảy ra ở điều kiện áp suất không đổi. Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện này gọi là biến thiên enthalpy của phản ứng (nhiệt phản ứng), kí hiệu là DrH.
Phương trình hóa học kèm theo trạng thái của các chất và giá trị DrH gọi là phương trình nhiệt hóa học.
Ví dụ: Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng, tỏa ra nhiệt lượng 571,6 kJ. Phản ứng trên có biến thiên enthalpy = –571,6 kJ, biểu diễn bằng phương trình nhiệt hóa học như sau:
2H2(g) + O2(g) 2H2O(l) = –571,6 kJ
Ví dụ 2: Phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2, tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ. Phản ứng trên có biến thiên enthalpy = +9,0 kJ và biểu diễn bằng phương trình nhiệt hóa học như sau:
Cu(OH)2(s) CuO(s) + H2O(l) = +9,0 kJ
2. Biến thiên enthalpy chuẩn
Biến thiên enthalpy chuẩn là nhiệt tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/l (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 25oC (298K), kí hiệu .
Ví dụ: Phản ứng đốt cháy hoàn toàn 1 mol carbon graphite trong khí oxygen dư (ở điều kiện chuẩn) tạo ra 1 mol CO2, nhiệt lượng tỏa ra là 393,5 kJ. Phương trình nhiệt hóa học của phản ứng được viết như sau:
C(graphite) + O2(g) CO2(g) = –393,5 kJ
3. Ý nghĩa của biến thiên enthalpy
Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt:
> 0: phản ứng thu nhiệt.
Chú ý: Gía trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều.
Ví dụ: Xét 2 phản ứng
CH4(g) + 2O2(g) CO2(g) + 2H2O(l) = –890 kJ
CH3OH(l) + ![]() O2(g) CO2(g) + 2H2O(l) = –726 kJ
O2(g) CO2(g) + 2H2O(l) = –726 kJ
Vậy, khi đốt 1 mol methane (16 g) tỏa ra nhiệt lượng nhiều hơn đốt 1 mol methanol (32 g).
Chú ý: Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng tỏa nhiệt, các phản ứng thu nhiệt thường xảy ra khi đun nóng.
III. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
1. Khái niệm nhiệt tạo thành
Nhiệt tạo thành (DfH) của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định.
Nhiệt tạo thành chuẩn () là nhiệt tạo thành ở điều kiện chuẩn.
Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0. Ví dụ: kJ.
Ví dụ 1: Nước lỏng được tạo thành từ khí hydrogen và khí oxygen theo phản ứng:
H2(g) + O2(g) H2O(l)
Ở điều kiện chuẩn, cứ 1 mol H2O(l) tạo thành từ 1 mol H2(g) và mol O2(g) giải phóng nhiệt lượng là 285,8 kJ.
Như vậy, nhiệt tạo thành của nước lỏng: kJ/mol.
Ví dụ 2: Phản ứng N2(g) + O2(g) NO(g) có biến thiên enthalpy: kJ/mol. Giá trị > 0, tức phản ứng này là phản ứng thu nhiệt.
2. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ).
Ở điều kiện chuẩn: (cđ).
Trong tính toán cần lưu ý đến hệ số của các chất trong phương trình hóa học.
Ví dụ 1: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
SO2(g) + O2(g) SO3(l)
biết nhiệt tạo tạo thành của SO2(g) là –296,8 kJ/mol, của SO3(l) là – 441,0 kJ/mol.
Hướng dẫn giải:
= – 441,0 – (–296,8 + 0×) = –144,2 (kJ).
Ví dụ 2: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
4FeS2(s) + 11O2(g) 2Fe2O3(s) + 8SO2(g)
biết nhiệt tạo thành của các chất FeS2(s), Fe2O3(s) và SO2(g) lần lượt là –177,9 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol.
Hướng dẫn giải:
Tổng nhiệt tạo thành các chất ban đầu là:
(cđ) = = (–177,9)×4 + 0×11 = –711,6 (kJ).
Tổng nhiệt tạo thành các chất sản phẩm là:
= (–825,5)×2 + (–296,8)×8 = –4025,4 (kJ).
Vậy, biến thiên enthalpy của phản ứng:
(cđ) = –4025,4 – (–711,6) = –3313,8 (kJ).
IV. Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết
Biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí), bằng hiệu số giữa tổng năng lượng liên kết của các chất đầu và tổng năng lượng liên kết của các sản phẩm (ở cùng điều kiện nhiệt độ và áp suất).
Ở điều kiện chuẩn: = (cđ) – .
Ví dụ 1: Tính biến thiên enthalpy chuẩn của phản ứng
H2(g) + Cl2(g) 2HCl(g)
biết Eb (H–H) = 436 kJ/mol, Eb (Cl–Cl) = 243 kJ/mol, Eb (H–Cl) = 432 kJ/mol.
Hướng dẫn giải:
Biến thiên enthalpy chuẩn của phản ứng là:
= Eb (H–H) + Eb (Cl–Cl) – 2×Eb (H–Cl) = 436 + 243 – 2×432 = –185 (kJ).
Phản ứng tỏa nhiệt vì khi tạo thành 2 liên kết H–Cl tỏa ra năng lượng lớn hơn năng lượng cần thiết để phá vỡ liên kết H–H và Cl–Cl.
Ví dụ 2: Xác định biến thiên enthalpy chuẩn của phản ứng
C2H4(g) + H2(g) C2H6(g)
biết năng lượng liên kết (ở điều kiện chuẩn):

Hướng dẫn giải:
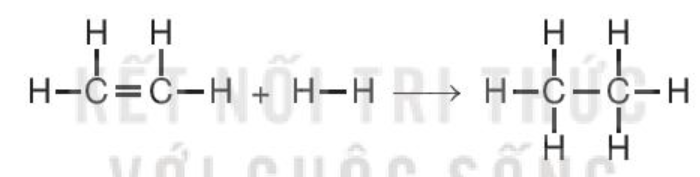
= Eb (C=C) + 4Eb (C–H) + Eb (H–H) – Eb (C–C) – 6Eb (C–H)
= 612 + 4×418 + 436 – 346 – 6×418 = –134 (kJ).
B. Trắc nghiệm Biến thiên enthalpy trong các phản ứng hóa học
Câu 1. Phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2, tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ. Phương trình nhiệt hóa học được biểu diễn như sau:
A. Cu(OH)2(s) ![]() CuO(s) + H2O(l);
CuO(s) + H2O(l); ![]() = –9,0 kJ
= –9,0 kJ
B. Cu(OH)2(s) ![]() CuO(s) + H2O(l);
CuO(s) + H2O(l); ![]() = +9,0 kJ
= +9,0 kJ
C. CuO(s) + H2O(l) ![]() Cu(OH)2(s);
Cu(OH)2(s); ![]() = –9,0 kJ
= –9,0 kJ
D. CuO(s) + H2O(l) ![]() Cu(OH)2(s);
Cu(OH)2(s); ![]() = +9,0 kJ
= +9,0 kJ
Đáp án: B
Giải thích:
Phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2, tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ. Phản ứng trên có biến thiên enthalpy ![]() = +9,0 kJ và biểu diễn bằng phương trình nhiệt hóa học như sau:
= +9,0 kJ và biểu diễn bằng phương trình nhiệt hóa học như sau:
Cu(OH)2(s) ![]() CuO(s) + H2O(l)
CuO(s) + H2O(l) ![]() = +9,0 kJ
= +9,0 kJ
Câu 2. Biến thiên enthalpy chuẩn là nhiệt tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn là:
A. áp suất 1 bar (đối với chất khí), nồng độ 1 mol/l (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 20oC (293K).
B. áp suất 1,5 bar (đối với chất khí), nồng độ 1,5 mol/l (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 20oC (293K).
C. áp suất 1 bar (đối với chất khí), nồng độ 1 mol/l (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 25oC (298K).
D. áp suất 1,5 bar (đối với chất khí), nồng độ 1,5 mol/l (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 25oC (298K)
Đáp án: C
Giải thích:
Biến thiên enthalpy chuẩn là nhiệt tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/l (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 25oC (298K), kí hiệu ![]() .
.
Câu 3. Người ta xác định được một phản ứng hóa học có ![]() > 0. Đây là
> 0. Đây là
A. phản ứng thu nhiệt.
B. phản ứng tỏa nhiệt.
C. phản ứng phân hủy.
D. phản ứng trung hòa.
Đáp án: A
Giải thích:
Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt:
![]() > 0: phản ứng thu nhiệt.
> 0: phản ứng thu nhiệt.
![]()
Câu 4. Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì
A. nhiệt tỏa ra càng ít và nhiệt thu vào càng nhiều.
B. nhiệt tỏa ra càng nhiều và nhiệt thu vào càng ít.
C. nhiệt lượng tỏa ra hay thu vào của phản ứng càng ít.
D. nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều.
Đáp án: D
Giải thích:
Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều.
Ví dụ: Xét 2 phản ứng
CH4(g) + 2O2(g) ![]() CO2(g) + 2H2O(l)
CO2(g) + 2H2O(l) ![]() = –890 kJ
= –890 kJ
CH3OH(l) + 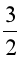 O2(g)
O2(g) ![]() CO2(g) + 2H2O(l)
CO2(g) + 2H2O(l) ![]() = –726 kJ
= –726 kJ
Vậy, khi đốt 1 mol methane (16 g) tỏa ra nhiệt lượng nhiều hơn đốt 1 mol methanol (32 g).
Câu 5. Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng
A. 0.
B. 1.
C. 2.
D. 3.
Đáp án: A
Giải thích:
Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0.
Ví dụ: ![]() kJ.
kJ.
Câu 6. Phản ứng tỏa nhiệt là
A. phản ứng tỏa năng lượng dưới dạng nhiệt.
B. phản ứng thu năng lượng dưới dạng nhiệt.
C. phản ứng trong đó có sự trao đổi electron.
D. phản ứng trong đó có tạo thành chất khí hoặc kết tủa.
Đáp án: A
Giải thích:
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Câu 7. Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phát biểu nào sau đây là đúng?
A. Phản ứng đốt than là phản ứng thu nhiệt, phản ứng phân hủy đá vôi là phản ứng tỏa nhiệt.
B. Phản ứng đốt than là phản ứng tỏa nhiệt, phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
C. Phản ứng đốt than và phản ứng phân hủy đá vôi là phản ứng tỏa nhiệt.
D. Phản ứng đốt than và phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
Đáp án: B
Giải thích:
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phản ứng đốt than là phản ứng tỏa nhiệt, phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
Câu 8. Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện áp suất không đổi gọi là
A. biến thiên năng lượng của phản ứng.
B. biến thiên nhiệt lượng của phản ứng.
C. biến thiên enthalpy của phản ứng.
D. enthalpy của phản ứng.
Đáp án: C
Giải thích:
Hầu hết các quá trình hóa học trong thực tế xảy ra ở điều kiện áp suất không đổi. Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện này gọi là biến thiên enthalpy của phản ứng (nhiệt phản ứng), kí hiệu là DrH.
Câu 9. Phương trình hóa học kèm theo trạng thái của các chất và giá trị DrH gọi là
A. phương trình phân hủy.
B. phương trình trung hòa.
C. phương trình động hóa học.
D. phương trình nhiệt hóa học.
Đáp án: D
Giải thích:
Phương trình hóa học kèm theo trạng thái của các chất và giá trị DrH gọi là phương trình nhiệt hóa học.
Câu 10. Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng được biểu diễn như sau:
2H2(g) + O2(g) 2H2O(l) ![]() = –571,6 kJ
= –571,6 kJ
Nhận xét nào sau đây là đúng?
A. Phản ứng trên tỏa ra nhiệt lượng là 571,6 kJ.
B. Phản ứng trên thu vào nhiệt lượng là 571,6 kJ.
C. Phản ứng trên cần cung cấp một nhiệt lượng là 571,6 kJ để phản ứng xảy ra.
D. Năng lượng của phản ứng là 571,6 kJ.
Đáp án: A
Giải thích:
Phương trình nhiệt hóa học:
2H2(g) + O2(g) 2H2O(l) ![]() = –571,6 kJ
= –571,6 kJ
Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng, tỏa ra nhiệt lượng 571,6 kJ.
Câu 11. Các phản ứng xảy ra ở nhiệt độ phòng thường là
A. phản ứng thu nhiệt.
B. phản ứng tỏa nhiệt.
C. phản ứng oxi hóa – khử.
D. phản ứng thế.
Đáp án: B
Giải thích:
Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng tỏa nhiệt, các phản ứng thu nhiệt thường xảy ra khi đun nóng.
Câu 12. Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
SO2(g) + 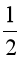 O2(g) SO3(l)
O2(g) SO3(l)
biết nhiệt tạo tạo thành ![]() của SO2(g) là –296,8 kJ/mol, của SO3(l) là – 441,0 kJ/mol.
của SO2(g) là –296,8 kJ/mol, của SO3(l) là – 441,0 kJ/mol.
A. +155,2 kJ.
B. –155,2 kJ.
C. –144,2 kJ.
D. +144,2 kJ.
Đáp án: C
Giải thích:
Phương trình hóa học: SO2(g) + 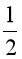 O2(g) ® SO3(l).
O2(g) ® SO3(l).
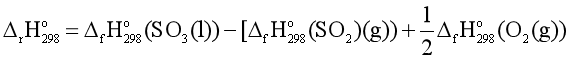
= – 441,0 – (–296,8 + 0×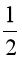 ) = –144,2 (kJ).
) = –144,2 (kJ).
Câu 13. Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
4FeS(s) + 7O2(g) ® 2Fe2O3(s) + 4SO2(g)
biết nhiệt tạo thành ![]() của các chất FeS (s), Fe2O3(s) và SO2(g) lần lượt là –100,0 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol.
của các chất FeS (s), Fe2O3(s) và SO2(g) lần lượt là –100,0 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol.
A. +3105,6 kJ.
B. –3105,6 kJ.
C. +2438,2 kJ.
D. –2438,2 kJ.
Đáp án: D
Giải thích:
Tổng nhiệt tạo thành các chất ban đầu là:
![]() (cđ) =
(cđ) = ![]() = (–100,0)×4 + 0×7 = –400,0 (kJ).
= (–100,0)×4 + 0×7 = –400,0 (kJ).
Tổng nhiệt tạo thành các chất sản phẩm là:
![]()
= (–825,5)×2 + (–296,8)×4 = –2838,2 (kJ).
Vậy, biến thiên enthalpy của phản ứng:
![]() (cđ) = –2838,2 – (–400,0) = –2438,2 (kJ).
(cđ) = –2838,2 – (–400,0) = –2438,2 (kJ).
Câu 14. Tính biến thiên enthalpy chuẩn của phản ứng
N2(g) + O2(g) 2NO(g)
Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol; 945 kJ/mol và 607 kJ/mol.
A. +298 kJ.
B. –298 kJ.
C. +225 kJ.
D. –225 kJ.
Đáp án: C
Giải thích:
Biến thiên enthalpy chuẩn của phản ứng là:
![]() (kJ).
(kJ).
Câu 15. Xác định biến thiên enthalpy chuẩn của phản ứng
C2H2(g) + 2H2(g) C2H6(g)
biết năng lượng liên kết (ở điều kiện chuẩn): Eb (H–H) = 436 kJ/mol; Eb (C–H) = 418 kJ/mol; Eb (CºC) = 837 kJ/mol.
A. +309 kJ.
B. –309 kJ.
C. –358 kJ.
D. +358 kJ.
Đáp án: B
Giải thích:
Phương trình hóa học:
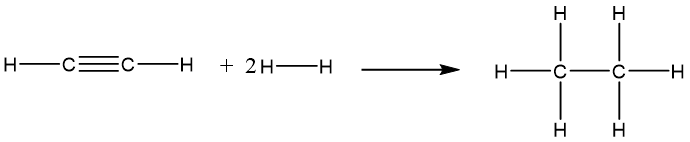
® ![]() = Eb (CºC) + 2Eb (C–H) + 2Eb (H–H) – Eb (C–C) – 6Eb (C–H)
= Eb (CºC) + 2Eb (C–H) + 2Eb (H–H) – Eb (C–C) – 6Eb (C–H)
= 837 + 2×418 + 2×436 – 346 – 6×418 = –309 (kJ).
Bài giảng Hóa học 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học – Kết nối tri thức
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Chương 4: Phản ứng oxi hóa – khử
Chương 5: Năng lượng hóa học
Bài 19: Tốc độ phản ứng
Chương 6: Tốc độ phản ứng