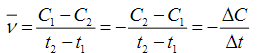Mời các quý thầy cô cùng tham khảo và tải về chi tiết tài liệu dưới đây:
BÀI 36: TỐC ĐỘ PHẢN ỨNG HÓA HỌC.
I.Mục tiêu.
1.Kiến thức:
Trình bày được sự ảnh hưởng của các yếu tố đến tốc độ phản ứng:
+ Tăng nồng độ chất phản ứng thì tốc độ phản ứng tăng và ngược lại.
+ Tăng áp suất, nồng độ chất khí tăng theo nên tốc độ phản ứng tăng.
+ Tăng nhiệt độ tốc độ phản ứng tăng.
+Tăng diện tích tiếp xúc tốc độ phản ứng tăng.
+ Dùng chất xúc tác làm tăng tốc độ phản ứng.
2.Kĩ năng.
– Tiến hành và quan sát thí nghiệm cụ thể.
– Nêu hiện tượng thực tế về tốc độ phản ứng rút ra được nhận xét.
– Viết phương trình phản ứng hóa học.
– Vận dụng lý thuyết vào bài tập.
3.Thái độ: Tích cực tham gia các hoạt động, có ý thức hợp tác, chủ động, sáng tạo.
4.Năng lực hướng tới.
– Năng lực sử dụng ngôn ngữ hóa học.
– Năng lực thuyết trình, làm việc nhóm.
-Năng lực sử dụng thí nghiệm.
II.Phương pháp và kĩ thuật dạy học.
– Phương pháp: dạy học hợp tác, trực quan.
– Kĩ thuật: mảnh ghép.
III.Chuẩn bị.
1.Giáo viên.
+ Phiếu bài tập, giáo án, máy tính, máy chiếu.
+ Hóa chất:BaCl2 0,1M, HCl 4M, Na2S2O3 0,1M, H2SO4 0,1M, H2O2,MnO2 và ống nghiệm.
2.Học sinh: đọc bài và chuẩn bị nội dung bài học.
IV.Tiến trình dạy học.
1. Hoạt động 1: Tìm hiểu khái niệm về tốc độ phản ứng hóa học (15 phút)
– Mục tiêu:
+ HS nêu được khái niệm của tốc độ phản ứng, công thức tính tốc độ phản ứng.
+ HS áp dụng được công thức tính tốc độ phản ứng để giải các bài tập.
– PP, KT:
+ sử dụng PTTQ theo phương pháp nghiên cứu.
+ KT đặt câu hỏi.
|
Hoạt động của giáo viên |
Hoạt động của học sinh |
|
-GV chuẩn bị 2 thí nghiệm gồm các dung dịch BaCl2 , Na2S2O3 và H2SO4 có cùng nồng độ 0,1M. + GV làm thí nghiệm đổ vào 2 cốc 25ml dd BaCl2 (cốc 1) và 25ml dd Na2S2O3 (cốc 2) . + Sau đó đổ vào mỗi cốc lần lượt 25ml dd H2SO4. Yêu cầu HS quan sát hiện tượng ở 2 cốc và nêu nhận xét + GV yêu cầu HS dự đoán sản phẩm và viết PTPU lên bảng
-GV: Trong 2 thí nghiệm trên thì phản ứng nào xảy ra nhanh hơn?
-GV: PTHH cho ta biết phản ứng tạo thành sản phẩm gì, còn để đánh giá mức độ nhanh hay chậm của phản ứng dùng khái niệm tốc độ phản ứng hóa học, gọi tắt là tốc độ phản ứng. Vậy tốc độ phản ứng là gì? -GV: Tốc độ phản ứng xác định được trong khoảng thời gian từ t1 đến t2 được gọi là tốc độ trung bình của phản ứng. Vì trong khoảng thời gian đó có những lúc phản ứng xảy ra với tốc độ khác nhau. CT tính
-GV cho ví dụ tính tốc độ phản ứng của Br2, Hướng dẫn HS làm |
-HS: quan sát thí nghiệm và nêu nhận xét + Cốc 1: khi đổ H2SO4 vào thì thấy xuất hiện ngay kết tủa màu trắng, dự đoán đó là BaSO4 + Cốc 2: Khi đổ H2SO4 vào thì một lúc sau thấy cốc bị vẩn đục trắng, dự đoán có xuất hiện S PTPU BaCl2 + H2SO4 BaSO4 + HCl Na2S2O3 + H2SO4 S + SO2 + Na2SO4 + H2O
-HS: Phản ứng ở cốc 1 xảy ra nhanh hơn cốc 2
-HS nghiên cứu SGK và trả lời: Tốc độ phản ứng thường được xác định bằng độ biến thiên nòng độ trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
VD: Br2 + HCOOH CO2 + HBr Lúc đầu nồng độ Br2 là 0,012 mol/l, sau 50s nồng độ là 0,0101 mol/l Vậy tốc độ trung bình của phản ứng trong 50s tính theo Br2 là: v= (0,012-0,0101)/50=3,8.10-5 (đơn vị là mol/l.s )
|
2. Hoạt động 2: Nghiên cứu các yếu tố ảnh hưởng đến tốc độ phản ứng
(35 phút)
Câu dẫn: Tốc độ phản ứng là mức độ xảy ra nhanh, chậm của các phản ứng hóa học. Vậy những yếu tố nào ảnh hưởng đến mức độ nhanh, chậm của phản ứng? Cô và cả lớp cùng tìm hiểu phần tiếp theo: các yếu tố ảnh hưởng đến tốc độ phản ứng.
Để tìm hiểu về phần này lớp ta sẽ chia nhóm thảo luận. Cách thảo luận nhóm như sau: GV chiếu sơ đồ cách chia nhóm và giải thích.
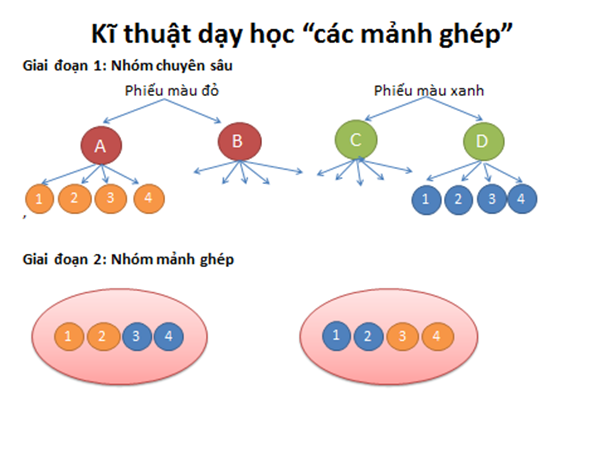
Bước 1: Gv chia nhóm, giao nhiệm vụ và hướng dẫn hoạt động nhóm.
Giai đoạn 1: Hoạt động của nhóm chuyên gia.
– Chia lớp thành 2 loại nhóm (nhóm màu đỏ và nhóm màu xanh), mỗi loại gồm 2 nhóm nhỏ, mỗi nhóm nhỏ có 4 học sinh gọi là nhóm chuyên gia.( Mỗi dãy của lớp là một loại nhóm).
– Nhiệm vụ của nhóm chuyên gia:
+ Nhóm màu đỏ: nghiên cứu về sự ảnh hưởng của nhiệt độ, áp suất, nồng độ đến tốc độ phản ứng.
+ Nhóm màu xanh: nghiên cứu về sự ảnh hưởng của diện tích tiếp xúc, chất xúc tác đến tốc độ phản ứng.
-Thời gian làm việc của nhóm chuyên gia là 10 phút. Hết thời gian thì các nhóm chuyển sang nhóm mảnh ghép.
-Các nhóm tiến hành làm thí nghiệm và hoàn thành nội dung của phiếu học tập đỏ và xanh.
Giai đoạn 2: hoạt động của nhóm mảnh ghép.
– Sau khi các nhóm chuyên gia làm việc xong, chia lại nhóm theo nhóm mảnh ghép: cứ 2 chuyên gia ở nhóm màu đỏ kết hợp với 2 chuyên gia ở nhóm xanh tạo thành 1 nhóm mới gọi là nhóm mảnh ghép.Cách làm đánh mã số các chuyên gia thuộc mỗi nhóm chuyên gia từ 1 đến 4, sau đó từng cặp nhóm màu đỏ và màu xanh , các chuyên gia mang mã số 1,2 ghép thành 1 nhóm, các nhóm chuyên gia mang mã số 3,4 ghép thành 1 nhóm.
– Nhiệm vụ của nhóm mảnh ghép: các chuyên gia của từng nhóm chuyên sâu tóm tắt lại quá trình thảo luận của nhóm mình và sau đó các nhóm thảo luận về ý nghĩa thực tiễn của tốc độ phản ứng.
– Hs thực hiện nhiệm vụ bằng cách hoàn thành phiếu màu vàng.
– Thời gian hoạt động là 10 phút.
Bước 2: Hoạt động nhóm.
Hs hoạt động theo nhóm, Gv đi đến các nhóm để giám sát hoạt động các nhóm, hướng dẫn HS hoạt động nhóm.
Bước 3: Thảo luận chung:
– Các nhóm treo sản phẩm của mình lên bảng.
– GV mời các nhóm bất kì lên báo cáo:
+ 1 nhóm : trình bày sự ảnh hưởng của nồng độ, áp suất, nhiệt độ đến tốc độ phản ứng ( tiến trình+ hiện tượng+ kết luận) và làm bài tập 2.c, e.
+ 1 nhóm trình bày sự ảnh hưởng của diện tích tiếp xúc, chất xúc tác đến tốc độ phản ứng( tiến trình+ hiện tượng+ kết luận) và làm bài tập 2.a,b,d.
– Các nhóm khác nhận xét, giáo viên tổng kết lại.
PHIẾU MÀU ĐỎ
Yêu cầu cả nhóm cùng tiến hành thí nghiệm theo hướng dẫn và hoàn thành nội dung trong phiếu học tập.
Hướng dẫn cách tiến hành thí nghiệm.
TN1.Làm thí nghiệm với 2 ống nghiệm:
+ Ống 1: 3ml dd Na2S2O3 0,1M.
+ Ống 2: 1 ml dd Na2S2O3 0,1M + 2ml nước cất.
Sau đó thêm vào 2 ống nghiệm 3ml dd H2SO4 0,1M.
Quan sát thời gian xuất hiện kết tủa ở mỗi ống.
TN2.Xét phản ứng sau trong bình kín ở nhiệt độ xác định:
2HI(k) H2(k) + I2(k)
Thực nghiệm cho thấy:
– PHI = 1 atm: tốc độ phản ứng đo được v1= 1,22.10-8.
– PHI = 2 atm: tốc độ phản ứng đo được v2 = 4,48.10-8.
So sánh tốc độ phản ứng và ghi vào ô hiện tượng.
TN3. Chuẩn bị 4 ống nghiệm được đánh số thứ tự từ 1 đến 4:
+ Ống 1,2: đựng 3ml dd Na2S2O3 0,1M.
+ Ống 3,4: đựng 3ml dd H2SO4 0,1M.
Đem ống nghiệm 2 và 4 đi đun nóng đến 50 . Sau khi đun nóng thì đổ đồng thời vào mỗi cốc 3ml dd H2SO4 0,1 M ( ống 3 đổ vào ống 1 và ống 4 đổ vào ống 2). Quan sát thời gian kết tủa xuất hiện ở mỗi ống.
|
Nội dung |
Tiến hành TN |
Hiện tượng |
Kết luận |
|
TN1: Ảnh hưởng của nồng độ. |
|
|
|
|
TN2: Ảnh hưởng của áp suất. |
|
|
|
|
TN3: Ảnh hưởng của nhiệt độ. |
|
|
|
Lưu ý: cách tiến hành trình bày bằng hình vẽ minh họa.
PHIẾU MÀU XANH
Yêu cầu cả nhóm cùng tiến hành thí nghiệm theo hướng dẫn và hoàn thành nội dung trong phiếu học tập.
Hướng dẫn cách tiến hành thí nghiệm.
TN1.Làm thí nghiệm với 2 ống nghiệm:
+ Ống 1: 3 ml dd HCl 4M.
+ Ống 2: 3 ml dd HCl 4M.
Cho đồng thời vào 2 ống nghiệm mỗi ống chứa một lượng đá vôi như nhau, trong đó ống 1 ở dạng hạt nhỏ và ống 2 ở dạng hạt to. Quan sát thời gian phản ứng ở mỗi ống nghiệm.
TN2. Làm thí nghiệm với 2 ống nghiệm, mỗi ống chứa 4ml H2O2. Cho thêm một ít bột MnO2 vào ống nghiệm thứ 2. So sánh bọt khí sủi lên ở 2 ống nghiệm.
|
Nội dung |
Tiến hành TN |
Hiện tượng |
Kết luận |
|
Ảnh hưởng của diện tích tiếp xúc. |
|
|
|
|
Ảnh hưởng của chất xúc tác. |
|
|
|
Lưu ý: cách tiến hành trình bày bằng hình vẽ minh họa.
PHIẾU MÀU VÀNG
1. Trình bày sự ảnh hưởng của các yếu tố đến tốc độ phản ứng.
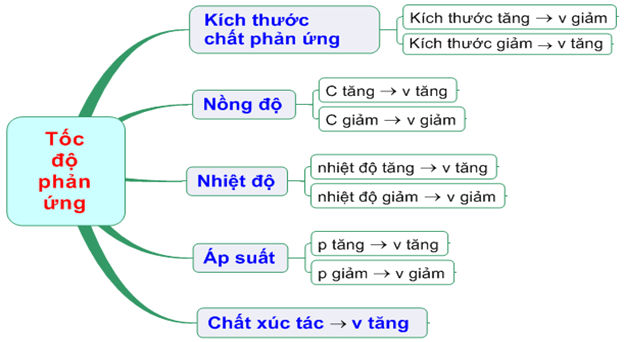
– Ảnh hưởng của nồng độ:
– Ảnh hưởng của áp suất:
– Ảnh hưởng của nhiệt độ:
– Ảnh hưởng của diện tích tiếp xúc:
– Ảnh hưởng của chất xúc tác:
2.Trong các cặp phản ứng sau phản ứng nào có tốc độ lớn hơn, tại sao?
a, Phản ứng (1): Fe + CuSO4( 2M).
Phản ứng (2): Fe + CuSO4( 4M).
b, Phản ứng (1): Zn + CuSO4 ( 2M, ).
Phản ứng (2): Zn + CuSO4( 2M, 500 ).
c, Phản ứng (1): Zn(hạt) + CuSO4(2M).
Phản ứng (2): Zn( bột) + CuSO4(2M).
d, Phản ứng (1): A(k) + 2B(k) AB2 (k), P= 4 atm.
Phản ứng (2): A(k) + 2B(k) AB2 (k), P= 2 atm.
e, Phản ứng (1): KClO3 KCl +Cl2 + O2( nhiệt độ).
Phản ứng (2): KClO3KCl +Cl2 + O2( nhiệt độ, xúc tác MnO2)
Gợi ý trả lời của các phiếu.
Phiếu màu đỏ
|
Nội dung |
Hiện tượng |
Kết luận |
|
TN1: Ảnh hưởng của nồng độ |
Ống 1 sẽ xuất hiện sớm hơn, màu đậm hơn |
Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng |
|
TN2: Ảnh hưởng của áp suất |
Ở PHI = 2atm tốc độ phản ứng xảy ra nhanh hơn |
Khi tăng áp suất, nồng độ chất khí tăng theo, nên tốc độ phản ứng tăng |
|
TN3: Ảnh hưởng của nhiệt độ |
Ở cốc 2 xuất hiện kết tủa nhanh hơn, màu đậm hơn |
Khi tăng nhiệt độ, tốc độ phản ứng tăng |
Phiếu màu xanh.
|
Nội dung |
Hiện tượng |
Kết luận |
|
Ảnh hưởng của diện tích tiếp xúc |
Ống 1 thời gian phản ứng xảy ra nhanh hơn vì tổng diện tích bề mặt tiếp xúc lớn hơn. |
Khi tăng diện tích tiếp xúc của các chất phản ứng, tốc độ phản ứng tăng. |
|
Ảnh hưởng của chất xúc tác |
Ống 2 bọt khí thoát ra mạnh hơn. |
Chất xúc tác làm tăng tốc độ phản ứng. |
SƠ ĐỒ TƯ DUY
3. Hoạt động 3: Ý nghĩa thực tiễn của tốc độ phản ứng (10 phút)
– Mục tiêu: GV giúp HS hiểu và giải thích thêm một số hiện tượng áp dụng kiến thức tốc độ phản ứng như: nồi áp suất, đập nhỏ than khi đun…
– PP, KT:
+ PP thuyết trình
+ sử dụng bài tập hóa học
– GV yêu cầu HS xác định yếu tố ảnh hưởng đến tốc độ phản ứng trong các trường hợp sau:
|
Các trường hợp |
Yếu tố ảnh hưởng |
|
Sự cháy diễn ra nhanh và mạnh hơn khi được đưa đang cháy ngoài không khí vào lọ đựng O2 nguyên chất |
|
|
Phản ứng oxi hóa SO2 tạo thành SO3 diễn ra nhanh hơn khi có mặt của V2O5 |
|
|
Al bột tác dụng với dung dịch HCl nhanh hơn mảnh Al |
|
|
Thép được bền hơn nếu được sơn chống gỉ |
|
|
Khi cần ủ bếp than, người ta đậy nắp bếp lò làm cho phản ứng của than bị chậm lại |
|
4. Hoạt động 4: Trò chơi củng cố kiến thức (10 phút)
-GV: Để tổng kết lại nội dung kiến thức mà cô trò mình đã học được trong bài hôm nay, cô mời cả lớp cùng tham gia một trò chơi thú vị mang tên “Ô chữ bí mật”.
– GV: Yêu cầu HS gấp hết sách vở lại và tham gia trò chơi. GV phổ biến luật chơi: Ô chữ bí mật là hàng dọc, gồm 5 chữ cái. Để tìm được ô chữ bí mật, HS phải trả lời 5 câu hỏi tương ứng.
Câu 1: Đối với phản ứng có chấ khí, khi tăng áp suất, tốc độ phản ứng thay đổi như thế nào?
Câu 2: Khi đốt S trong không khí không cháy mạnh bằng khi đốt trong lọ đựng O2 nguyên chất.Giải thích bằng sự ảnh hưởng của yếu tố nào?
Câu 3: Khi ủ cơm rượu để giảm thời gian ủ người ta cho thêm men nấu rượu vào. Vậy người ta đã lợi dụng yếu tố nào để tăng tốc độ phản ứng ủ rượu lên?
Câu 4: Yếu tố nào đã được vận dụng khi nung nóng đá vôi ở nhiệt độ cao để sản xuất vôi sống
Câu 5: Tốc độ phản ứng là………..của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian
-GV: Vậy ô chữ bí mật cần tìm đó là “TỐC ĐỘ”
|
|
|
|
|
|
T |
Ă |
N |
G |
|
|
|
|
|
|
|
|
|
|
|
|
N |
Ô |
N |
G |
Đ |
Ô |
|
|
|
|
|
|
|
|
|
|
|
|
C |
H |
 |
T |
X |
U |
C |
T |
A |
C |
|
|
N |
H |
I |
Ê |
T |
Đ |
Ô |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Đ |
Ô |
B |
I |
Ê |
N |
T |
H |
I |
Ê |
N |
5. Hoạt động 5: HS làm bài tập củng cố kiến thức (20 phút)
Bài 1: Xét phản ứng phân huỷ N2O5 trong dung môi CCl4 ở 45oC
![]()
|
Thời gian(s) |
Nồng độ N2O5 (mol/lit) |
Vận tốc trung bình |
|
0 |
2,33 |
|
|
184 |
2,08 |
|
|
319 |
1,91 |
|
Tính tốc độ trung bình của phản ứng tại thời điểm 184 giây và 319 giây tính theo N2O5.
Bài 2: Cho 6 gam hạt kẽm vào 1 cốc đựng dung dịch H2SO4 4M (dư) ở nhiệt độ thường. Cho biết biến đổi nào sau đây không làm thay đổi tốc độ phản ứng ?
A. Thay 6 gam kẽm hạt bằng 6 gam kẽm bột.
B. Thay H2SO4 4M bằng H2SO4 2M.
C. Thực hiện phản ứng ở .
D. Dùng thể tích dung dịch H2SO4 gấp đôi ban đầu.
Bài 3: Cho phản ứng A+2B à C có V = K [A].[B]2. Cho biết nồng độ dầu của A là 0,8M và của B là 0,9M. Hãy tính tốc độ phản ứng khi nồng độ chất A giảm 0,2M biết K = 0,3.
Xem thêm