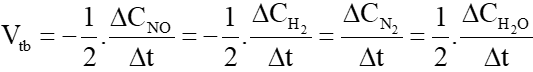Giáo án Hóa học 10 Kết nối tri thức bản word trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 20k cho 1 bài Giáo án lẻ bất kì):
B1: – –
B2:
Xem thử tài liệu tại đây: Link tài liệu
Ngày soạn: …/…/…
Ngày dạy: …/…/…
|
Trường: ……………………. Tổ: …………………………. |
Họ và tên giáo viên: ……………………………….. |
BÀI 19. TỐC ĐỘ PHẢN ỨNG (4 tiết)
I. MỤC TIÊU
1. Kiến thức
– Trình bày được khái niệm tốc độ phản ứng hóa học và cách tính tốc độ trung bình của phản ứng.
– Viết được biểu thức tốc độ của phản ứng theo hằng số tốc độ phản ứng và nồng độ (còn gọi là định luật tác dụng khối lượng, chỉ đúng cho phản ứng đơn giản nên không tùy ý áp dụng cho mọi phản ứng). Từ đó nêu được ý nghĩa hằng số tốc độ phản ứng.
– Thực hiện được một số thí nghiệm nghiên cứu và giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng (nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác).
– Nêu được ý nghĩa của hệ số nhiệt độ Van’t Hoff.
– Vận dụng được kiến thức tốc độ phản ứng hóa học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất.
2. Năng lực
* Năng lực chung:
a) Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu về nhiệt động học của phản ứng, ý nghĩa và tìm hiểu ứng dụng của các yếu tố ảnh hưởng đến tốc độ phản ứng trong đời sống, sản xuất.
b) Năng lực giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để diễn đạt về các yếu tố ảnh hưởng đến tốc độ phản ứng; Hoạt động nhóm và cặp đôi hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo; Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
c) Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm, liên hệ thực tiễn nhằm giải quyết các vấn đề bài học trong cuộc sống.
* Năng lực hóa học:
a) Nhận thức hóa học:
– Trình bày được khái niệm tốc độ phản ứng hóa học và cách tính tốc độ trung bình của phản ứng.
– Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ cho phản ứng đơn giản.
– Nêu được ý nghĩa của hằng số tốc độ phản ứng (k).
– Giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng như: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác.
– Nêu được ý nghĩa của hệ số nhiệt độ Van’t Hoff (γ).
b) Tìm hiểu thế giới tự nhiên dưới góc độ hóa học:
– Tìm hiểu những hiện tượng diễn ra xung quanh liên quan đến tốc độ phản ứng hóa học.
– Tiến hành được thí nghiệm nghiên cứu các yếu tố ảnh hưởng tới tốc độ phản ứng như: nồng độ, diện tích bề mặt, chất xúc tác.
c) Vận dụng kiến thức, kĩ năng đã học:
– Vận dụng được kiến thức tốc độ phản ứng hóa học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất (một số biện pháp làm thay đổi tốc độ phản ứng như: Bảo quản thức ăn trong tủ lạnh, sử dụng bình oxygen hỗ trợ quá trình hô hấp, muối dưa, …)
3. Phẩm chất:
– Cẩn thận, trung thực, trách nhiệm trong quá trình tìm tòi thông tin SGK, các phương tiện thông tin (internet), trong quá trình thực hành và ghi chép bài học, hoạt động nhóm, hoàn thành các nội dung được giao.
– Có niềm say mê, hứng thú với việc khám phá và học tập bộ môn hóa học.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
– Phiếu học tập.
– Hình ảnh các phản ứng hóa học xảy ra nhanh và chậm như:
+ Phản ứng nhanh: Nướng bánh mì, đốt gas, …
+ Phản ứng chậm: Phản ứng lên men rượu, men giấm, phản ứng tạo gỉ sắt, …
– Dụng cụ và hóa chất: Như mô tả trong thí nghiệm.
– Các hình ảnh, mô hình liên quan đến ảnh hưởng của các yếu tố: nồng độ, áp suất, nhiệt độ, diện tích bề mặt tiếp xúc, chất xúc tác đến tốc độ phản ứng.
III. TIẾN TRÌNH DẠY HỌC
1. Hoạt động 1: Khởi động
a) Mục tiêu: Thông qua hình ảnh các phản ứng xảy ra nhanh, chậm giúp học sinh nhận thấy sự khác nhau về tốc độ của các phản ứng. Học sinh trả lời câu hỏi gợi mở GV đặt ra gợi mở vào bài học.
b) Nội dung: Trong tự nhiên có những phản ứng xảy ra rất nhanh, cũng có những phản ứng xảy ra chậm như:
|
– Nướng bánh mì – cần vài phút.
|
|
|
– Đốt gas khi nấu ăn – cần vài giây.
|
|
|
– Lên men rượu để nấu rượu – cần vài ngày.
|
|
|
– Chiếc đinh sắt bị gỉ – cần vài tháng. |
|
Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học cần dùng đại lượng nào? Cách tính ra sao? Em có thể làm cách nào để kim hãm hoặc thúc đẩy một phản ứng hóa học theo mong muốn?
c) Sản phẩm: HS dựa vào câu hỏi, đưa ra dự đoán của bản thân.
d) Tổ chức thực hiện: HS làm việc theo bàn, GV gợi ý, hỗ trợ HS.
2. Hoạt động 2: Hình thành kiến thức mới
|
I. Tốc độ phản ứng hóa học Hoạt động 1: Khái niệm tốc độ phản ứng hóa học Mục tiêu: HS trình bày được khái niệm tốc độ phản ứng hóa học. |
|
|
Hoạt động của GV và HS |
Sản phẩm dự kiến |
|
Giao nhiệm vụ học tập: NV1. GV yêu cầu học sinh quan sát Hình 19.1 SGK. Yêu cầu HS nhận xét về sự thay đổi lượng chất đầu và chất sản phẩm khi phản ứng xảy ra? NV2. GV yêu cầu HS nêu kết luận về liên hệ giữa tốc độ phản ứng và sự biến đổi nồng độ các chất trong phản ứng. Từ đó nêu khái niệm tốc độ phản ứng, đơn vị tốc độ phản ứng.
NV3. GV yêu cầu HS quan sát Hình 19.2 nêu khoảng thời gian cho từng phản ứng xảy ra. GV yêu cầu HS tìm thêm các ví dụ để minh họa cho các phản ứng xảy ra nhanh, chậm. NV4. GV yêu cầu HS thảo luận theo bàn trả lời câu hỏi 1. Thực hiện nhiệm vụ: – HS suy nghĩ trả lời câu hỏi GV đặt ra ở NV1, NV2, NV3. – HS thực hiện theo nhóm (mỗi nhóm một bàn) thực hiện NV4. Báo cáo theo nhóm Báo cáo, thảo luận: – HS giơ tay trả lời câu hỏi, các bạn khác góp ý, bổ xung, ghi chép bài vào vở. – Đại diện 2 nhóm HS đưa ra nội dung kết quả thảo luận của nhóm. Các nhóm khác so sánh, bổ sung. Kết luận, nhận định: GV nhận xét, đưa ra kết luận. |
NV1. Khi phản ứng hóa học xảy ra, lượng chất đầu giảm dần theo thời gian, trong khi lượng chất sản phẩm tăng dần theo thời gian. NV2. – Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian: giây (s), phút (min), giờ (h), ngày (d), … – Tốc độ phản ứng kí hiệu là v, đơn vị tốc độ phản ứng là (đơn vị nồng độ) (đơn vị thời gian)-1, ví dụ: mol L-1 s-1 hay M s-1. NV3. a) Đốt than – cần vài phút b) Đinh sắt bị gỉ – cần vài tháng c) Tinh bột lên men rượu – cần vài ngày. HS tìm thêm ví dụ : lên men làm sữa chua, đốt lá cây khô, tàu biển bị gỉ, …
NV4. a) Dựa vào đồ thị ta thấy: Nồng độ ban đầu của chất là 0 mol/L. Thời gian của phản ứng tăng, nồng độ dung dịch chất tăng. ⇒ Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất sản phẩm HCl. b) Đơn vị của tốc độ phản ứng trong trường hợp này là mol/(L.min).
|
|
Hoạt động 2: Tốc độ trung bình của phản ứng Mục tiêu: HS biết cách tính tốc độ trung bình của phản ứng. |
|
|
GV dẫn dắt: Từ hoạt động trên chúng ta đã biết tốc độ phản ứng thay đổi theo thời gian. Tương tự tốc độ trung bình trong chuyển động, để đặc trưng cho sự nhanh chậm của phản ứng trong một khoảng thời gian, ta dùng đại lượng tốc độ phản ứng trung bình. Giao nhiệm vụ học tập: NV1. Giáo viên chia lớp thành 4 nhóm, hoàn thành phiếu học tập số 1. (đính kèm phần phụ lục). NV2. GV hướng dẫn HS tìm hiểu công thức tính tốc độ trung bình của phản ứng theo các chất khác nhau của phản ứng tổng hợp NH3 (Ví dụ SGK). Từ đó rút ra được khái niệm và công thức tổng quát tính tốc độ trung bình của một phản ứng hóa học. GV đặt lại câu hỏi: Vì sao cần đặt dấu “-” trước biến thiên nồng độ chất đầu? GV giới thiệu: Sự thay đổi lượng chất trong khoảng thời gian vô cùng ngắn được gọi là tốc độ tức thời của phản ứng. NV3. GV yêu cầu HS trả lời câu hỏi 2. GV yêu cầu 2 bạn lên bảng trình bày. Thực hiện nhiệm vụ: NV1. HS hoàn thành phiếu học tập theo 4 nhóm. NV2. HS trình bày được khái niệm tốc độ trung bình của phản ứng. Hình thành kĩ năng tính tốc độ trung bình của phản ứng. NV3. HS làm việc cá nhân hoàn thành câu hỏi 2. Hai bạn lên bảng trình bày. Báo cáo, thảo luận: – Đại diện nhóm HS đưa ra nội dung kết quả thảo luận của nhóm. – HS tìm hiểu công thức tính tốc độ trung bình của phản ứng tổng hợp NH3. Rút ra khái niệm và công thức tổng quát để tính tốc độ trung bình của một phản ứng hóa học. Kết luận, nhận định: GV nhận xét kết quả hoạt động của các nhóm. Đưa ra kết luận. |
NV1. Dự kiến sản phẩm được cho trong phần phụ lục.
NV2. Tốc độ trung bình của phản ứng ( – Cho phản ứng tổng quát: aA + bB ® dD + eE Tốc độ phản ứng được tính dựa theo thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:
Trong đó: DCA; DCB; DCD; DCE lần lượt là biến thiên lượng các chất A, B, D, E trong khoảng thời gian Dt. Lưu ý: Nồng độ chất đầu giảm dần theo thời gian nên biến thiên nồng độ chất đầu âm. Đặt dấu trừ trước biến thiên nồng độ chất đầu để tốc độ phản ứng có giá trị dương. NV3. Biểu thức tính tốc độ trung bình theo sự biến đổi nồng độ chất đầu và chất sản phẩm của phản ứng trên là:
|
|
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng Hoạt động 3: Ảnh hưởng của nồng độ đến tốc độ phản ứng Mục tiêu: HS trình bày được định luật tác dụng khối lượng và áp dụng cho một số phản ứng đơn giản. Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ. Từ đó nêu được ý nghĩa hằng số tốc độ phản ứng. Thực hành đúng thao tác, phản ánh khách quan về hiện tượng, nhận định được sự khác nhau về nồng độ ảnh hưởng tới tốc độ phản ứng. |
|
…………………………………………
…………………………………………
…………………………………………
Tài liệu có 22 trang, trên đây trình bày tóm tắt 8 trang của Giáo án Hóa hoc 10 Kết nối tri thức Bài 19: Tốc độ phản ứng.
Xem thêm các bài giáo án Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Giáo án Bài 18: Ôn tập chương 5
Giáo án Bài 19: Tốc độ phản ứng
Giáo án Bài 20: Ôn tập chương 6
Giáo án Bài 21: Nhóm halogen
Giáo án Bài 22: Hydrogen halide – Muối halide
Để mua Giáo án Hóa học 10 Kết nối tri thức năm 2023 mới nhất, mời Thầy/Cô liên hệ https://tailieugiaovien.com.vn/




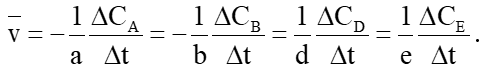 .
.