Giáo án Hóa học 10 Chân trời sáng tạo bản word trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 20k cho 1 bài Giáo án lẻ bất kì):
B1: – –
B2:
Xem thử tài liệu tại đây: Link tài liệu
|
Trường THPT …………. Tổ: ………………….. |
Họ và tên giáo viên
|
|||
|
BÀI 12: PHẢN ỨNG OXI HÓA – KHỬ VÀ ỨNG DỤNG TRONG CUỘC SỐNG |
||||
|
Tuần: |
Tiết: |
Ngày soạn: |
Thời gian thực hiện: 3 tiết |
|
I. MỤC TIÊU
1. Năng lực chung
– Tự chủ và tự học: Chủ động, tích cực tìm hiểu về phản ứng oxi hoá – khử, các ứng dụng và vai trò của phản ứng oxi hoá – khử.
– Giao tiếp và hợp tác: Hoạt động nhóm và cặp đôi theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo; Sử dụng ngôn ngữ hoá học để diễn đạt về phản ứng oxi hoá – khử.
– Giải quyết vấn đề: Thảo luận với các thành viên trong nhóm, liên hệ thực tiễn nhằm giải quyết các vấn đề trong bài học và cuộc sống.
2. Năng lực hóa học
– Nhận thức hoá học: Nêu được khái niệm và xác định được số oxi hoá của nguyên tử các nguyên tố trong hợp chất; Nêu được khái niệm về phản ứng oxi hoá – khử và ý nghĩa của phản ứng oxi hoá – khử; Mô tả được một số phản ứng oxi hoá – khử quan trọng gắn liền với cuộc sống; Cân bằng được phản ứng oxi hoá – khử bằng phương pháp thăng bằng electron.
– Tìm hiểu thế giói tự nhiên dưới góc độ hoá học: Tiến hành được thí nghiệm về phản ứng oxi hoá – khử.
– Vận dụng kiến thức, kĩ năng đã học: Tìm hiểu, đưa ra được ví dụ về phản ứng oxi hoá – khử và rút ra kết luận về vai trò của phản úng oxi hoá – khử trong cuộc sống.
3. Phẩm chất
– Cẩn thận, trung thực và thực hiện an toàn trong quá trình làm thực hành.
– Có niềm say mê, hứng thú với việc học tập.
– Tham gia tích cực hoạt động cặp đôi hay hoạt động nhóm.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
– Tranh ảnh minh họa các hình ảnh trong SGK.
– Thiết kế phiếu học tập.
– Dụng cụ và hóa chất: Ống nghiệm, dây kẽm (Zn), dung dịch H2SO4 1M, dung dịch CuSO4 0,5M.
II. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a. Mục tiêu
– Tạo hứng thú và kích thích sự tò mò của học sinh vào chủ đề học tập. Học sinh tiếp nhận kiến thức chủ động, tích cực, hiệu quả.
b. Nội dung
– GV đặt vấn đề thông qua câu hỏi khởi động, từ đó HS lĩnh hội và hình thành nên mục tiêu học tập.
|
CÂU HỎI KHỞI ĐỘNG Thiết bị thử nồng độ cồn của cảnh sát giao thông được minh họa như hình bên dưới. em hãy cho biết nguyên nhân dẫn đến sự thay đổi màu sắc của thiết bị và cho biết đó là phản ứng gì?
|
c. Sản phẩm
– Câu trả lời của HS, câu trả lời có thể đúng hoặc sai. GV dựa vào đó để nêu nhiệm vụ học tập.
|
DỰ KIẾN CÂU TRẢ LỜI Nếu trong hơi thở của tài xế có hơi cồn (ethanol) thì sẽ xảy ra phản ứng hóa học làm thay đổi màu sắc từ màu da cam sang màu xanh. Phản ứng này là phản ứng oxi hóa khử. |
d. Tổ chức thực hiện
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Bước 1: Chuyển giao nhiệm vụ học tập Yêu cầu học sinh hoạt động cá nhân trả lời câu hỏi khởi động. |
Nhận nhiệm vụ. |
|
Bước 2: Thực hiện nhiệm vụ Theo dõi và hỗ trợ cho HS. |
Suy nghĩ và trả lời câu hỏi. |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu đại diện một học sinh báo cáo kết quả. |
Báo cáo sản phẩm.
|
|
Bước 4: Kết luận và nhận định Nhận xét và dẫn dắt vào bài: Trong cuộc sống cũng như trong tự nhiên có nhiều hiện tượng mà nguyên nhân chính là do phản ứng oxi hoá – khử gây ra. Vậy phản ứng oxi hoá – khử là gì? Chúng ta cùng tìm hiểu chi tiết trong bài học ngày hôm nay. |
|
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu về số oxi hóa
a. Mục tiêu: Nêu được khái niệm và xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất.
b. Nội dung: HS thảo luận nhóm, hoàn thành phiếu học tập số 1, từ đó lĩnh hội kiến thức.
|
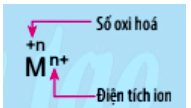
PHIẾU HỌC TẬP SỐ 1 Câu 1: Quan sát Hình 12.1 – SGK Hoá 10, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen. Câu 2: Quan sát hình 12.2a – SGK Hoá 10, hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chloride (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl. Kết luận: Số oxi hóa của một nguyên tử trong phân tử là …………………………. nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyê tử của nguyên tố có độ âm điện lớn hơn. Câu 3: Nêu điểm khác nhau giữa kí hiệu số oxi hóa và kí hiệu điện tích của ion M trong hình sau:
Câu 4: Dự đoán số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất. Giải thích. Luyện tập: Hãy xác định số oxi hóa của các nguyên tử trong các đơn chất, hợp chất và ion sau: Zn, H2, Cl–, O2-, S2-, HSO4–, Na2S2O3, KNO3. Vận dụng: Magnetite là khoáng vật sắt từ có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép, với công thức hóa học là Fe3O4. Hãy xác định số oxi hóa của nguyên tử Fe trong hợp chất trên. |
c. Sản phẩm
|
DỰ KIẾN ĐÁP ÁN PHIẾU HỌC TẬP SỐ 1 Câu 1: Quá trình nhường electron: Mg → Mg2+ + 2e. Quá trình nhận electron: O2 + 4e → 2O2-. Câu 2: Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl khi đó có thể coi Cl nhận 1 electron và H nhường 1 electron ⇒ Cl mang điện tích 1- và H mang điện tích 1+. Kết luận: Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn Câu 3: Kí hiệu số oxi hóa: dấu viết trước, số viết sau. Kí hiệu điện tích ion: số viết trước, dấu viết sau. Câu 4: Các nguyên tử trong nhóm IA, IIA, IIIA dễ dàng nhường đi 1, 2, 3 electron ở lớp ngoài cùng. Dự đoán, số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất lần lượt là +1; +2; +3. Luyện tập: – Với các đơn chất: – Với các ion đơn nguyên tử: Số oxi hóa của nguyên tử Cl, O, S trong Cl‑, O2-, S2- lần lượt bằng -1; -2; -2. – Với ion đa nguyên tử: HSO4– + Số oxi hóa của H là +1, của O là -2 + Số oxi hóa của S là x ta có: 1.(+1) + 1.x + 4.(-2) = -1 ⇒ x = +6 – Với các phân tử hợp chất: + Xét phân tử Na2S2O3: Số oxi hóa của Na là +1; số oxi hóa của O là -2 Số oxi hóa của S là x ta có: 2.(+1) + 2.x + 3.(-2) = 0 ⇒ x = +2 + Xét phân tử KNO3: Số oxi hóa của K là +1; số oxi hóa của O là -2 Số oxi hóa của N là x ta có: 1.(+1) + 1.x + 3.(-2) = 0 ⇒ x = +5 Vận dụng: Gọi số oxi hóa của Fe là x ta có: 3.x + 4. (-2) = 0 ⇒ x = Vậy số oxi hóa của Fe trong Fe3O4 là |
d. Tổ chức thực hiện
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Bước 1: Chuyển giao nhiệm vụ học tập Chia lớp thành 6 nhóm Yêu cầu học sinh thảo luận và trả lời câu hỏi trong phiếu học tập số 1. |
Nhận nhiệm vụ. |
|
Bước 2: Thực hiện nhiệm vụ Theo dõi và hỗ trợ cho nhóm HS. |
Thảo luận và ghi câu trả lời vào PHT. |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu đại diện một số nhóm báo cáo kết quả PHT số 1. |
Báo cáo sản phẩm thảo luận của nhóm.
|
|
Bước 4: Kết luận và nhận định Nhận xét và chốt kiến thức. |
Nhận xét sản phẩm của nhóm khác. |
|
Kiến thức trọng tâm – Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn. – Số oxi hóa của nguyên tử một nguyên tố là một số đại số được gán cho nguyên tử của nguyên tố đó và thường được xác định theo các quy tắc sau: Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0. Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0. Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với các ion đa nguyên tử) bằng điện tích của ion đó. Quy tắc 4: Trong đa số các hợp chất, số oxi hóa của hydrogen là +1, trừ các hydride kim loại như NaH, CaH2 …. Số oxi hóa của oxygen bằng -2, trừ OF2 và các peroxide; superoxide (như H2O2; Na2O2; KO2 …). Kim loại kiềm (nhóm IA) luôn có số oxi hóa + 1; kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm có số oxi hóa +3. Số oxi hóa của các nguyên tử nguyên tố fluorine trong các hợp chất bằng -1. |
|
…………………………………………
…………………………………………
…………………………………………
Tài liệu có 16 trang, trên đây trình bày tóm tắt 6 trang của Giáo án Hóa hoc 10 Chân trời sáng tạo Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống.
Xem thêm các bài giáo án Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Giáo án Bài 11: Liên kết hydrogen và tương tác van der Waals
Giáo án Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Giáo án Bài 13: Enthalpy tạo thành và sự biến thiên enthalpy của phản ứng hoá học
Giáo án Bài 14: Tính biến thiên enthalpy của phản ứng hoá học
Giáo án Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Để mua Giáo án Hóa học 10 Chân trời sáng tạo năm 2023 mới nhất, mời Thầy/Cô liên hệ https://tailieugiaovien.com.vn/