Giải bài tập Hóa học lớp 10 Bài 3: Nguyên tố hóa học
Giải hóa học 10 trang 20 Chân trời sáng tạo
Mở đầu trang 20 Hóa học 10: Kim cương và than chì có vẻ ngoài khác nhau. Tuy nhiên, chúng đều được tạo thành từ cùng một nguyên tố hóa học là nguyên tố carbon (C). Nguyên tố hóa học là gì? Một nguyên tử của nguyên tố hóa học có những đặc trưng cơ bản nào?

Lời giải:
– Nguyên tố hóa học là tập hợp tất cả các nguyên tử có cùng điện tích hạt nhân
– Một nguyên tử của nguyên tố hóa học có những đặc trưng: số khối A và điện tích hạt nhân
1. Hạt nhân nguyên tử
Câu hỏi 1 trang 20 Hóa học 10: Quan sát Hình 3.1, cho biết nguyên tử nitrogen có bao nhiêu proton, neutron và electron
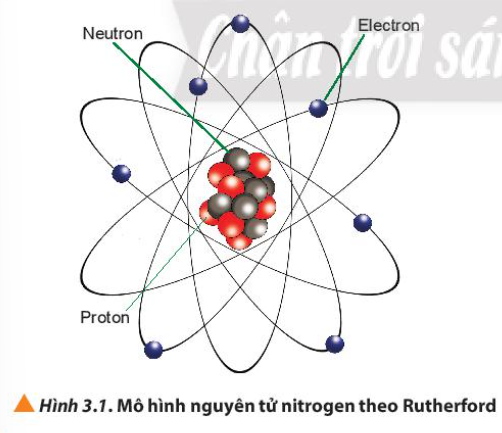
Phương pháp giải:
– Quả cầu màu xanh: electron
– Quả cầu màu đỏ: proton
– Quả cầu màu xám: neutron
Lời giải:
– Có 7 quả cầu màu xanh => 7 electron
– Có 7 quả cầu màu đỏ => 7 proton
– Có 7 quả cầu màu xám => 7 neutron
Câu hỏi 2 trang 20 Hóa học 10: Điện tích hạt nhân của nguyên tử nitrogen có giá trị là bao nhiêu?
Phương pháp giải:
– Số đơn vị điện tích hạt nhân (Z) = số proton = số electron
– Điện tích hạt nhân = +Z
Lời giải:
– Nguyên tử nitrogen có 7 electron
=> Số đơn vị điện tích hạt nhân: Z = 7
=> Điện tích hạt nhân = +Z = +7
Luyện tập trang 20 Hóa học 10: Nguyên tử sodium có 11 proton. Cho biết số đơn vị điện tích hạt nhân và số electron của nguyên tử này
Phương pháp giải:
– Số đơn vị điện tích hạt nhân (Z) = số proton = số electron
– Điện tích hạt nhân = +Z
Lời giải:
– Nguyên tử sodium có 11 proton
=> Số đơn vị điện tích hạt nhân (Z) = số proton = số electron = 11
Vậy số đơn vị điện tích hạt nhân và số electron của nguyên tử sodium đều bằng 11
Giải hóa học 10 trang 21 Chân trời sáng tạo
Câu hỏi 3 trang 21 Hóa học 10: Bổ sung những dữ liệu còn thiếu trong Bảng 3.1
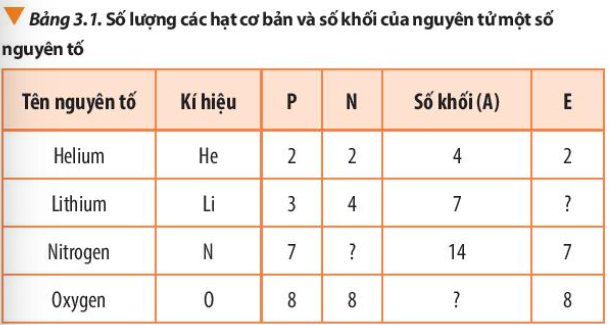
Phương pháp giải:
Số khối A = số proton (P) + số neutron (N)
Số electron (E) = Số proton (P)
Lời giải:
Số khối A = số proton (P) + số neutron (N)
Số electron (E) = Số proton (P)
|
Tên nguyên tố |
Kí hiệu |
P |
N |
Số khối (A) |
E |
|
Helium |
He |
2 |
2 |
4 |
2 |
|
Lithium |
Li |
3 |
4 |
7 |
3 |
|
Nitrogen |
N |
7 |
7 |
14 |
7 |
|
Oxygen |
O |
8 |
8 |
16 |
8 |
2. Nguyên tố hóa học
Câu hỏi 4 trang 21 Hóa học 10: Nguyên tố carbon có số hiệu nguyên tử là 6. Xác định điện tích hạt nhân của nguyên tử này.
Phương pháp giải:
Số hiệu nguyên tử được quy ước bằng số đơn vị điện tích hạt nhân
Lời giải:
Số hiệu nguyên tử của một nguyên tố được quy ước bằng số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó
=> Điện tích hạt nhân của nguyên tử carbon = 6
Giải hóa học 10 trang 22 Chân trời sáng tạo
Câu hỏi 5 trang 22 Hóa học 10: Quan sát Hình 3.2, cho biết số proton, số neutron, số electron và điện tích hạt nhân của từng loại nguyên tử của nguyên tố hydrogen
Phương pháp giải:
– Số electron (E) = Số proton (P) = Số đơn vị điện tích hạt nhân (Z)
– Điện tích hạt nhân = +Z
Lời giải:
– Nguyên tử Protium
+ 1 electron, 1 proton
+ Điện tích hạt nhân = +1
– Nguyên tử Deuterium
+ 1 electron, 1 proton, 1 neutron
+ Điện tích hạt nhân = +1
– Nguyên tử Tritium
+ 1 electron, 1 proton, 2 neutron
+ Điện tích hạt nhân = +1
Câu hỏi 6 trang 22 Hóa học 10: Kí hiệu nguyên tử cho biết những thông tin nào?
Phương pháp giải:

Lời giải:
– Kí hiệu hóa học cho biết:
+ Kí hiệu nguyên tố hóa học
+ Số hiệu nguyên tử => Số proton, số electron, điện tích hạt nhân, số đơn vị điện tích hạt nhân
+ Số khối => Số neutron = số khối – số proton
Luyện tập trang 22 Hóa học 10: a) Viết kí hiệu các nguyên tử của nguyên tố hydrogen (Hình 3.2)
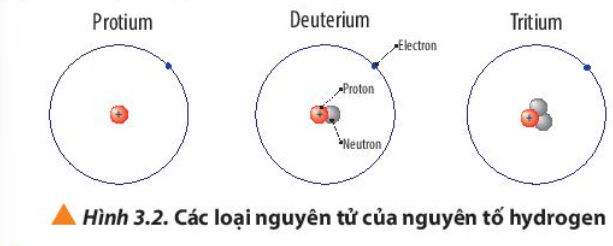
b) Viết kí hiệu nguyên tử của nguyên tố oxygen. Biết nguyên tử của nguyên tố này có 8 electron và 8 neutron
Phương pháp giải:

A = Z + N (neutron), Z = P
Lời giải:
a)
– Nguyên tử protium: 1 proton, 0 neutron => Z = 1, A = 1 =>
– Nguyên tử deuterium: 1 proton, 1 neutron => Z = 1, A = 2 =>
– Nguyên tử tritium: 1 proton, 2 neutron => Z = 1, A = 3 =>
b)
– Nguyên tử oxygen có 8 electron
=> Số E = Số P = Z = 8
– Nguyên tử oxygen có 8 neutron
=> Số khối A = P + N = 8 + 8 = 16
=> Kí hiệu nguyên tử
3. Đồng vị
Câu hỏi 7 trang 22 Hóa học 10: Quan sát Hình 3.2, so sánh điểm giống và khác nhau giữa các loại nguyên tử của nguyên tố hydrogen
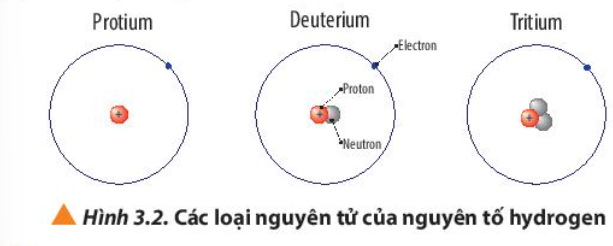
Phương pháp giải:
So sánh số proton, neutron và electron
Lời giải:
|
|
Protium |
Deuterium |
Tritium |
|
Giống nhau |
Đều có 1 electron và 1 proton |
||
|
Khác nhau |
Không có neutron |
1 neutron |
2 neutron |
Giải hóa học 10 trang 23 Chân trời sáng tạo
Luyện tập trang 23 Hóa học 10: Kim cương là một trong những dạng tồn tại của nguyên tố carbon trong tự nhiên. Nguyên tố này có hai đồng vị bền với số khối lần lượt là 12 và 13. Hãy viết kí hiệu nguyên tử của hai đồng vị này
Phương pháp giải:

– Carbon có 6 proton => Số hiệu nguyên tử Z = 6
Lời giải:
– Carbon có số khối = 12:
– Carbon có số khối = 13:
4. Nguyên tử khối và nguyên tử khối trung bình
Câu hỏi 8 trang 23 Hóa học 10: Nguyên tử của nguyên tố magnesium (Mg) có 12 proton và 12 neutron. Nguyên tử khối của Mg là bao nhiêu?
Phương pháp giải:
Nguyên tử khối của một nguyên tử có giá trị bằng số khối
Lời giải:
– Nguyên tử Mg có 12 proton, 12 neutron
=> Số khối: A = P + N = 12 + 12
– Mà nguyên tử khối của 1 nguyên tử = số khối
=> Nguyên tử khối của Mg = 24
Câu hỏi 9 trang 23 Hóa học 10: Trong tự nhiên, nguyên tố copper có hai đồng vị với phần trăm số nguyên tử tương ứng là (69,15%) và (30,85%). Hãy tính nguyên tử khối trung bình của nguyên tố copper
Phương pháp giải:
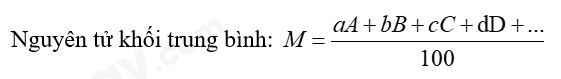
Trong đó: A, B, C, D… là số khối của các đồng vị
a, b, c, d… là phần trăm của các đồng vị tương ứng
Lời giải:
Ta có: 63Cu chiếm 69,15%; 65Cu chiếm 30,85%
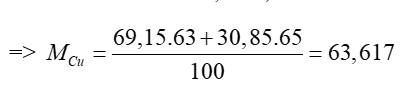
Vậy nguyên tử khối trung bình của Cu là 63,617
Giải hóa học 10 trang 24 Chân trời sáng tạo
Vận dụng trang 24 Hóa học 10: Trong thể dục thể thao, có một số vận động viên sử dụng các loại chất kích thích trong thi đấu, gọi là doping, dẫn đến thành tích đạt được của họ không thật so với năng lực vốn có. Một trong các loại doping thường gặp nhất là testosterone tổng hợp
Tỉ lệ giữa hai đồng vị (98,98%) và (1,11%) là không đổi đối với testosterone tự nhiên trong cơ thể, Trong khi testosterone tổng hợp (tức doping) có phần trăm số nguyên tử đồng vị ít hơn testosterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR (Carbon Isotope Ratio – Tỉ lệ đồng vị carbon) – một xét nghiệm với mục đích xác định xem vận động viên có sử dụng doping hay không.
Giả sử, thực hiện phân tích CIR đối với một vận động viên thu được kết quả phần trăm số nguyên tử đồng vị là x và là y. Từ tỉ lệ đó, người ta tính được nguyên tử khối trung bình của carbon trong mẫu phân tích có giá trị là 12,0098. Với kết quả thu được, em có nghi ngờ vận động viên này sử dụng doping hay không? Vì sao?
Phương pháp giải:
Ta có hệ phương trình:
x + y = 100
Lời giải:
– Nguyên tố carbon có 2 đồng vị là và
– Đồng vị chiếm x%
– Đồng vị chiếm y%
=> x + y = 100 (1)
– Nguyên tử khối trung bình của carbon trong mẫu phân tích = 12,009
=> (2)
Từ (1) và (2) => x = 99,02 và y = 0,98
Nhận thấy 0,98 < 1,11
=> Vận động viên này sử dụng doping
Giải hóa học 10 trang 25 Chân trời sáng tạo
Bài tập (trang 25)
Bài 1 trang 25 Hóa học 10: Một nguyên tử X gồm 16 proton, 16 electron và 16 neutron. Nguyên tử X có kí hiệu là
A.
B.
C.
D.
Phương pháp giải:
– Số P = Số Z
– Số khối A = N + P
Lời giải:
– Nguyên tử X có 16 proton => Nguyên tử S
– Số proton = số hiệu nguyên tử = 16 => Z = 16
– Số khối = số proton + số neutron = 16 + 16 = 32
=> Kí hiệu nguyên tử X:
Đáp án C
Bài 2 trang 25 Hóa học 10: Silicon là nguyên tố được sử dụng để chế tạo vật liệu bán dẫn, có vai trò quan trọng trong sản xuất công nghiệp. Trong tự nhiên, nguyên tố này có 3 đồng vị với số khối lần lượt là 28, 29, 30. Viết kí hiệu nguyên tử cho mỗi đồng vị của silicon. Biết nguyên tố silicon có số hiệu nguyên tử là 14.
Phương pháp giải:

Lời giải:
– Số khối = 28:
– Số khối = 29:
– Số khối = 30:
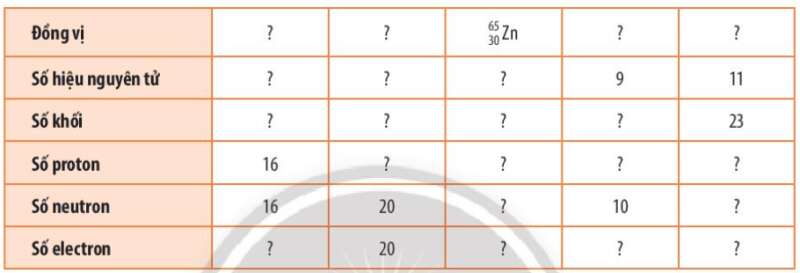
Bài 3 trang 25 Hóa học 10: Hoàn thành những thông tin chưa biết trong bảng sau:
Phương pháp giải:

– Số hiệu nguyên tử = số proton = số electron
– Số khối: A = số proton (P) + số neutron (N)
Lời giải:
|
Đồng vị |
|||||
|
Số hiệu nguyên tử |
16 |
20 |
30 |
9 |
11 |
|
Số khối |
32 |
40 |
65 |
19 |
23 |
|
Số proton |
16 |
20 |
30 |
9 |
11 |
|
Số neutron |
16 |
20 |
35 |
10 |
12 |
|
Số electron |
16 |
20 |
30 |
9 |
11 |
Bài 4 trang 25 Hóa học 10: Trong tự nhiên, magnesium có 3 đồng vị bền là 24Mg, 25Mg và 26Mg. Phương pháp phổ khối lượng xác nhận đồng vị 26Mg chiếm tỉ lệ phần trăm số nguyên tử là 11%. Biết rằng nguyên tử khối trung bình của Mg là 24,32. Tính % số nguyên tử của đồng vị 24Mg, đồng vị 25Mg?
Phương pháp giải:
Bước 1: Gọi phần trăm đồng vị 24Mg là x%
=> Phần trăm đồng vị 25Mg là: 100 – 11 – x
Bước 2: Áp dụng công thức:
Nguyên tử khối trung bình:
Trong đó: A, B, C, D… là số khối của các đồng vị
a, b, c, d… là phần trăm của các đồng vị tương ứng
Lời giải:
Gọi phần trăm đồng vị 24Mg là x%
=> Phần trăm đồng vị 25Mg là: 100 – 11 – x = (89 – x) %
Nguyên tử khối trung bình của Mg = 24,32
Áp dụng công thức:
=>
=> x = 79%
=> Phần trăm đồng vị 24Mg là 79%
=> Phần trăm đồng vị 25Mg là: 10%
Bài giảng Hóa học 10 Bài 3: Nguyên tố hóa học – Chân trời sáng tạo
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 2: Thành phần của nguyên tử
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm