Giải bài tập Hóa học lớp 10 Bài 19: Tốc độ phản ứng
Giải hóa học 10 trang 92 Kết nối tri thức
Mở đầu trang 92 Hóa học 10: Làm thế nào có thể so sánh sự nhanh, chậm của các phản ứng hóa học để thúc đẩy hoặc kìm hãm nó theo mong muốn?
Phương pháp giải:
Các phản ứng khác nhau sẽ xảy ra với thời gian khác nhau.
Lời giải:
Thời gian là đại lượng để xác định sự nhanh, chậm của các phản ứng hóa học.
Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất đầu hoặc sản phẩm trong một đơn vị thời gian: giây(s), phút (min), giờ (h), ngày(d),..
Giải hóa học 10 trang 93 Kết nối tri thức
I. Tốc độ phản ứng hóa học
Câu hỏi 1 trang 93 Hóa học 10: Xét phản ứng H2 + Cl2 → 2HCl
Nghiên cứu sự thay đổi nồng độ một chất trong phản ứng theo thời gian, thu được đồ thị sau:
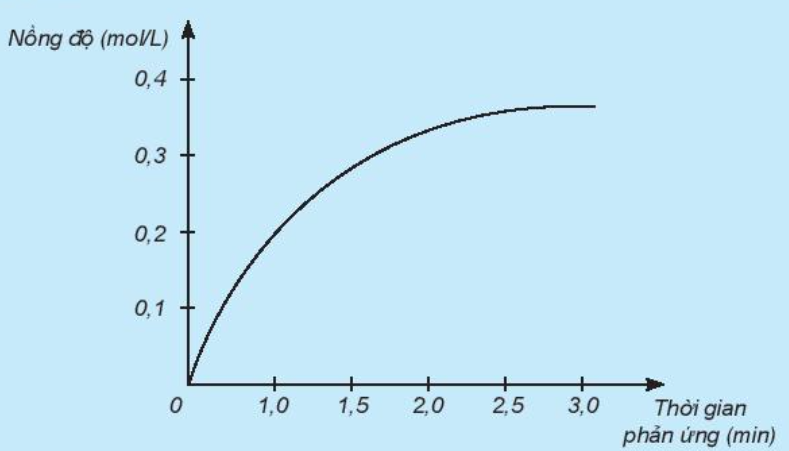
a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
b) Nêu đơn vị của tốc độ phản ứng trong trường hợp này.
Phương pháp giải:
a) Khi phản ứng hóa học xảy ra, lượng chất đầu giảm dần theo thời gian, trong khi lượng sản phẩm tăng dần theo thời gian.
b) Đơn vị thời gian: giây(s), phút (min), giờ (h), ngày(d),..
Lời giải:
a) Theo thời gian, nồng độ có xu hướng tăng dần
=> Đồ thị mô tả sự thay đổi nồng độ theo thời gian của sản phẩm HCl
b) Đơn vị của tốc độ phản ứng trong trường hợp này là phút (min).
Giải hóa học 10 trang 94 Kết nối tri thức
Câu hỏi 2 trang 94 Hóa học 10: Cho phản ứng của các chất ở thể khí
2NO + 2H2 → N2 + 2H2O
Hãy viết biểu thức tính tốc độ trung bình theo sự biến đổi nồng độ chất đầu và chất sản phẩm của phản ứng trên.
Phương pháp giải:
Từ phương trình hóa học, cho thấy tỉ lệ cứ 2 mol NO phản ứng với 2 mol H2, sinh ra 1 mol N2 và 2 mol H2
Lời giải:
Gọi ∆CNO, ∆CH2, ∆CN2, ∆CH2O lần lượt là biến thiên nồng độ các chất NO, H2, N2 và H2O trong khoảng thời gian . Tốc độ trung bình của phản ứng được tính theo biểu thức:
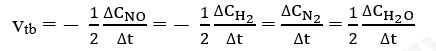
Giải hóa học 10 trang 96 Kết nối tri thức
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng
Câu hỏi 3 trang 96 Hóa học 10: Cho phản ứng của các chất ở thể khí: X + Y → XY
Biết tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia và phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.
a) Hãy viết phương trình tốc độ của phản ứng này.
b) Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4L/(mol.s).
Nồng độ đầu của X và Y lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:
– Tại thời điểm đầu.
– Tại thời điểm đã hết một nửa lượng X.
Phương pháp giải:
Tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia và phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.
Lời giải:
a) v = k . CX.CY
Trong đó k là hằng số tốc độ phản ứng
CX.CY lần lượt là nồng độ của X và Y tại một thời điểm đang xét
b)
– Tốc độ phản ứng tại thời điểm đầu:
v = k . CX.CY = 2,5 . 10-4 . 0,02 . 0,03 = 1,5 . 10-7(mol/(Ls))
– Tốc độ phản ứng tại thời điểm hết một nửa lượng X
=> CX= 0,01 M
CY = 0,02 M
v = k . CX.CY = 2,5 . 10-4 . 0,01 . 0,02 = 5.10-8(mol/(Ls))
Giải hóa học 10 trang 97 Kết nối tri thức
Câu hỏi 4 trang 97 Hóa học 10: Nêu mối liên hệ giữa nồng độ và áp suất của khí trong hỗn hợp.
Phương pháp giải:
Nồng độ mỗi khí tỉ lệ thuận với áp suất của nó.
Lời giải:
Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên.
Câu hỏi 5 trang 97 Hóa học 10: Áp suất ảnh hưởng đến tốc độ phản ứng nào sau đây?
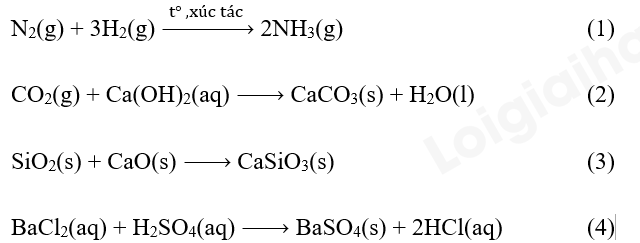
Phương pháp giải:
Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
Lời giải:
Phản ứng (1) và (2) có sự tham gia của chất khí
=> Áp suất ảnh hưởng đến tốc độ phản ứng (1) và (2).
Giải hóa học 10 trang 98 Kết nối tri thức
Câu hỏi 6 trang 98 Hóa học 10: Hãy giải thích tại sao khi nhiệt độ tăng thì tốc độ phản ứng tăng.
Phương pháp giải:
Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn.
Lời giải:
Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Câu hỏi 7 trang 98 Hóa học 10: Nêu ý nghĩa của hệ số nhiệt độ Van’t Hoff.
Phương pháp giải:
– Thực nghiệm cho thấy khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng thường tăng từ 2 đến 4 lần.
– Tỉ số tốc độ phản ứng tại nhiệt độ T và T+10 được biểu diễn thông qua đại lượng hệ số nhiệt độ .
Lời giải:
Hệ số nhiệt độ Van’t Hoff là tỉ số giữa tốc độ phản ứng tại nhiệt độ T và T+10 nên giá trị càng lớn thì ảnh hưởng của nhiệt độ đến phản ứng càng mạnh.
Câu hỏi 8 trang 98 Hóa học 10: Ở 20 oC, tốc độ một phản ứng là 0,05 mol/(L.min). Ở 30oC, tốc độ phản ứng này là 0,15 mol/(L.min).
a) Hãy tính hệ số nhiệt độ Van’t Hoff của phản ứng trên.
b) Dự đoán tốc độ phản ứng trên ở 40oC (giả thiết hệ số nhiệt độ trong khoảng nhiệt độ này không đổi).
Phương pháp giải:
Lời giải:
a) = 0,15 : 0,05 = 3
b) = v40/v30 = v40/0,15 = 3
=> v40 = 0,15.3 = 0,45 mol/L.min
Giải hóa học 10 trang 99 Kết nối tri thức
Câu hỏi 9 trang 99 Hóa học 10: Thực hiện hai phản ứng phân hủy H2O2; một phản ứng có xúc tác MnO2, một phản ứng không xúc tác. Đo thể tích khí oxygen theo thời gian và biểu diễn trên đồ thị như hình bên: Đường phản ứng nào trê đồ thị (Hình19.6) tương ứng với phản ứng có xúc tác, với phản ứng không có xúc tác.
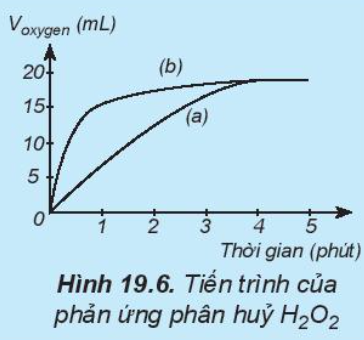
Phương pháp giải:
Khi có chất xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hóa thấp hơn so với phản ứng không xúc tác. Do đó số hạt có đủ năng lượng hoạt hóa sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
Lời giải:
Trong cùng khoảng thời gian, thể tích khí oxygen được biểu diễn theo đường (b) lớn hơn so với đường (a).
=> Đường phản ứng (a) tương ứng với phản ứng không có xúc tác.
Đường phản ứng (b) tương ứng với phản ứng có xúc tác.
Giải hóa học 10 trang 100 Kết nối tri thức
III. Một số ứng dụng của việc thay đổi tốc độ phản ứng
Câu hỏi 10 trang 100 Hóa học 10: Yếu tố nào đã được áp dụng để làm thay đổi tốc độ của các phản ứng trong Hình 19.7?

Phương pháp giải:
Trong đời sống và sản xuất, con người áp dụng nhiều biện pháp kĩ thuật để thay đổi tốc độ phản ứng như thay nồng độ , nhiệt độ, dùng chất xúc tác,…
Lời giải:
a) Sử dụng oxygen nguyên chất => tăng nồng độ
b) Tủ lạnh bảo quản => hạ nhiệt độ, kìm hãm tốc độ chuyển hóa các chất.
c) Muối dưa bằng cách cho thêm muối, nước chua,… => thêm chất xúc tác,
Câu hỏi 11 trang 100 Hóa học 10: Phản ứng tạo NO từ NH3 là một giai đoạn trung gian trong quá trình sản xuất nitric acid:
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Hãy nêu một số cách để tăng tốc độ phản ứng này.
Phương pháp giải:
Trong sản xuất, con người áp dụng nhiều biện pháp kĩ thuật để thay đổi tốc độ phản ứng như thay nồng độ , nhiệt độ, dùng chất xúc tác,…
Lời giải:
Phản ứng 4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g), có sự tham của chất khí nên có thể tăng tốc độ phản ứng bằng cách: tăng áp suất, tăng nhiệt độ của phản ứng.
Bài giảng Hóa học 10 Bài 19: Tốc độ phản ứng – Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 18: Ôn tập chương 5
Bài 19: Tốc độ phản ứng
Bài 20: Ôn tập chương 6
Bài 21: Nhóm halogen
Bài 22: Hydrogen halide. Muối halide