Giải bài tập Hóa học lớp 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Giải hóa học 10 trang 81 Kết nối tri thức
Mở đầu trang 81 Hóa học 10: Phản ứng giữa đường glucose với oxygen tạo ra carbon dioxide, hơi nước và tỏa nhiều nhiệt. Sau khi chơi thể thao, cơ thể mệt mỏi, nếu uống một cốc nước hoa quả, em sẽ cảm thấy khỏe hơn. Có phải đường glucose đã “cháy” và cấp bù năng lượng cho cơ thể?
Phương pháp giải:
Quá trình phân giải glucose trong cơ thể thực hiện qua 2 giai đoạn, trong đó có giai đoạn hiếu khí: chuyển axit pyruvic thành CO2 và H2O trong chu trình Krebs. Một phân tử glucozo sau một vòng chu trình Krebs giải phóng được 36 ATP, mỗi ATP khoảng 10 Kcal/mol.
Lời giải:
Do đường glucose đã phản ứng với oxygen tạo ra carbon dioxide, hơi nước, tỏa nhiều nhiệt và giải phóng được 36 ATP nên đường glucose bù năng lượng cho cơ thể.
I. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
Câu hỏi 1 trang 81 Hóa học 10: Khi đun nóng ống nghiệm đựng KMnO4 ( thuốc tím), nhiệt của ngọn lửa làm cho KMnO4 bị nhiệt phân, tạo ra hỗn hợp bột màu đen:
2KMnO4 → K2MnO4 + MnO2 + O2
Em hãy dự đoán phản ứng này tỏa nhiệt hay thu nhiệt.
Phương pháp giải:
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Lời giải chi tiết:
Khi đung nóng ống nghiệm đựng KMnO4 ( thuốc tím), nhiệt của ngọn lửa làm cho KMnO4 bị nhiệt phân. Phản ứng đốt cháy cồn (trong đèn cồn – cung cấp nhiệt) là phản ứng tỏa nhiệt, phản ứng nhiệt phân KMnO4 là phản ứng thu nhiệt.
Giải hóa học 10 trang 83 Kết nối tri thức
II. Biến thiên enthalpy của phản ứng
Câu hỏi 2 trang 83 Hóa học 10: Cho các phương trình nhiệt hóa học:
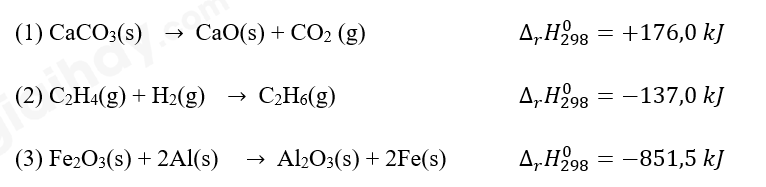
Trong các phản ứng trên, phản ứng nào tỏa nhiệt, phản ứng nào thu nhiệt?
Phương pháp giải:
Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt.
∆rH > 0: phản ứng thu nhiệt
∆rH < 0: phản ứng tỏa nhiệt
Lời giải:
– Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt.
∆rH > 0: phản ứng thu nhiệt
∆rH < 0: phản ứng tỏa nhiệt
(1) phản ứng thu nhiệt
(2) phản ứng tỏa nhiệt
(3) phản ứng tỏa nhiệt
Câu hỏi 3 trang 83 Hóa học 10: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:

Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng tỏa ra là bao nhiêu?
Phương pháp giải:
Cứ 1 mol CO được đốt cháy sẽ tỏa ra lượng nhiệt là 283,0 kJ.
Lời giải:
2,479 L khí CO tương đương với khoảng 0,11 mol
Cứ 1 mol CO được đốt cháy sẽ tỏa ra lượng nhiệt là 283,0 kJ.
=> Nhiệt lượng tỏa ra là 0,11 x 283,0 = 31,13 kJ.
Giải hóa học 10 trang 84 Kết nối tri thức
Câu hỏi 4 trang 84 Hóa học 10: Phản ứng tôi vôi tỏa ra nhiệt lượng rất lớn, có thể làm sôi nước. Hãy nêu các biện pháp để đảm bảo an toàn khi thực hiện quá trình tối vôi.
Phương pháp giải:
– Mặc đồ bảo hộ
– Chọn địa điểm tôi vôi thoáng và rộng
– Chọn dụng cụ tôi chịu nhiệt
Lời giải:
Khi thực hiện quá trình tôi vôi trong phòng thí nghiệm cần chú ý một số biện pháp sau để đảm bảo an toàn:
– Mặc đồ bảo hộ như găng tay, kính mắt
– Chọn địa điểm tôi vôi thoáng và rộng rãi, đồ dùng khác để xa khu vực tôi
– Chọn dụng cụ tôi vôi chịu nhiệt do quá trình này tỏa lượng nhiệt lớn có thể làm hỏng dụng cụ.
Giải hóa học 10 trang 86 Kết nối tri thức
III. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
Câu hỏi 5 trang 86 Hóa học 10: Cho phản ứng:
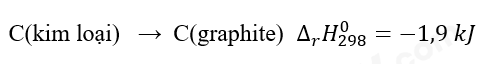
a) Ở điều kiện chuẩn, kim cương hay graphite có mức năng lượng thấp hơn?
b) Trong phản ứng xác định nhiệt tạo thành của CO2(g): C(s) + O2(g) → CO2(g), carbon ở dạng kim cương hay graphite?
Phương pháp giải:
a) Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt.
∆rH > 0: phản ứng thu nhiệt
∆rH < 0: phản ứng tỏa nhiệt
b) Nhiệt tạo thành càng nhỏ( năng lượng thấp) => Chất càng dễ phản ứng
Lời giải:
a. Biến thiên enthalpy của phản ứng = -1,9 kJ < 0
=> Phản ứng tỏa nhiệt => Graphite có nhiệt tạo thành nhỏ hơn kim cương nên graphite có mức năng lượng thấp thơn.
b. Ở điều kiện chuẩn, graphite có mức năng lượng thấp nên dễ bị phá vỡ cấu trúc
=> Graphite phản ứng được với nhiều chất khác
=> Trong phản ứng trên, carbon ở dạng kim cương.
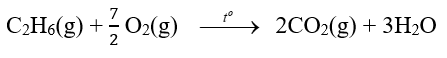
Câu hỏi 6 trang 86 Hóa học 10: Từ số liệu Bảng 17.1, hãy xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane:
Phương pháp giải:
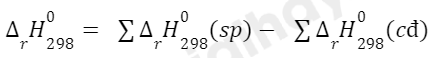
Lời giải:
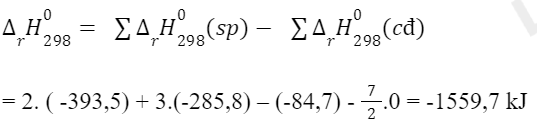
Giải hóa học 10 trang 88 Kết nối tri thức
IV. Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết
Câu hỏi 7 trang 88 Hóa học 10: a) Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng:
N2(g) + O2(g) → 2NO(g)
b) Giải thích vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Phương pháp giải:
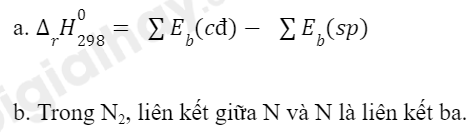
Lời giải:
![]()
b) Trong N2, liên kết giữa 2 nguyên tử là liên kết ba – một loại liên kết bển, cần 1 năng lượng rất lớn để phá vỡ liên kết đó.
=> N2 khá trơ về mặt hóa học và chỉ phản ứng với oxy khi có nhiệt đô cao hoặc có tia lửa điện
Câu hỏi 8 trang 88 Hóa học 10: Từ số liệu năng lượng liên kết ở Bảng 12.2, hãy tính biến thiên enthalpy của phản ứng đốt cháy butane theo năng lượng liên kết, biết sản phảm phản ứng đều ở thể khí.
Phương pháp giải:
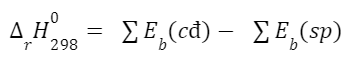
Lời giải:

Bài giảng Hóa học 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học – Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 16: Ôn tập chương 4
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Bài 18: Ôn tập chương 5
Bài 19: Tốc độ phản ứng
Bài 20: Ôn tập chương 6