Giải bài tập Hóa học lớp 10 Bài 13: Liên kết hydrogen và tương tác van der waals
Video giải Hóa học 10 Bài 13: Liên kết hydrogen và tương tác van der waals – Kết nối tri thức
Giải hóa học 10 trang 64 Kết nối tri thức
Mở đầu trang 64 Hóa học 10: Ở áp suất khí quyển, nhiệt độ sôi của H2O là 1000C, CH4 là -161,580C, H2S là -60,280C. Vì sao các chất trên có nhiệt độ sôi khác nhau.
Phương pháp giải:
Liên kết hydrogen làm tăng nhiệt độ sôi của nước so với H2S và CH4.
Lời giải:
– Liên kết hydrogen được hình thành giữa nguyên tử hydrogen với các nguyên tử có độ âm điện lớn và các nguyên tử này phải có 1 ít nhất một cặp electron hóa trị chưa tham gia liên kết.
– Do O và S đều còn 2 cặp electron hóa trị chưa tham gia liên kết, C không còn cặp electron hóa trị tự do nên H2O và H2S có thể tạo liên kết hydrogen trong phân tử, còn CH4 thì không.
=> Nhiệt độ sôi của H2O và H2S lớn hơn CH4.
– Do độ âm điện của O lớn hơn S nên liên kết hydrogen trong phân tử H2O mạnh hơn trong phân tử H2S.
=> Nhiệt độ sôi của H2O lớn hơn H2S.
I. Mở đầu
Giải hóa học 10 trang 66 Kết nối tri thức
II. Liên kết hydrogen
Câu 1 trang 66 Hóa học 10: Vẽ sơ đồ biểu diễn liên kết hydrogen giữa:
a) hai phân tử hydrogen fluoride (HF)
b) phân tử hydrogen fluoride (HF) và phân tử ammonia (NH3).
Phương pháp giải:
– Liên kết hydrogen được hình thành giữa nguyên tử hydrogen với các nguyên tử có độ âm điện lớn (F, N, O…) và các nguyên tử này phải có 1 ít nhất một cặp electron hóa trị chưa tham gia liên kết.
– Liên kết hydrogen được biểu diễn bằng dấu ba chấm (…)
Lời giải:
a)
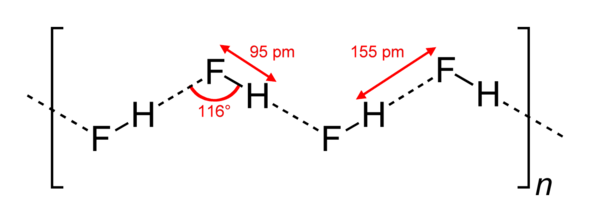
b)
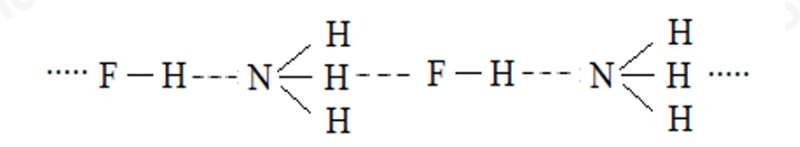
Câu 2 trang 66 Hóa học 10: Những nguyên tử hydrogen nào trong phân tử ethanol (CH3CH2OH) không tham gia vào liên kết hydrogen? Vì sao?
Phương pháp giải:
– Liên kết hydrogen được hình thành giữa nguyên tử hydrogen với các nguyên tử có độ âm điện lớn (F, N, O…) và các nguyên tử này phải có 1 ít nhất một cặp electron hóa trị chưa tham gia liên kết.
Lời giải:
Công thức cấu tạo ethanol
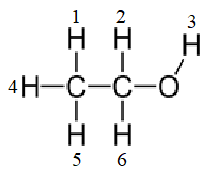
Trong phân tử ethanol, có 6 nguyên tử H liên kết với C và O. Tuy nhiên, duy nhất H(3) liên kết với O có độ âm điện lớn và còn 2 cặp electron hóa trị chưa tham gia liên kết nên H (3) đủ điều kiện tham gia liên kết hydrogen với phân tử ethanol khác.
Giải hóa học 10 trang 67 Kết nối tri thức
III. Tươngg tác van der waals
Câu 3 trang 67 Hóa học 10: Hãy giải thích sự khác nhau về nhiệt độ sôi của butane và isobutane.
Phương pháp giải:
Diện tích tiếp xúc giữa các phân tử càng lớn thì nhiệt độ sôi càng lớn.
Lời giải:
Đồng phân mạch không phân nhánh butane có nhiệt độ sôi cao hơn so với đồng phân mạch phân nhánh isobutan do diện tích tiếp xúc giữa các phân tử butane lớn hơn nhiều so với isobutane.
Bài giảng Hóa học 10 Bài 13: Liên kết hydrogen và tương tác van der waals – Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 12: Liên kết cộng hóa trị
Bài 13: Liên kết hydrogen và tương tác van der waals
Bài 14: Ôn tập chương 3
Bài 15: Phản ứng oxi hóa – khử
Bài 16: Ôn tập chương 4