Giải bài tập Hóa học lớp 10 Bài 12: Liên kết cộng hóa trị
Video giải Hóa học 10 Bài 12: Liên kết cộng hóa trị – Kết nối tri thức
Giải hóa học 10 trang 55 Kết nối tri thức
Mở đầu trang 55 Hóa học 10: Nguyên tử hydrogen và chlorine dễ dàng kết hợp để tạo thành phân tử hydrogen chloride (HCl), liên kết trong trường hợp này có gì khác so với liên kết ion trong phân tử sodium chloride (NaCl)?
Phương pháp giải:
– Liên kết trong phân tử HCl là liên kết cộng hóa trị.
– Liên kết trong phân tử NaCl là liên kết ion.
Lời giải:
– Nguyên tử H có 1 electron lớp ngoài cùng, cần 1 electron để đạt cấu hình bền giống He. Nguyên tử Cl có 7 electron lớp ngoài cùng, cũng cần 1 electron để đạt cấu hình bền giống Ne.
=> H và Cl khi liên kết với nhau có xu hướng góp chung electron để xung quanh mỗi nguyên tử đều có số electron đạt cấu hình bền của khí hiếm tạo liên kết cộng hóa trị.
– Trong phân tử NaCl có ion sodium mang điện tích dương, ion chlorine mang điện tích âm nên hình thành liên kết ion.
Vậy liên kết trong phân tử HC là liên kết cộng hóa trị còn liên kết trong phân tử NaCl là liên kết ion.
Giải hóa học 10 trang 58 Kết nối tri thức
I. Sự tạo thành liên kết cộng hóa trị
Câu 1 trang 58 Hóa học 10: Viết công thức electron, công thức cấu tạo và công thức Lewis của các phân tử:
a) Bromine (Br2). b) Hydrogen sulfide (H2S).
c) Methane (CH4). d) Ammonia (NH3).
e) Ethene ( C2H4). g) Ethyne (C2H2).
Phương pháp giải:
– Khi hai nguyên tử phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp một hoặc nhiều elctron để tạo thành các cặp electron dùng chung => thu được công thức electron
– Từ công thức electron, thay một cặp electron dùng chung bằng một gạch nối thì thu được công thức Lewis (Li – uýt).
– Công thức cấu tạo chỉ còn các liên kết biểu diễn dưới dạng gạch nối, không còn electron.
Lời giải:
a) Bromine (Br2).
Phân tử Bromine: Nguyên tử bromine có 7 electron hóa trị, hai nguyên tử bromine liên kết với nhau bằng cách mỗi nguyên tử bromine đóng góp 1 electron tạo thành cặp electron dùng chung.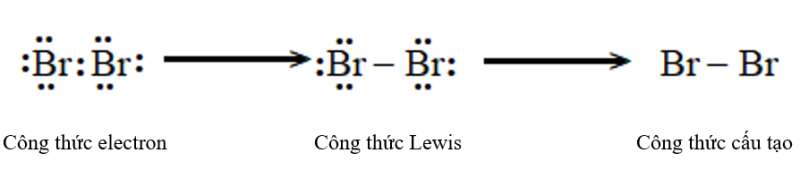
b) Hydrogen sulfide (H2S).
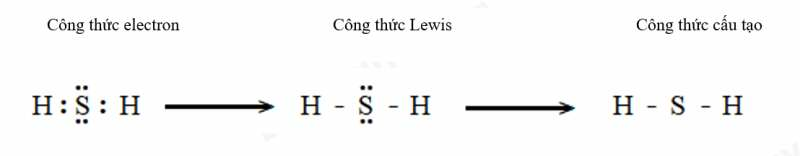
c) Methane (CH4).
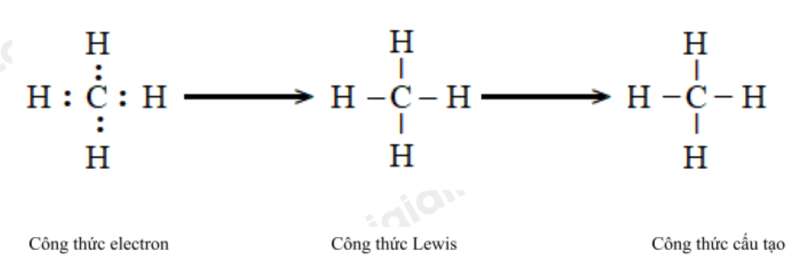
d) Ammonia (NH3)
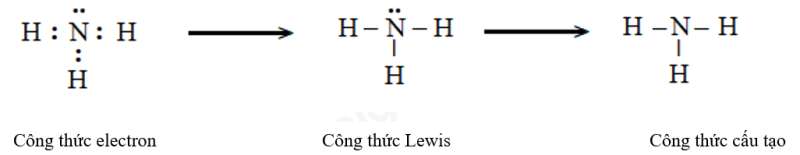
e) Ethene (C2H4)
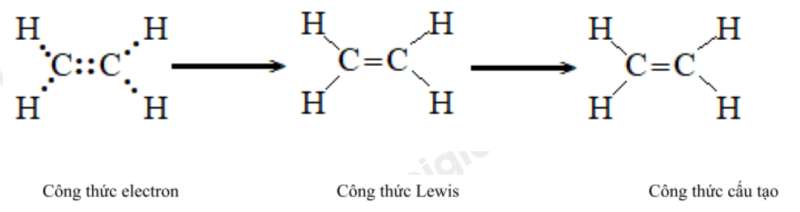
g) Ethyne (C2H2)
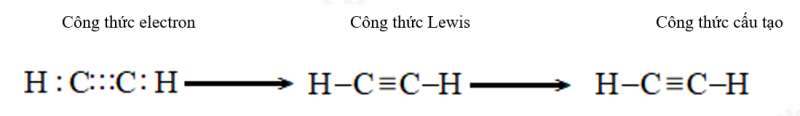
Giải hóa học 10 trang 59 Kết nối tri thức
II. Độ âm điện và liên kết hóa học
Câu 2 trang 59 Hóa học 10: Dựa vào giá trị độ âm điện trong Bảng 6.2, dự đoán loại liên kết (liên kết cộng hóa trị phân cực, liên kết cộng hóa trị không phân cực, liên kết ion) trong các phân tử MgCl2, AlCl3, HBr, O2, H2, NH3.
Phương pháp giải:
Dựa vào hiệu độ âm điện của các nguyên tử, dự đoán loại liên kết

Lời giải:
– Trong phân tử MgCl2, hiệu độ âm điện của Cl và Mg là: 3,16 – 1,31 = 1,85 > 1,7. Vì vậy, liên kết giữa Mg và Cl là liên kết ion.
– Trong phân tử AlCl3, hiệu độ âm điện của Cl và Al là: 3,16 – 1,61 = 1,85. Vì vậy, liên kết giữa Al và Cl là liên kết cộng hóa trị phân cực.
– Trong phân tử HBr, hiệu độ âm điện của Br và H là: 2,96 – 2,2 = 0,76. Vì vậy, liên kết giữa H và Br là liên kết cộng hóa trị phân cực.
– Trong phân tử O2, hiệu độ âm điện của O và O là: 3,44 – 3,44= 0. Vì vậy, liên kết giữa O và O là liên kết cộng hóa trị không phân cực.
– Trong phân tử H2, hiệu độ âm điện của H và H là: 2,2 – 2,2 = 0. Vì vậy, liên kết giữa H và H là liên kết cộng hóa trị không phân cực.
– Trong phân tử NH3, hiệu độ âm điện của N và H là: 3,04 – 2,2 = 1,04. Vì vậy, liên kết giữa Mg và Cl là liên kết cộng hóa trị phân cực.
Giải hóa học 10 trang 61 Kết nối tri thức
III. Mô tả liên kết cộng hóa trị bằng sự xen phủ các orbital nguyên tử
Câu 3 trang 61 Hóa học 10: Sự hình thành liên kết σ và liên kết π khác nhau như thế nào?
Phương pháp giải:
– Trong các trường hợp xen phủ, các orbital sẽ xen phủ với nhau theo trục liên kết. Sự xen phủ như thế gọi là xen phủ trục, tạo ra liên kết .
– Sự xen phủ, trong đó trục của các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết, được gọi là xen phủ bên, tạo ra liên kết
Lời giải:
a) Liên kết σ
– Liên kết σ được hình thành do sự xen phủ giữa hai obitan hóa trị của hai nguyên tử tham gia liên kết dọc theo trục liên kết.
– Tính chất của liên kết σ là đối xứng qua trục liên kết, các nguyên tử tham gia liên kết quay quanh trục liên kết. Liên kết σ bền hơn các loại liên kết khác.
b) Liên kết π
– Liên kết π là liên kết được hình thành do sự xen phủ giữa hai obitan hóa trị của 2 nguyên tử tham gia liên kết ở hai bên trục liên kết (xen phủ bên).
– Tính chất của liên kết π là không có tính đối xứng trục, nên hai nguyên tử tham gia liên kết không có khả năng quay quanh trục liên kết và kém bền hơn các liên kết khác.
Câu 4 trang 61 Hóa học 10: Số liên kết σ và π có trong phân tử C2H4 lần lượt là
A. 4 và 0.
B. 2 và 0.
C. 1 và 1.
D. 5 và 1.
Phương pháp giải:
Liên kết đơn là liên kết .
Liên kết đôi gồm 1 liên kết và 1 liên kết
Lời giải:
Trong phân tử C2H4, có 4 liên đơn kết C – H và 1 liên kết đôi C = C. Vì thế, số liên kết và có trong phân tử C2H4 lần lượt là 5 và 1.
=> Đáp án D.
Giải hóa học 10 trang 62 Kết nối tri thức
IV. Năng lượng liên kết cộng hóa trị
Câu 5 trang 62 Hóa học 10: Năng lượng liên kết là gì? Năng lượng liên kết của phân tử Cl2 là 243 kJ/mol cho biết điều gì?
Phương pháp giải:
Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học.
Lời giải:
– Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí.
– Để phá vỡ 1 mol liên kết Cl – Cl thành các nguyên tử H và Cl ( ở thể khí) cần năng lượng là 243 kJ, nên năng lượng liên kết Cl – Cl là Eb = 243 kJ/mol.
Câu 6 trang 62 Hóa học 10: Dựa vào giá trị năng lượng liên kết ở bảng 12.2, hãy chọn phương án đúng khi so sánh độ bền liên kết giữa Cl2, Br2 và I2.
A. I2 > Br2 > Cl2.
B. Br2 > Cl2 > I2.
C. Cl2 > Br2 > I2.
D. Cl2 > I2 > Br2.
Phương pháp giải:
Năng lượng liên kết đặc trưng cho độ bền của liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và phân tử càng khó bị phân hủy.
Lời giải: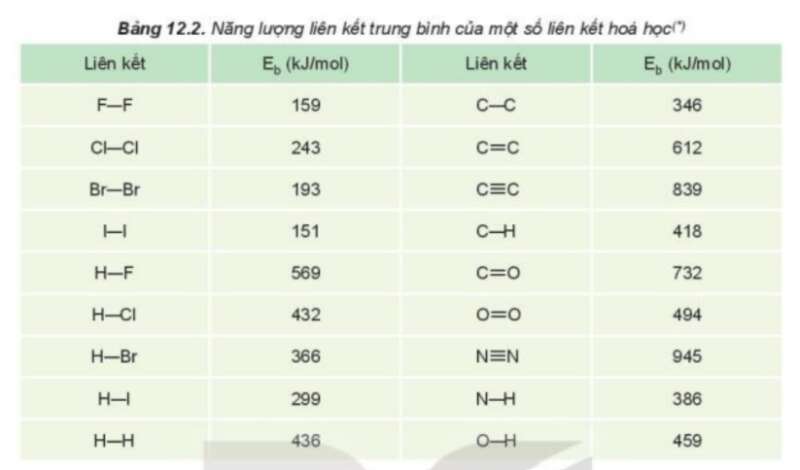
Năng lượng càng lớn thì liên kết đó càng bền.
=> Đáp án C.
Bài giảng Hóa học 10 Bài 12: Liên kết cộng hóa trị – Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 11: Liên kết ion
Bài 12: Liên kết cộng hóa trị
Bài 13: Liên kết hydrogen và tương tác van der waals
Bài 14: Ôn tập chương 3
Bài 15: Phản ứng oxi hóa – khử