|
SỞ GD & ĐT THANH HÓA CỤM CÁC TRƯỜNG THPT PHÍA BẮC |
ĐỀ THI CHỌN HỌC SINH GIỎI CẤP CỤM NĂM HỌC 2020-2021 MÔN : HÓA HỌC LỚP 10 Thời gian: 150 phút (không kể thời gian giao đề) |
Họ và tên: ………………………………………. SBD: …………..
Câu 1: (2,0 điểm)
Ở trạng thái cơ bản, nguyên tố X có 11 electron thuộc các phân lớp p. X có hai đồng vị hơn kém nhau hai nơtron. Trong đồng vị số khối lớn, số hạt mang điện gấp 1,7 lần hạt không mang điện.
1. Viết cấu hình electron của X.
2. Xác định vị trí của X trong bảng tuần hoàn.
3.Xác định thành phần cấu tạo (số hạt p, n, e) của hai đồng vị.
4. Trong tự nhiên, nguyên tố Clo có 2 đồng vị là 35Cl và 37Cl. Nguyên tử khối trung bình của Clo là 35,5. Trong hợp chất HClOx, nguyên tử đồng vị 35Cl chiếm 26,12% về khối lượng. Xác định công thức phân tử của hợp chất HClOx (cho H = 1; O = 16)
Câu 2: (2,0 điểm)
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (trong đó R có số oxi hóa thấp nhất) là a%, còn trong oxit cao nhất là b%.
1. Xác định R biết rằng
2. Viết công thức phân tử, xác định số oxi hóa của R trong hợp chất khí với hiđro và trong oxit cao nhất của nó.
Câu 3: (2,0 điểm)
1. Viết công thức electron và công thức cấu tạo của các phân tử: Cl2, HCl theo quy tắc bát tử.
2. Dựa vào hiệu độ âm điện hãy xác định loại liên kết hóa học (ion, CHT phân cực, CHT không phân cực) trong các phân tử: HCl và NaCl. Cho biết độ âm điện của các nguyên tố là: H = 2,20; Cl = 3,16; Na = 0,93.
Câu 4: (2,0 điểm)
Cho 1 mol chất X phản ứng với dung dịch H2SO4 (đặc, nóng, dư) đều thu được sản phẩm chỉ gồm Fe2(SO4)3, 0,5 mol SO2, H2O. Chọn 2 chất X thỏa mãn tính chất điều kiện đề bài, viết và cân bằng các phản ứng theo phương pháp thăng bằng electron.
Câu 5: (2,0 điểm)
1. Hoàn thành phản ứng theo sơ đồ sau (ghi rõ điều kiện phản ứng nếu có):
HCl NaCl Cl2NaClONaHCO3
2. Nêu hiện tượng và viết phương trình phản ứng hóa học trong các thí nghiệm sau:
a) Sục khí H2S vào dung dịch CuCl2.
d) Sục khí SO2 dư vào dung dịch KMnO4.
Câu 6: (2,0 điểm)
Cho biết A, B, C, D, E, G là các chất sau: O2, O3, Cl2, HCl, H2S, SO2.
– A có mùi trứng thối, có trong khí núi lửa, khi tác dụng với dung dịch Pb(NO3)2 thu được kết tủa màu đen.
– B có khả năng làm mất màu dung dịch Br2, là một trong những nguyên nhân chính gây ra hiện tượng mưa axit.
– C và E là 2 dạng thù hình của cùng một nguyên tố, C có tính oxi hóa mạnh hơn E.
– G có màu vàng lục, thường được dùng để khử trùng nước sinh hoạt.
– Khi cho D hoặc G tác dụng với kim loại Na thu được sản phẩm trong đó đều có NaCl.
Xác định các chất A, B, C, D, E, G và viết các phương trình phản ứng minh họa (nếu có).
Câu 7: (2,0 điểm)
1. Bằng phương pháp hóa học hãy phân biệt các dung dịch sau: HCl; NaOH; HNO3; KNO3.
2. Từ các hóa chất là KClO3, FeS, và dung dịch HCl. Các thiết bị thí nghiệm và điều kiện phản ứng coi như có đủ, hãy viết các phương trình phản ứng điều chế 4 chất khí khác nhau.
Câu 8: (2,0 điểm)
1. Cho 3,87 gam hỗn hợp A gồm Mg và Al tác dụng vừa đủ với 162,5 ml dung dịch HCl 7,3% thu được dung dịch B và 4,368 lít khí H2 (đktc).
a) Tính thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp A.
b) Tính nồng độ % của các muối có trong dung dịch B.
2. Cho 14 gam sắt tác dụng vừa đủ với dung dịch H2SO4 24,5% thu được dung dịch A. Làm lạnh dung dịch A xuống 30C thấy có 55,53 gam tinh thể tách ra. Biết nồng độ muối sunfat trong dung dịch bão hòa ở nhiệt độ đó là 13,18%. Xác định công thức tinh thể ngậm nước.
Câu 9: (2,0 điểm)
1. Cho 14 gam Fe tác dụng với khí O2, đun nóng. Sau một thời gian thu được 17,2 gam hỗn hợp X gồm Fe, FeO, Fe2O3, Fe3O4. Hòa tan hoàn toàn hỗn hợp X bằng dung dịch H2SO4 đặc, nóng, dư thu được dung dịch Y và V lít khí SO2 (đktc). Tính V.
2. Oleum X có công thức là H2SO4.nSO3.
a) Hòa tan hoàn toàn 41,8 gam X vào nước dư thu được dung dịch Y. Để trung hòa ½ dung dịch Y cần vừa đủ 500 ml dung dịch NaOH 1M. Xác định công thức của X.
b) Tính khối lượng X và khối lượng nước cần lấy để điều chế được 101,4 gam oleum mới có công thức là H2SO4.(n-1)SO3.
Câu 10: (2,0 điểm)
Cho sơ đồ điều chế khí O2 trong phòng thí nghiệm:
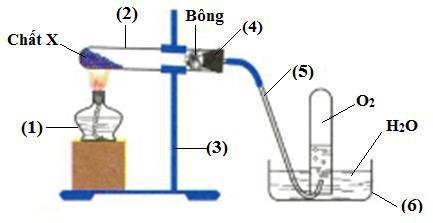 1. Nêu tên các dụng cụ thí nghiệm đã đánh số trong hình vẽ.
1. Nêu tên các dụng cụ thí nghiệm đã đánh số trong hình vẽ.
2. Chỉ ra hai chất có thể là X trong sơ đồ trên (ngoài KClO3), viết phương trình phản ứng minh họa.
3. Hãy giải thích tại sao trong thí nghiệm trên:
– khí O2 lại được thu bằng phương pháp đẩy nước?
– khi kết thúc thí nghiệm phải tháo ống dẫn khí trước khi tắt đèn cồn?
……………………………………………. HẾT …………………………………………….
– Cho khối lượng nguyên tử của các nguyên tố như sau: H = 1; Cl = 35,5; O = 16; S = 32; Mg = 24; Al = 27; Na = 23; Ba = 137; Fe = 56.
– Thí sinh không được sử dụng bảng tuần hoàn.
– Giám thị coi thi không giải thích gì thêm.
|
SỞ GD & ĐT THANH HÓA CỤM CÁC TRƯỜNG THPT PHÍA BẮC |
ĐÁP ÁN ĐỀ THI CHỌN HỌC SINH GIỎI CẤP CỤM NĂM HỌC 2020-2021 MÔN : HÓA HỌC LỚP 10 |
|
CÂU |
Ý |
NỘI DUNG |
ĐIỂM |
||||||||||
|
1 |
1 |
Vì X có 11 electron thuộc phân lớp p cấu hình electron đầy đủ: 1s22s22p63s23p5 |
0.5 |
||||||||||
|
2 |
Vị trí của X trong bảng tuần hoàn: Ô số 17 vì có 17 electron điện tích hạt nhân bằng 17. Chu kì 3 vì có 3 lớp electron. Nhóm VII A vì cấu hình electron hóa trị là 3s23p5. |
0.5 |
|||||||||||
|
3 |
Trong đồng vị số khối lớn số hạt mang điện là 17.2 = 34 hạt số nơtron (hạt không mang điện) là 34:1,7 = 20 hạt. số nơtron trong đồng vị số khối nhỏ là 18 hạt. Vậy thành phần cấu tạo các đồng vị của X là: Đồng vị số khối nhỏ: 17 electron, 17 proton, 18 nơtron. Đồng vị số khối lớn: 17 electron, 17 proton, 20 nơtron |
0.5 |
|||||||||||
|
4 |
Chọn số mol của HClOx = 1 mol => nCl = 1 mol => số mol nguyên tử 35Cl = 0,75 mol. Theo bài ta có: %m 35Cl = = 0,2612 ……………………………. => x= 4. CTPT hợp chất là : HClO4 |
0.25
0.25 |
|||||||||||
|
2 |
1 |
Vì R tạo được hợp chất khí với H nên R là phi kim. Giả sử R thuộc nhóm x (x4). Theo giả thiết công thức của R với H là RH8-xa=.100 công thức oxit cao nhất của R là R2Ox b = suy ra Xét bảng
Vậy X là Lưu huỳnh (S) |
0.5
0.5
0.5 |
||||||||||
|
2 |
Công thức hợp chất khí với hiđro là H2S, số oxi hóa của S là -2. Công thức oxit cao nhất là SO3, số oxi hóa của S là +6. |
0.5 |
|||||||||||
|
3 |
1 |
Viết được công thức electron và CTCT của Cl2 Viết được công thức electron và CTCT của HCl |
0.5 0.5 |
||||||||||
|
2 |
Phân tử HCl: Hiệu độ âm điện = 3,16 – 2,20 = 0,96 liên kết CHT phân cực Phân tử NaCl: Hiệu độ âm điện = 3,16 – 0,93 = 2,23 liên kết ion |
0.25 0.25 0.25 0.25 |
|||||||||||
|
4 |
|
Chọn được chất, viết phương trình và cân bằng: 1,0 điểm/ chất Ví dụ: 1. 2Fe3O4 + 10H2SO43 Fe2(SO4)3 + SO2 + 10H2O 2x\[\left| {} \right.\] 2Fe+8/3 2Fe+3 + 1e 1x \[\left| {} \right.\] S+6+ 2e S+4
2. 2FeO + 4H2SO4 Fe2(SO4)3 + SO2 + 4H2O 2x\[\left| {} \right.\] Fe+2 Fe+3 + 1e 1x \[\left| {} \right.\] S+6+ 2e S+4
|
1,0
1,0 |
||||||||||
|
5 |
1 |
1. HCl + NaOH NaCl + H2O 2. 2NaCl + 2H2O 2NaOH + Cl2 + H2 3. Cl2 + 2NaOH NaCl + NaClO + H2O 4. CO2 + NaClO NaHCO3 + HClO |
0,25×4 |
||||||||||
|
2a |
Hiện tượng: Xuất hiện kết tủa đen CuCl2 + H2S → CuS + 2HCl |
0.25×2 |
|||||||||||
|
2b |
Dung dịch bị mất màu tím: 5SO2 + 2KMnO4+ 2H2O → K2SO4 + 2MnSO4 + 2H2SO4 |
0.25×2 |
|||||||||||
|
6 |
|
A là khí H2S: H2S + Pb(NO3)2→ PbS + 2HNO3 ……………………………………. B là khí SO2 Br2 + SO2 + 2H2O → 2HBr + H2SO4 ………………………………………. C là khí O3, E là khí O2 D là khí HCl, G là khí Cl2 ……………………………………. Cl2 + 2Na → 2NaCl 2HCl + 2Na → 2NaCl + H2 |
0.5
0,5
0,5
0,5 |
||||||||||
|
7 |
1 |
– Trích các mẫu thử. – Cho giấy quỳ tím lần lượt vào các mẫu thử: + Có 2 mẫu thử làm quỳ tím hóa đỏ là HCl và HNO3 (nhóm 1). + Có 1 mẫu thử làm quỳ tím hóa xanh là NaOH. + Có 1 mẫu thử không có hiện tượng gì là KNO3. – Cho dung dịch AgNO3 vào 2 mẫu thử của nhóm (1), mẫu thử nào xuất hiện kết tủa màu trắng là HCl, mẫu thử không có hiện tượng gì là HNO3. HCl + AgNO3 → AgCl + NaNO3 |
0.5
0.25 0.25 |
||||||||||
|
2 |
Điều chế được mỗi chất cho 0,25 điểm * Điều chế O2 : 2KClO3→ 2KCl + 3O2 * Điều chế Cl2 KClO3 + 6HCl → KCl + 3Cl2+ 3H2O * Điều chế H2S: FeS + 2HCl → FeCl2 + H2S * Điều chế SO2 : 4FeS + 7O2 → 2Fe2O3 + 4SO2 |
1.0 |
|||||||||||
|
8 |
1a |
Sơ đồ phản ứng: Al, Mg + HCl → AlCl3, MgCl2 + H2 Số mol H2 thu được = Đặt x là số mol Mg Đặt y là số mol Al Ta có : Viết PTHH hoặc sử dụng bảo toàn electron: 2 Giải hệ ta được x = 0,06 và y = 0,09 mMg = 0,06. 24 = 1,44 gam mAl = 0,09.27= 2,43 gam |
0,25
0.25 |
||||||||||
|
1b |
nHCl = 0,39 mol mHCl = 14,235 gam mddHCl = 195 gam d = 1,2 g/ml Dung dịch B gồm: MgCl2 0,06 mol và AlCl3 0,09 mol mddB = mddHCl + mKL – mH2 = 198,48 gam C% MgCl2 = \(\frac{{0,06.95}}{{198,48}}.100\% \) = 2,87% C% AlCl3 = \(\frac{{0,09.133,5}}{{198,48}}.100\% \) = 6,05% |
0.25
0.25 |
|||||||||||
|
2 |
Số mol Fe = 14/56 = 0,25 mol Gọi m (g) là khối lượng dung dịch H2SO4 Số mol H2SO4 = = 0,0025m mol Fe + H2SO4 → FeSO4 + H2 0,25 mol 0,25 mol 0,25 mol 0,25 mol → 0,0025m = 0,25 → m = 100 gam Khối lượng dung dịch sau pư = 100 + 14 – 2.0,25 = 113,5 gam Đặt công thức tinh thể tách ra là: FeSO4 .xH2O → số mol FeSO4 tách ra = mol Khối lượng dung dịch còn lại = 113,5 – 55,53 = 57,97 gam Khối lượng FeSO4 còn lại trong dung dịch = % FeSO4 = ().100/57,97 = 13,18 x = 7. Vậy công thức tinh thể ngậm nước là: FeSO4.7H2O |
0.25
0.25
0.25 0.25 |
|||||||||||
|
9 |
1 |
Ta có: nFe = 0,25 mol Bảo toàn khối lượng → mO2 = 3,2 gam → nO2 = 0,1 mol. Gọi số mol SO2 là x mol. \(\mathop {{\rm{Fe}}}\limits^{\rm{0}} \to \mathop {{\rm{Fe}}}\limits^{ + {\rm{3}}} + {\rm{3e}}\) 0,25 0,75 \({\mathop {\rm{O}}\limits^{\rm{0}} _{\rm{2}}} + {\rm{4e}} \to {\rm{2}}\mathop {\rm{O}}\limits^{{\rm{ – 2}}} \) 0,1 0,4 \(\mathop {\rm{S}}\limits^{ + {\rm{6}}} + {\rm{2e}} \to \mathop {\rm{S}}\limits^{ + {\rm{4}}} \) 2x x Bảo toàn electron cho cả quá trình: → 0,75 = 0,4 + 2x → x = 0,175 → V = 3,92 lít |
0.25
0.25
0.25
0.25 |
||||||||||
|
2a |
Các PTHH: H2SO4.nSO3 + nH2O → (n+1) H2SO4 H2SO4 + 2NaOH → Na2SO4 + 2H2O nNaOH = 0,5 mol → nH2SO4 = 0,25 mol → noleum ban đầu =.2 = moleum = .(98 + 80n) = 41,8 -> n = 4 Công thức oleum là H2SO4.4SO3 |
|
|||||||||||
|
2b |
Công thức oleum mới là H2SO4.3SO3 noleum mới = 0,3 mol -> nS = 0,3.4 = 1,2 mol Gọi số mol oleum X (H2SO4.4SO3)cần lấy là x mol Bảo toàn nguyên tố S ta có: 5x = 1,2 -> x = 0,24 mol mX cần lấy= 0,24.418 = 100,32 gam mH2O cần lấy = 101,4 – 100,32 = 1,08 gam |
|
|||||||||||
|
10 |
1 |
(1) Đèn cồn; (2) Ống nghiệm; (3) Giá đỡ. |
0,5 |
||||||||||
|
2 |
X có thể là: KNO3, KMnO4. |
0,5 |
|||||||||||
|
3 |
Giải thích: |
0,5
0,5 |
Lưu ý: – Thí sinh làm cách khác đúng vẫn cho điểm tối đa.
– PTHH thiếu điều kiện hoặc không cân bằng thì trừ ½ số điểm.
Xem thêm