Giải bài tập Chuyên đề Hóa học 10 Bài 2: Phản ứng hạt nhân
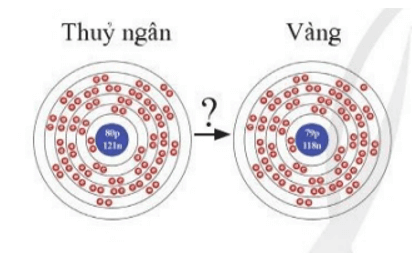
Mở đầu trang 15 Chuyên đề học tập Hóa học 10: Sự phát triển của hóa học thời cổ và trung đại có sự đóng góp quan trọng của các nhà gia kim thuật, những người có ước mơ biến thủy ngân (Hg, Z = 80) thành vàng (Au, Z = 79). Tất nhiên họ không thể thành công. Tuy nhiên ngày nay điều này đã trở thành sự thật nhờ sự biến đổi hạt nhân nguyên tử. Sự biến đổi hạt nhân nào sau đây mô tả quá trình này?
A. Loại đi một proton từ hạt nhân Hg.
B. Thêm một proton vào hạt nhân Hg.
Lời giải:
Một nguyên tử nguyên tố thủy ngân (Hg, Z = 80) có 80 proton trong hạt nhân.
Một nguyên tử nguyên tố vàng (Au, Z = 79) có 79 proton trong hạt nhân.
Sự biến đổi hạt nhân bằng cách loại đi một proton từ hạt nhân Hg đã biến được thủy ngân thành vàng.
I. Phóng xạ tự nhiên và phóng xạ nhân tạo
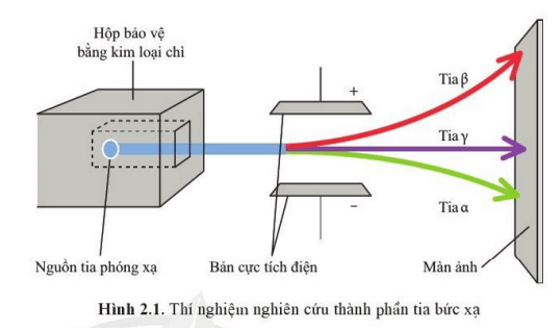
Câu hỏi 1 trang 16 Chuyên đề học tập Hóa học 10: Qua thí nghiệm nghiên cứu thành phần tia bức xạ từ phóng xạ tự nhiên (Hình 2.1), hãy cho biết các dòng hạt α, β, γ mang điện tích dương, âm hay không mang điện.
Lời giải:
Dòng hạt α (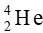 ) mang điện tích dương
) mang điện tích dương
Dòng hạt β (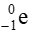 ) mang điện tích âm
) mang điện tích âm
Dòng hạt γ không nang điện
Luyện tập trang 16 Chuyên đề học tập Hóa học 10: Vì sao hạt α có giá trị điện tích lớn gấp đôi hạt β nhưng lại bị lệch ít hơn trong cùng một trường điện?
Lời giải:
Tia α bản chất là các hạt nhân của nguyên tử 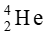 có khối lượng lớn hơn nhiều so với tia β có bản chất là các electron. Nên dù điện tích có lớn hơn thì gia tốc của hạt là
có khối lượng lớn hơn nhiều so với tia β có bản chất là các electron. Nên dù điện tích có lớn hơn thì gia tốc của hạt là
của tia β cũng lớn hơn so với tia α nên trong điện trường nó bị lệch nhiều hơn.
Câu hỏi 2 trang 16 Chuyên đề học tập Hóa học 10: Vì sao tia γ không bị lệch trong trường điện?
Lời giải:
Tia γ không bị lệch trong trường điện vì tia γ không mang điện tích.
Câu hỏi 3 trang 16 Chuyên đề học tập Hóa học 10: Nhận xét về tổng số khối và tổng điện tích trước và sau phản ứng.
Lời giải:
Tổng số khối và tổng điện tích trước và sau phản ứng không thay đổi.
Câu hỏi 4 trang 17 Chuyên đề học tập Hóa học 10: Nêu sự giống và khác nhau giữa phóng xạ tự nhiên và phóng xạ nhân tạo.
Lời giải:
– Giống nhau: Đều là quá trình biến đổi hạt nhân nguyên tử đồng thời phát ra các tia bức xạ
– Khác nhau:
+ Phóng xạ tự nhiên: Là quá trình tự phát, không phụ thuộc vào tác động bên ngoài.
Sơ đồ tổng quát:
Hạt nhân mẹ → Hạt nhân con + Tia bức xạ
+ Phóng xạ nhân tạo: Là quá trình không tự phát, gây ra bởi tác động bên ngoài lên hạt nhân.
Sơ đồ tổng quát:
Tia bức xạ 1 + Hạt nhân 1 → [Hạt nhân trung gian] → Hạt nhân 2 + Tia bức xạ 2
II. Phản ứng hạt nhân và các định luật bảo toàn số khối và điện tích
-
Câu hỏi 5 trang 17 Chuyên đề học tập Hóa học 10: Cho phản ứng hóa học C + O2 → CO2
Phản ứng hóa học trên khác các phản ứng phóng xạ tự nhiên và nhân tạo ở điểm nào?
Lời giải:
– Phản ứng hóa học trên chỉ có sự biến đổi electron lớp vỏ của các nguyên tử nguyên tố.
Cụ thể:
Nguyên tử C nhường 4 electron, mỗi nguyên tử O nhận 2 electron.
– Các phản ứng phóng xạ tự nhiên và nhân tạo là sự biến đổi các proton trong hạt nhân nguyên tử
-
Câu hỏi 6 trang 18 Chuyên đề học tập Hóa học 10: Cho phản ứng hạt nhân sau:
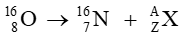
Xác định số khối, điện tích và tên gọi của hạt nhân 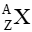
Lời giải:
Theo định luật bảo toàn số khối: 16 = 16 + A
⇒ A = 0
Theo định luật bảo toàn điện tích: 8 = 7 + Z
⇒ Z = 1
Vậy hạt nhân cần tìm có tên gọi là H (hydrogen) số khối A = 0, điện tích hạt nhân Z = 1
-
III. Ứng dụng của phản ứng hạt nhân
-
Vận dụng trang 19 Chuyên đề học tập Hóa học 10: 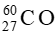 được dùng trong phương pháp xạ trị dựa theo phản ứng sau đây:
được dùng trong phương pháp xạ trị dựa theo phản ứng sau đây:
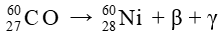
Do nguồn bức xạ đặt ngoài cơ thể bệnh nhân nên tia xạ trị cần phải có khả năng đâm xuyên (khả năng đi xuyên qua lớp vật chất) lớn. Dựa vào bản chất của tia γ và β, em hãy dự đoán tác dụng xạ trị chính của 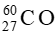 khi đặt ngoài cơ thể bệnh nhân gây ra bởi tia γ hay β?
khi đặt ngoài cơ thể bệnh nhân gây ra bởi tia γ hay β?
Lời giải:
Tia γ có khả năng đâm xuyên lớn hơn tia β
⇒ Tác dụng xạ trị chính của 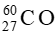 khi đặt ngoài cơ thể bệnh nhân gây ra bởi tia γ
khi đặt ngoài cơ thể bệnh nhân gây ra bởi tia γ
-
Bài tập (trang 21)
-
Bài tập 1 trang 21 Chuyên đề học tập Hóa học 10: Xác định số khối và điện tích của hạt nhân X trong các quá trình sau:
a) 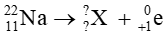
b) 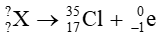
c) 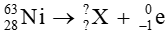
d) 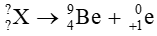
(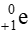 là hạt positron, còn được kí hiệu là β+)
là hạt positron, còn được kí hiệu là β+)
Lời giải:
a) 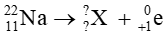
Giả sử X có 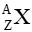
Theo định luật bảo toàn số khối: 22 = A + 0
⇒ A = 22
Theo định luật bảo toàn điện tích: 11 = Z + (+1)
⇒ Z = 10
Vậy hạt nhân X có số khối A = 22, điện tích hạt nhân Z = 10
b) 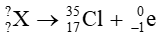
Giả sử X có 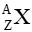
Theo định luật bảo toàn số khối: A = 35 + 0
⇒ A = 35
Theo định luật bảo toàn điện tích: Z = 17 + (-1)
⇒ Z = 16
Vậy hạt nhân X có số khối A = 35, điện tích hạt nhân Z = 16
c) 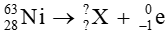
Giả sử X có 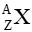
Theo định luật bảo toàn số khối: 63 = A + 0
⇒ A = 63
Theo định luật bảo toàn điện tích: 28 = Z + (-1)
⇒ Z = 29
Vậy hạt nhân X có số khối A = 63, điện tích hạt nhân Z = 29
d) 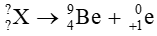
Giả sử X có 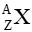
Theo định luật bảo toàn số khối: A = 9 + 0
⇒ A = 9
Theo định luật bảo toàn điện tích: Z = 4 + (+1)
⇒ Z = 5
Vậy hạt nhân X có số khối A = 9, điện tích hạt nhân Z = 5
-
Bài tập 2 trang 21 Chuyên đề học tập Hóa học 10: Phân rã tự nhiên 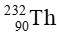 tạo ra đồng vị bền
tạo ra đồng vị bền 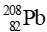 , đồng thời giải phóng một số hạt α và β. Xác định số hạt α và β cho quá trình phân rã một hạt nhân
, đồng thời giải phóng một số hạt α và β. Xác định số hạt α và β cho quá trình phân rã một hạt nhân 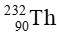 .
.
Lời giải:
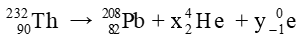
Theo định luật bảo toàn số khối: 232 = 208 + 4x + 0y (1)
Theo định luật bảo toàn điện tích: 90 = 82 + 2x + (-1)y (2)
Giải hệ hai phương trình (1) và (2) ta tìm được: x = 6, y = 4.
Vậy quá trình phân rã một hạt nhân 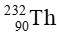 giải phóng ra 6 hạt α và 4 hạt β.
giải phóng ra 6 hạt α và 4 hạt β.
-
Bài tập 3 trang 21 Chuyên đề học tập Hóa học 10: Cần đốt cháy bao nhiêu kg than đá chứa 80% C để tạo ra lượng nhiệt bằng năng lượng giải phóng ra khi 1 gam 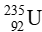 phân hạch. Biết khi phân hạch 1 mol
phân hạch. Biết khi phân hạch 1 mol 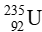 tỏa ra năng lượng là 1,8.1010 kJ, đốt cháy hoàn toàn 1 mol C tỏa ra năng lượng 393,5 kJ.
tỏa ra năng lượng là 1,8.1010 kJ, đốt cháy hoàn toàn 1 mol C tỏa ra năng lượng 393,5 kJ.
Lời giải:
1 mol 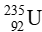 tương ứng với 1.235 = 235 gam
tương ứng với 1.235 = 235 gam
Khi phân hạch 235 gam 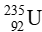 tỏa ra năng lượng là 1,8.1010 kJ
tỏa ra năng lượng là 1,8.1010 kJ
Khi phân hạch1 gam 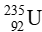 tỏa ra năng lượng là kJ
tỏa ra năng lượng là kJ
Đốt cháy hoàn toàn 1 mol C tỏa ra năng lượng 393,5 kJ.
⇒ Đốt cháy hoàn toàn x mol C tỏa ra được năng lượng kJ
⇒ x = mol
⇒ Khối lượng C cần dùng là .12 (gam)
⇒ Khối lượng than đá cần dùng là: .12 ≈ 2,92.106 gam ≈ 2920 kg
-
Bài tập 4* trang 21 Chuyên đề học tập Hóa học 10: Một mảnh giấy lấy được từ một trong các “Cuộn sách Biển Chết” (gồm 981 bản ghi khác nhau được phát hiện tại 12 hang động ở phía đông hoang mạc Judaea), được xác định có 10,8 nguyên tử 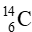 bị phân rã trong 1 phút ứng với 1 gam carbon trong mảnh giấy (Hình 2.3).
bị phân rã trong 1 phút ứng với 1 gam carbon trong mảnh giấy (Hình 2.3).
Hãy tính tuổi của mảnh giấy (t) dựa theo phương trình:
Trong đó:
A0 được coi bằng số nguyên tử 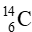 bị phân rã trong 1 phút với 1 gam carbon trong sinh vật sống, A0 = 13,6
bị phân rã trong 1 phút với 1 gam carbon trong sinh vật sống, A0 = 13,6
At được coi bằng số nguyên tử 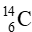 bị phân rã trong 1 phút với 1 gam carbon trong mẫu vật nghiên cứu.
bị phân rã trong 1 phút với 1 gam carbon trong mẫu vật nghiên cứu.
Hằng số k = 1,21 × 10-4 năm-1

Lời giải:
Tuổi của mảnh giấy = ≈ 1905 năm
) mang điện tích dương
) mang điện tích âm
có khối lượng lớn hơn nhiều so với tia β có bản chất là các electron. Nên dù điện tích có lớn hơn thì gia tốc của hạt là