Giải SBT Hóa học 11 Bài 35: Benzen và đồng đẳng. Một số hidrocacbon thơm khác
Bài 35.1 trang 53 SBT Hóa học 11: Chất
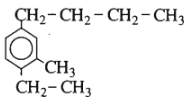 có tên là gì ?
có tên là gì ?
A. 1-butyl-3-metyl-4-etylbenzen.
B. 1-butyl-4-etyl-3-metylbenzen.
C. 1-etyl-2-metyl-4-butylbenzen.
D. 4-butyl-1-etyl-2-metylbenzen.
Lời giải:
Hợp chất trên có tên là: 4-butyl-1-etyl-2-metylbenzen
Chọn D.
Bài 35.2 trang 53 SBT Hóa học 11: Chất
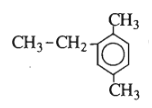 có tên là gì ?
có tên là gì ?
A. 1,4-đimetyl-6-etylbenzen.
B. 1,4-đimety1-2-etylbenzen.
C. 2-etyl-1,4-đimetylbenzen.
D. 1-etyl-2,5-đimetylbenzen.
Lời giải:
Hợp chất trên có tên là: 2-etyl-1,4-đimetylbenzen
Chọn C.
Bài 35.3 trang 53 SBT Hóa học 11: Stiren có công thức phân tử C8H8 và có công thức cấu tạo : C6H5-CH=CH2. Nhận xét nào cho dưới đây đúng ?
A. Stiren là đồng đẳng của benzen.
B. Stiren là đồng đẳng của etilen.
C. Stiren là hiđrocacbon thơm.
D. Stiren là hiđrocacbon không no.
Lời giải:
Stiren là hiđrocacbon thơm
Chọn C.
Bài 35.4 trang 53 SBT Hóa học 11: m-xilen có công thức cấu tạo là ?
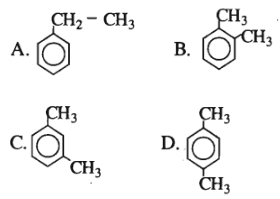 .
.
Lời giải:
m – xilen có công thức là
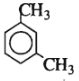
Chọn C.
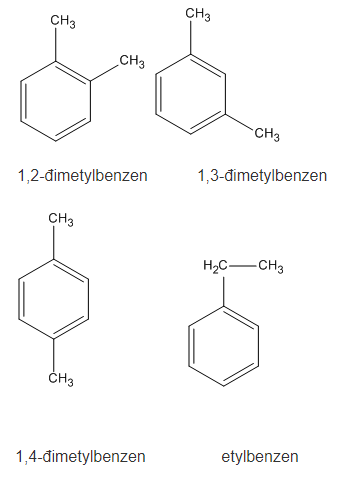
Bài 35.5 trang 53 SBT Hóa học 11: Có bao nhiêu chất đồng đẳng của benzen có cùng công thức phân tử C9H12
A. 6 chất B. 7 chất
C. 8 chất D. 9 chất
Lời giải:
8 chất gồm: 2 chất C6H5C3H7; 3 chất C2H5-C6H4-CH3 và 3 chất C6H3(CH3)3
Chọn C.
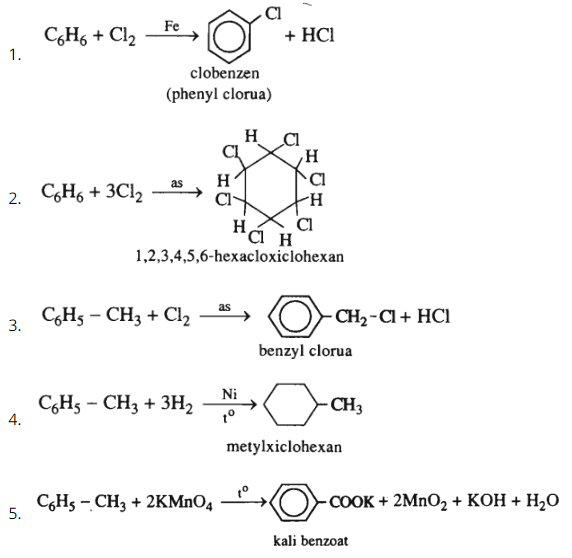
Bài 35.6 trang 54 SBT Hóa học 11: Hoàn thành các phương trình hoá học dưới đây. Viết các chất sản phẩm hữu cơ ở dạng công thức cấu tạo và kèm theo tên.
1.
2.
3.
4. (dư)
5. (dd)
Lời giải:
Bài 35.7 trang 54 SBT Hóa học 11: Benzen không tác dụng với dung dịch Br2 và dung dịch KMnO4 nhưng stiren thì có phản ứng với cả hai dung dịch đó.
1. Giải thích vì sao stiren có khả năng phản ứng đó.
2. Viết phương trình hoá học biểu diễn các phản ứng đó.
Lời giải:
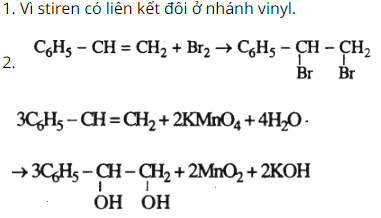
Bài 35.8 trang 54 SBT Hóa học 11: Chất A là một đồng đẳng của benzen. Để đốt cháy hoàn toàn 13,25 g chất A cần dùng vừa hết 29,40 lít O2 (đktc).
1. Xác định công thức phân tử chất A.
2. Viết các công thức cấu tạo có thể có của chất A. Ghi tên ứng với mỗi công thức cấu tạo đó.
Phương pháp giải:
1. +) Viết PTHH:
+) Tính theo PTHH, lập phương trình n CTPT của chất.
2. Học sinh viết CTCT
Lời giải:
1.
Theo phương trình: Cứ (14n – 6)g A tác dụng với mol
Theo đầu bài: Cứ 13,25g A tác dụng với = 1,3125 mol
Ta có CTPT:
2. Các công thức cấu tạo
Bài 35.9 trang 54 SBT Hóa học 11: Khi đốt cháy hoàn toàn hiđrocacbon A, thu được khí CO2 và hơi nước theo tỉ lệ 77 : 18 về khối lượng. Nếu làm bay hơi hết 5,06 gam A thì thể tích hơi thu được đúng bằng thể tích của 1,76 g O2 ở cùng nhiệt độ và áp suất.
1. Xác định công thức phân tử của chất A.
2. Chất A không tác dụng với nước brom nhưng tác dụng được với dung dịch KMn04 khi đun nóng. Viết công thức cấu tạo và tên chất A.
Phương pháp giải:
1. +) Viết PTHH:
+) Dựa vào dữ kiện: “khí CO2 và hơi nước theo tỉ lệ 77 : 18 về khối lượng” => x, y => CTPT
2. Học sinh viết CTCT của chất
Lời giải:
1.
Theo đầu bài ta có :
= 92 (g/mol) tức là 12x + y = 92,0 x = 7 ; y = 8
Công thức phân tử chất A là .
2. 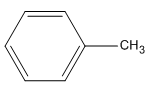
metylbenzen (toluen)
Bài 35.10 trang 55 SBT Hóa học 11: Hỗn hợp M ở thể lỏng, chứa hai hiđrocacbon kế tiếp nhau trong một dãy đồng đẳng. Đốt cháy hoàn toàn 2,62 g M, thu được 8,8 g CO2. Nếu làm bay hơi hết 6,55 gam M thì thể tích hơi thu được đúng bằng thể tích của 2,4 g khí oxi ở cùng điều kiện.
Xác định công thức phân tử và phần trăm (về khối lượng) của từng chất trong hỗn hợp M.
Phương pháp giải:
+) Tính số mol 2 chất trong 2,62 gam M
+) Giả sử trong 2,62 g M có a mol CxHy và b mol Cx+1 Hy+2
+) Viết PTHH:
+) Khai thác dữ kiện đề bài => x, y, a, b
=> công thức phân tử và phần trăm (về khối lượng) của từng chất trong hỗn hợp M.
Lời giải:
Số mol 2 chất trong 6,55 g M là : = 0,075 (mol).
Số mol 2 chất trong 2,62 g M là : = 0,03 (mol).
Giả sử trong 2,62 g M có a mol CxHy và b mol Cx+1 Hy+2
a mol xa mol
b mol (x + 1)b mol
Từ (3), ta có x(a + b) + b = 0,2
b = 0,2 – 0,03x
Vì 0 < b < 0,03 nên 0 < 0,2 – 0,03x < 0,03.
5,67 < x < 6,67 x = 6 .
b = 0,2 – 0,03.6 = 0,02; a = 0,03 – 0,02 = 0,01
Thay giá trị của a và b vào (2), tìm được y = 6.
Khối lượng C6H6 chiếm . 100% = 29,8%.
Khối lượng C7H8 chiếm 100 – 29,8% = 70,2%.
Bài 35.11 trang 55 SBT Hóa học 11: Cho 23 kg toluen tác dụng với hỗn hợp gồm 88 kg axit nitric 66% và 74 kg axit sunfuric 96%. Giả sử toluen được chuyển hoá hoàn toàn thành trinitrotoluen và sản phẩm này được tách hết khỏi hỗn hợp axit còn dư. Tính :
1. Khối lượng trinitrotuluen thu được.
2. Khối lượng hỗn hợp axit còn dư và nồng độ phần trăm của từng axit trong hỗn hợp đó.
Phương pháp giải:
1. Tính theo PTHH
2. Sử dụng công thức:
Lời giải:
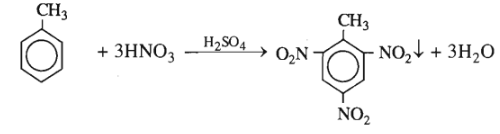
1. Số mol TNT = số mol toluen = = 250 (mol).
Khối lượng TNT = (kg).
2. Khối lượng hỗn hợp axit còn lại sau phản ứng :
23 + 88 + 74 – = (kg)
Khối lượng trong đó : (kg).
C% của là : . 100% = 8,4%.
Khối lượng là : = 71 (kg).
C% của là :
Bài 35.12 trang 55 SBT Hóa học 11: Có thể điều chế toluen bằng phản ứng đehiđro hoá – đóng vòng đối với heptan ở 500°C, 30 – 40 atm, chất xúc tác /.
1. Viết phương trình hoá học của phản ứng (các chất hữu cơ viết bằng công thức cấu tạo).
2. Tính khối lượng toluen thu được nếu phản ứng tạo ra 336 lít H2 (đktc).
Phương pháp giải:
1. Học sinh viết PTHH
2. Tính theo PTHH => số mol toluen theo số mol H2 => Khối lượng toluen thu được.
Lời giải:
1.
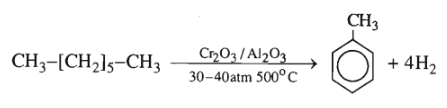
2. Số mol toluen = số mol = 3,75 (mol).
Khối lượng toluen là : 3,75.92 = 345 (g).