Giải bài tập Hóa Học lớp 11 Bài 15: Cacbon
Câu hỏi và bài tập (trang 70 sgk Hóa học 11)
Bài 1 trang 70 sgk hóa học 11: Tại sao hầu hết các hợp chất của cacbon lại là hợp chất cộng hóa trị ?
Lời giải:
Vì nguyên tử cacbon có 4e ở lớp ngoài cùng (2s22p2), độ âm điện trung bình nên rất khó cho hoặc nhận electron mà chủ yếu liên kết được tạo thành từ việc dùng chung các electron với nguyên tử của các nguyên tố khác.
Bài 2 trang 70 sgk hóa học 11: Tính oxi hóa của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
1. C + O2 → CO2
2. C + 2CuO → 2Cu + CO2
3. 3C + 4 Al → Al4C3
4. C + H2O → CO + H2
Lời giải:
1. C có số oxi hóa từ 0 lên +4 => C là chất khử
2. C có số oxi hóa từ 0 lên +4 => C là chất khử
3. C từ số oxi hóa 0 xuống -4 => C là chất oxi hóa
4. C từ số oxi hóa 0 lên +2 => C là chất khử
Đáp án C
Bài 3 trang 70 sgk hóa học 11: Tính khử của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
A. 2C + Ca → CaC2
B. C + 2H2 → CH4
C. C + CO2 → 2CO
D. 3C + 4Al → Al4C3
Lời giải:
A. C có số oxi hóa từ 0 giảm xuống -1 =>C là chất oxi hóa
B. C có số oxi hóa từ 0 giảm xuống – 4 => C là chất oxi hóa
C. C có số oxi hóa từ 0 tăng lên + 2 => C là chất khử
D. C có số oxi hóa từ 0 xuống -4 => C là chất oxi hóa
Đáp án C
Bài 4 trang 70 sgk hóa học 11: Lập phương trình hóa học của các phản ứng sau đây:
a) H2SO4(đặc) + C SO2 + CO2 + ?
b) HNO3(đặc) + C NO2 + CO2 + ?
c) CaO + C CaC2 + CO
d) SiO2+ C Si + CO
Phương pháp giải:
Đây đều là các phản ứng oxi hóa khử => ta dùng phương pháp cân bằng electron để cân bằng các phương trình trên
Lời giải:
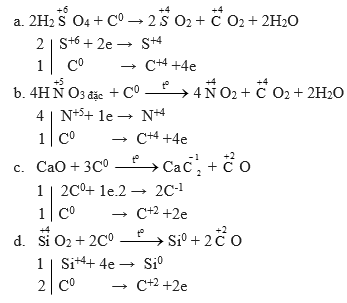
Bài 5 trang 70 sgk hóa học 11: Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 0,600kg trong oxi dư, thu được 1,06 m3 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.
Phương pháp giải:
Viết PTHH, tính toán theo PTHH
Lời giải:
C + O2 CO2
Theo PTHH 1,00mol 1,00mol
Theo Đề Bài 47,3 mol = 47,3 (mol)
Phần trăm khối lượng của C trong mẫu than đá:
Lý thuyết cacbon
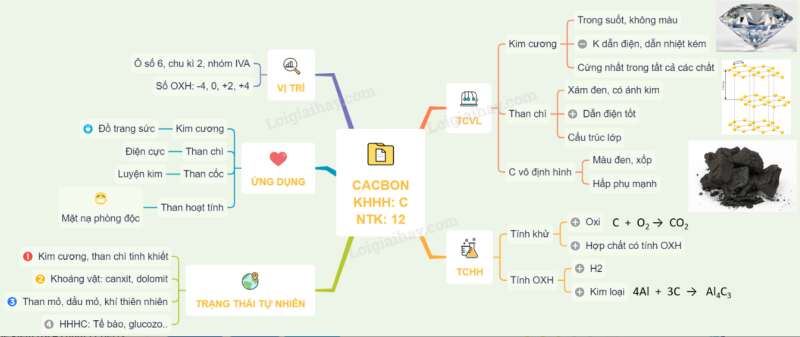
I. VỊ TRÍ, CẤU HÌNH ELECTRON
– Trong bảng tuần hoàn cacbon ở ô thứ 6, nhóm IVA, chu kì 2.
– Cấu hình electron : 1s22s22p2
– Các số oxi hóa của C là: -4, 0, +2, +4.
II. TÍNH CHẤT VẬT LÍ
– C có ba dạng thù hình chính: Kim cương, than chì và cacbon vô định hình.
– Kim cương là chất tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém. Kim cương có cấu trúc tinh thể nguyên tử và cứng nhất trong tất cả các chất.
– Than chì là tinh thể màu xám đen, có ánh kim, dẫn điện tốt nhưng kém kim loại. Tinh thể than chì có cấu trúc lớp.
– Cacbon vô định hình xốp, có khả năng hấp phụ mạnh
III. TÍNH CHẤT HÓA HỌC
Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
1. Tính khử
– Tác dụng với oxi:
C + O2 CO2
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
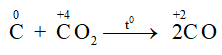
– Tác dụng với hợp chất:
C + 2H2SO4 (đặc) CO2 + 2SO2 + 2H2O
2. Tính OXH
– Tác dụng với hidro:
C + 2H2 CH4
– Tác dụng với KL:
Ca + 2C CaC2
4Al + 3C Al4C3
IV. ỨNG DỤNG
– Kim cương được dùng để đồ trang sức, chế tạo mũi khoan, dao cắt thủy tinh, bột mài,…
– Than chỉ được dùng làm các điện cực, làm nồi để nấu chảy các hợp kim chịu nhiệt, chế tạo chất bôi trơn, bút chì đen,…
– Than cốc được dùng làm chất khử trong luyện kim. Than gỗ dùng để chế tạo thuốc nổ đen, thuốc pháo,…
– Than hoạt tính có khả năng hấp phụ mạnh được dùng làm mặt nạ phòng độc và công nghiệp hóa chất,…
V. TRẠNG THÁI TỰ NHIÊN
– Kim cương và than chì là cacbon ở dạng tự do gần như tinh khiết.
– Cacbon còn có trong các khoáng vật như canxit (đá vôi, đá hoa, đá phấn đều chứa CaCO3), magiezit (MgCO3), đolomit (CaCO3.MgCO3). Dầu mỏ, khí thiên nhiên là hỗn hợp của các chất khác nhau chứa cacbon. Cơ thể động thực vật cũng chứa nhiều hợp chất của cacbon.
VI. ĐIỀU CHẾ
– Kim cương nhân tạo được điều chế bằng cách nung than chì ở 2000oC, p từ 50 – 100 nghìn atm, xúc tác là Fe, Cr, Ni.
– Than chì nhân tạo được điều chế bằng cách nung than cốc ở 2500 – 3000oC trong lò điện, không có không khí.
– Than cốc được điều chế bằng cách nung than mỡ khoảng 1000oC trong lò cốc, không có không khí.
– Than gỗ được tạo nên khi đốt cháy gỗ trong điều kiện thiếu không khí.
– Than muội được tạo nên khi nhiệt phân metan ở điều kiện nhiệt độ và xúc tác thích hợp.
– Than mỏ được khai thác trực tiếp từ các vỉa than nằm sâu dưới mặt đất.
Sơ đồ tư duy: Cacbon
Phương pháp giải một số dạng bài tập về cacbon
Dạng 1: Lý thuyết về cacbon
* Một số lưu ý cần nhớ:
– 1. Vị trí:
Trong bảng tuần hoàn cacbon ở ô thứ 6, nhóm IVA, chu kì 2. Cấu hình electron : 1s22s22p2
2. Tính chất vật lý:
Cacbon tạo thành một số dạng thù hình: kim cương, than chì, fuleren, cacbon vô định hình. Các dạng này khác nhau về tính chất vật lí do khác nhau về cấu trúc tinh thể và khả năng liên kết nên ứng dụng cũng khác nhau.
3. Tính chất hóa học:
* Tính khử:
– Tác dụng với oxi:
C + O2 CO2
– Tác dụng với hợp chất:
C + 2H2SO4 (đặc) CO2 + 2SO2 + 2H2O
* Tính OXH:
– Tác dụng với hidro:
C + 2H2 CH4
– Tác dụng với KL:
Ca + 2C CaC2
4Al + 3C Al4C3
* Một số ví dụ điển hình
Ví dụ 1: Kim cương, fuleren và than chì là các dạng:
A. đồng hình của cacbon.
B. đồng vị của cacbon.
C. thù hình của cacbon.
D. đồng phân của cacbon.
Hướng dẫn giải chi tiết:
Kim cương, fuleren và than chì là các dạng thù hình của cacbon.
Đáp án C
Câu 2: Thuốc nổ đen là hỗn hợp
A. KNO3, C và S.
B. KNO3 và S.
C. KClO3, C và S.
D. KClO3 và S.
Hướng dẫn giải chi tiết:
Thuốc nổ đen là hỗn hợp gồm KNO3, C và S.
Đáp án A
Câu 3: Cho các chất: O2 (1), CO2 (2), H2 (3), Fe2O3 (4), SiO2 (5), HCl (6), CaO (7), H2SO4 đặc (8), HNO3 (9), H2O (10), KCl (11). Cacbon phản ứng trực tiếp được với bao nhiêu chất?
A. 8
B. 9
C. 7
D. 10
Hướng dẫn giải chi tiết:
C phản ứng trực tiếp được với các chất: O2, CO2, H2, Fe2O3, H2SO4 đặc, HNO3, H2O
Đáp án C
Câu 4: Tính khử của cacbon thể hiện ở phản ứng nào trong các phản ứng sau:
A.
B.
C.
D.
Hướng dẫn giải chi tiết:
C thể hiện tính khử khi tác dụng với các chất có tính oxi hóa như : CO2; ZnO (các oxit sau Al); HNO3 (đặc); H2SO4 (đặc)
Đáp án A
Câu 5: Đốt cháy hỗn hợp lưu huỳnh và cacbon (thể tích không đáng kể) trong bình kín đựng oxi dư, thu được hỗn hợp ba khí (CO2, SO2, O2). Sau đó đưa bình về nhiệt độ ban đầu thì áp suất trong bình so với trước khi đốt sẽ thay đổi như thế nào?
A. Tăng
B. Gỉam
C. Có thể tăng hoặc giảm (phụ thuộc vào lượng S, C)
D. Không đổi
Hướng dẫn giải chi tiết:
S(rắn) + O2 SO2
C(rắn) + O2 CO2
Từ 2 phương trình trên ta thấy số mol khí của chất tham gia phản ứng và sau phản ứng bằng nhau và không phụ thuộc vào lượng C, S => do vậy áp suất của bình sẽ không thay đổi khi ta đưa về nhiệt độ ban đầu
Đáp án D
Dạng 2: Bài tập về tính chất hóa học của C
(Tác dụng với nước, kim loại, oxit kim loại, …)
* Một số lưu ý cần nhớ:
Ta có phương trình tổng quát:
nC + M2On → nCO + 2M
Trong đó M là những kim loại có mức độ hoạt động trung bình, đứng sau Al
Để làm được dạng bài tập này, ta cần áp dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố và bảo toàn electron để giải
* Một số ví dụ điển hình:
Ví dụ 1: Cho 3,60 gam cacbon tác dụng với 8,10 gam nhôm. Khối lượng nhôm cacbua tạo thành nếu hiệu suất của phản ứng 70% là
A. 5,76 gam
B. 7,56 gam
C. 10,08 gam
D. 10,80 gam
Hướng dẫn giải chi tiết:
nC = 0,3 mol; nAl = 0,3 mol
3C + 4Al Al4C3
Xét tỉ lệ : => phản ứng tính theo Al
nAl4C3 lí thuyết = nAl / 4 = 0,075 mol
H = 70% => nAl4C3 thực tế = 0,075.70/100 = 0,0525 mol => mAl4C3 = 7,56 gam
Đáp án B
Câu 2: Thể tích khí NO2 thoát ra ở đktc khi cho 0,12 gam cacbon tác dụng hết với HNO3 đặc nguội (coi phản ứng xảy ra hoàn toàn) là
A. 0,896 lít
B. 0,672 lít
C. 0,448 lít
D. 0.336 lít
Hướng dẫn giải chi tiết:
Quá trình cho – nhận e:
0,01 → 0,04 0,04 → 0,04
=> VNO2 = 0,04.22,4 = 0,896 lít
Đáp án A
Câu 3: Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2 sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A. 9,85
B. 19,7
C. 29,55
D. 15,76
Hướng dẫn giải chi tiết:
Ta thấy nC = nY – nX = 0,95 – 0,55 = 0,4 mol
Oxi hóa hoàn toàn hỗn hợp Y thì:
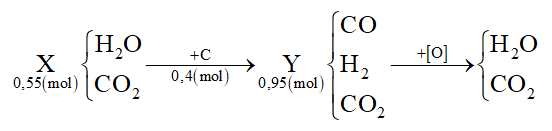
Áp dụng bảo toàn e cho toàn bộ quá trình thì: 4nC = 2nO → nO = 0,8 mol
Mà nO = ∑nCO(Y), H2(Y) = 0,8 mol ⟹ nCO2(Y) = 0,95 – 0,8 = 0,15 mol
Khi cho Y phản ứng với Ba(OH)2 tức là 0,15 mol CO2 phản ứng với 0,1 mol Ba(OH)2:
Tỉ lệ: 1 < nOH-/nCO2 = 0,2/0,15 = 1,33 < 2 → tạo CO32- (a) và HCO3– (b)
Giải hệ:
Ba2+ + CO32- → BaCO3
0,05 ← 0,05 → 0,05
→ m↓ = 0,05.197 = 9,85 gam
Đáp án A
Câu 4: Trộn 20 gam bột CuO và một lượng C rồi đem nung nóng, sau một thời gian phản ứng thấy có 3,36 lít khí thoát ra khỏi bình. Khối lượng chất rắn thu được là
A. 17,6
B. 8
C. 9,6
D. 15,6
Hướng dẫn giải chi tiết:
CuO + C Cu + CO
nCO = 3,36 / 22,4 = 0,15 mol
=> nCuO phản ứng = 0,15 mol
=> mCuO dư = 20 – 0,15.80 = 8 gam
nCu tạo thành = nCuO phản ứng = 0,15 mol
=> mCu = 0,15.64 = 9,6 gam
=> mchất rắn sau phản ứng = 8 + 9,6 = 17,6 gam
Đáp án A