Trắc nghiệm Hóa học 11 Chương 2 có đáp án: Nitơ – Photpho
Trắc nghiệm Nito và Lưu huỳnh có đáp án – Hóa học lớp 11
Bài : 1
Chiều tăng dần số oxi hoá của N trong các hợp chất của nitơ dưới đây là
Chọn một đáp án dưới đây
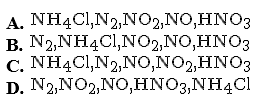
Đáp án là : (C)
Bài : 2
Trong nhóm N, khi đi từ N đến Bi, điều khẳng định nào dưới đây không đúng?
Chọn một đáp án dưới đây
A. Trong các axit, axit nitric là axit mạnh nhất
B. Khả năng oxi hoá giảm dần do độ âm điện giảm dần
C. Tính phi kim tăng dần, đồng thời tính kim loại giảm dần
D. Tính axit của các oxit giảm dần, đồng thời tính bazơ tăng dần
Đáp án là : (C)
Bài : 3
Trong nhóm N, khi đi từ N đến Bi, điều khẳng định nào dưới đây không đúng?
Chọn một đáp án dưới đây
A. Độ âm điện các nguyên tố giảm dần
B. Bán kính của nguyên tử các nguyên tố tăng dần
C. Năng lượng ion hoá của các nguyên tố giảm dần
D. Nguyên tử các nguyên tố đều có cùng số lớp electron
Đáp án là : (D)
Bài : 4
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm nitơ (VA) là cấu hình nào dưới đây?
Chọn một đáp án dưới đây
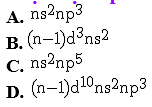
Đáp án là : (A)
Bài : 5
Nung 11,2 gam Fe và 26 gam Zn với một lượng S dư. Sản phẩm của phản ứng được hoà tan hoàn toàn trong dung dịch H2SO4 loãng, toàn bộ khí sinh ra được dẫn vào dung dịch CuSO4 10% (d = 1,2 gam/ml). Biết các phản ứng xảy ra hoàn toàn. Thể tích tối thiểu của dung dịch CuSO4 cần để hấp thụ hết khí sinh ra là
Chọn một đáp án dưới đây
A. 700 ml
B. 800 ml
C. 600 ml
D. 500 ml
Đáp án là : (B)
Bài : 6
Đốt cháy hoàn toàn 1,2 gam một muối sunfua của kim loại. Dẫn toàn bộ khí thu được sau phản ứng đi qua dung dịch nước Br2 dư, sau đó thêm tiếp dung dịch BaCl2 dư thì thu được 4,66 gam kết tủ
Chọn một đáp án dưới đây
A. Thành phần % về khối lượng của lưu huỳnh trong muối sunfua là bao nhiêu? A. 36,33%
B. 46,67%
C. 53,33%
D. 26,66%
Đáp án là : (C)
Bài : 7
Để phản ứng vừa đủ với 100ml dung dịch BaCl2 2M cần phải dùng 500ml dung dịch Na2SO4 với nồng độ bao nhiêu?
Chọn một đáp án dưới đây
A. 0,1 M
B. 0,4 M
C. 1,4 M
D. 0,2 M
Đáp án là : (B)
Bài : 8
Cho V lít SO2(đktc) tác dụng hết với dung dịch Br2 dư thu được dung dịch A. Cho dung dịch A tác dụng BaCl2 với dư thu được 2,33 gam kết tủa. Thể tích V là
Chọn một đáp án dưới đây
A. 0,112 lít
B. 1,12 lít
C. 0,224 lít
D. 2,24 lít
Đáp án là : (C)
Bài : 9
Để trung hoà 500 ml dung dịch X chứa hỗn hợp HClO 0,1M và H2SO4 0,3M cần bao nhiêu ml dung dịch hỗn hợp gồm [/ct]NaOH[/ct] 0,3M và Ba(OH)2 0,2M?
Chọn một đáp án dưới đây
A. 250ml
B. 500ml
C. 125ml
D. 750ml
Đáp án là : (B)
Bài 10
Sục từ từ 2,24 lít SO2 (đktc) vào 100 ml dung dịch NaOH 3M. Các chất có trong dung dịch sau phản ứng là
Chọn một đáp án dưới đây
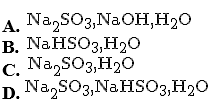
Đáp án là : (A)
Bài : 11
Cho hỗn hợp gồm Fe, FeS tác dụng với dung dịch HCl dư thu được 2,24 lít hỗn hợp khí ở điều kiện tiêu chuẩn. Hỗn hợp khí này có tỉ khối so với hiđro là 9. Thành phần % theo số mol của hỗn hợp Fe và FeS ban đầu lần lượt là
Chọn một đáp án dưới đây
A. 40% và 60%
B. 50% và 50%
C. 35% và 65%
D. 45% và 55%
Đáp án là : (B)
Bài : 12
Để thu được 6,72 lít O2(đktc), cần phải nhiệt phân hoàn toàn bao nhiêu gam tinh thể ![]() (khi có
(khi có ![]() xúc tác)?
xúc tác)?
Chọn một đáp án dưới đây
A. 21,25 gam
B. 42,50 gam
C. 63,75 gam
D. 85,00 gam
Đáp án là : (B)
Bài : 13
Xét cân bằng hoá học: ![]()
Tỉ lệ SO3 trong hỗn hợp lúc cân bằng sẽ lớn hơn khi
Chọn một đáp án dưới đây
A. tăng nhiệt độ và giảm áp suất
B. tăng nhiệt độ và áp suất không đổi
C. giảm nhiệt độ và tăng áp suất
D. cố định nhiệt độ và giảm áp suất
Đáp án là : (C)
Bài : 14
Cho phản ứng: ![]()
Cân bằng chuyển dịch sang phải nếu
Chọn một đáp án dưới đây
A. tăng nhiệt độ
B. thêm vào SO3
C. giảm áp suất
D. giảm nhiệt độ thích hợp và tăng áp suất
Đáp án là : (D
Bài :15
Để pha loãng dung dịch H2SO4 đậm đặc, trong phòng thí nghiệm, người ta tiến hành theo cách nào dưới đây?
Chọn một đáp án dưới đây
A. Cho từ từ nước vào axit và khuấy đều
B. Cho từ từ axit vào nước và khấy đều
C. Cho nhanh nước vào axit và khuấy đều
D. Cho nhanh axit vào nước và khuấy đều
Đáp án là : (B)
Bài : 16
Các khí sinh ra khi cho saccarozơ vào dung dịch H2SO4 đặc, nóng dư gồm:
Chọn một đáp án dưới đây
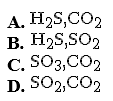
Đáp án là : (D)
Bài : 17
Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ
Chọn một đáp án dưới đây
A. có phản ứng oxi hoá – khử xảy ra
B. có kết tủa CuS tạo thành, không tan trong axit mạnh
C. axit sunfuhiđric mạnh hơn axit sunfuric
D. axit sunfuric mạnh hơn axit sunfuhiđric
Đáp án là : (B)
Bài : 18
Oxit nào dưới đây không thể hiện tính khử trong tất cả các phản ứng hoá học?
Chọn một đáp án dưới đây
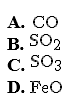
Đáp án là : (C)
Bài :19
Có hai ống nghiệm, một ống đựng dung dịch NaCl, một ống đựng dung dịch Na2SO3. Chỉ dùng một hoá chất trong số các chất sau: dung dịch HCl, dung dịch H2SO4, dung dịch BaCl2, dung dịch Ba(HCO3)2 thì số thuốc thử có thể dùng để phân biệt hai dung dịch trên là bao nhiêu?
Chọn một đáp án dưới đây
A. 1
B. 2
C. 3
D. 4
Đáp án là : (D)
Bài : 20
Chỉ dùng một thuốc thử nào dưới đây để phân biệt các lọ đựng riêng biệt khí SO2 và CO2?
Chọn một đáp án dưới đây
A. dung dịch brom trong nước
B. dung dịch NaOH
C. dung dịch BaSO4
D. dung dịch K(OH)2
Đáp án là : (A)
Trắc nghiệm Amoniac và muối amoni có đáp án – Hóa học lớp 11
Bài 1: Điều chế NH3 từ hỗn hợp hồm N2 và H2 (tỉ lệ 1 : 3) . Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9. Hiệu suất phản ứng là
A. 25%. B. 40%. C. 10%. D. 20%.
Đáp án: D
Ta có
Áp dụng định luật bảo toàn khối lượng: msau = mtrước
→ nH2 = 7,5 mol; nN2 = 2,5 mol
3H2 (3x) + N2 (x) → 2NH3 (2x mol) do H2 : N2 = 3 : 1 ⇒ Hiệu suất tính theo N2 hoặc H2
Sau phản ứng n = nH2 + nN2 + nNH3 = 7,5 – 3x + 2,5 – x + 2x = 10 – 2x = 9
→ x = 0,5 ⇒ H% = (0,5/2,5). 100% = 20%
Bài 2: Hỗn hợp X gồm NH4Cl và (NH4)2SO4. Cho X tác dụng với dung dịch Ba(OH)2 dư, đun nhẹ thu được 9,32 gam kết tủa và 2,24 lít khí thoát ra. Hỗn hợp X có khối lượng là
A. 5,28 gam. B. 6,60 gam. C. 5,35 gam. D. 6,35 gam.
Đáp án: D
NH4Cl (x mol); (NH4)2SO4 (y mol)
nBaSO4 = y = 0,04 mol
nNH3 = nNH4+ = x + 2y = 0,1 mol ⇒ x = 0,02 mol
mX = 0,02. 53,5 + 0,04. 132 = 6,35 gam
Bài 3: Cho 14,8 gam Ca(OH)2 vào 150 gam dung dịch (NH4)2SO4 26,4% rồi đun nóng thu được V lít khí (đktc). Để đốt cháy hết V lít khí trên cần vừa đủ một lượng O2. Lượng O2 trên thu được khi nung m gam KClO2 (có xúc tác). Giá trị của m là
A. 73,5. B. 49.
C. 24,5. D. 12,25.
Đáp án: Chưa biên soạn
Bài 4: Trộn 300 ml dung dịch NaNO2 2M với 200 ml dung dịch NH4Cl 2M rồi đun nóng cho đến khi phản ứng xảy ra hoàn toàn. Thể tích khí thu được ở đktc là
A. 22,4 lít. B. 13,44 lít. C. 8,96 lít. D. 1,12 lít.
Đáp án: C
nNaNO2 = 0,6 mol; nNH4Cl = 0,4 mol
NH4Cl + NaNO2 –toC→ N2 + NaCl + 2H2O
nN2 = nNH4Cl = 0,4 mol ⇒ VN2 = 8,96l
Bài 5: Cho 100 gam dung dịch NH4HSO4 11,5% vào 100 gam dung dịch Ba(OH)2 13,68% và đun nhẹ. Thể tích khí (đktc) và khối lượng kết tủa thu được là (giả sử toàn bộ khí sinh ra thoát ra khỏi dung dịch)
A. 2,24 lít và 23,3 gam B. 2,244 lít và 18,64 gam
C. 1,344 lít và 18,64 gam D. 1,792 lít và 18,64 gam.
Đáp án: C
NH4HSO4 + Ba(OH)2 → BaSO4 ↓ + NH3 ↑ + H2O
HSO4– + Ba2+ → SO42- + H2O
OH– + NH4+ → NH3 + H2O
⇒ nNH3 = 0,06 mol
⇒ V = 1,344l
Ba2+ + SO42- → BaSO4
⇒ nBaSO4 = 0,08 mol
⇒ m = 18,64g
Bài 6: X là muối khi tác dụng với dung dịch NaOH dư sinh khí mùi khai, tác dụng với dung dịch BaCl2 sinh kết tủa trắng không tan trong HNO3. X là muối nào trong số các muối sau?
A. (NH4)2CO3. B. (NH4)2SO3. C. NH4HSO3. D. (NH4)3PO4.
Đáp án: C
Bài 7: Nhận xét nào sau đây không đúng về muối amoni ?
A. Muối amoni bền với nhiệt.
B. Các muối amoni đều là chất điện li mạnh.
C. Tất cả các muối amoni đều tan trong nước.
D. các muối amoni đều bị thủy phân trong nước.
Đáp án: A
Bài 8: Oxi hóa 6 lít NH3 (tạo ra N2 và NO theo tỉ lệ mol 1 : 4) cần vừa đủ V là không khí ( chứa 20% oxi về thể tích). Các thể tích đó ở cùng điều kiện. Giá trị của V là
A. 6,5. B. 22,5. C. 32,5. D. 24,5.
Đáp án: C
12NH3 + 13O2 → 8NO + 2N2 + 18H2O
VO2 = (6 x 13) / 12 = 6,5 mol
⇒ Vkk = 6,5 : 20% = 32,5 lít
Bài 9: Cho 22,4 lít hỗn hợp khi X gồm N2 và H2 đi qua xúc tác Fe, nung nống để tổng hợp NH3 thu được 20,16 lít hỗn hợp khí Y. Hấp thụ toàn bộ Y vào dung dịch AlCl3 dư, thu được m gam kết tủa. Các thể tích khí đó ở cùng điều kiện. Giá trị của m là
A. 13. B. 2,6. C. 5,2. D. 3,9.
Đáp án: B
nX = 1 mol; nNH3 = nX – nY = 1- 0,9 = 0,1 mol
⇒ nAl(OH)3 = 0,1 /3 ⇒ m =2,6g
Bài 10: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu(trong cùng điều kiện). HIệu suất phản ứng là
A. 20%. B. 22,5%. C. 25%. D. 27%.
Đáp án: B
nH2 = 4 mol; nN2 = 1 mol ⇒ hỗn hợp khí có áp suất giảm 9%
⇒ Số mol sau phản ứng = 91%. 5 = 4,55 mol
3H2 (3x) + N2 (x) → 2NH3 (2x) do H2 : N2 = 4 : 1 ⇒ Hiệu suất tính theo N2
n hỗn hợp sau pư = nH2 dư + nN2 dư + nNH3 = 4 – 3x + 1 – x + 2x = 5 – 2x = 4,55
⇒ x = 0,225 ⇒ H% = 22,5%
Bài 11: Tính bazơ của NH3 do
A. trên N còn cặp e tự do.
B. phân tử có 3 liên kết cộng hóa trị phân cực.
C. NH3 tan được nhiều trong nước.
D. NH3 tác dụng với nước tạo NH4OH.
Đáp án: A
Bài 12: Để tách riêng NH3 ra khỏi hỗn hợp gồm N2 , H2, NH3 trong công nghiệp người ta đã
A. Cho hỗn hợp qua nước vôi trong dư.
B. Cho hỗn hợp qua bột CuO nung nóng.
C. nén và làm lạnh hỗn hợp để hòa lỏng NH3.
D. Cho hỗn hợp qua dung dịch H2SO4 đặc.
Đáp án: C
Bài 13: Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước ?
A. P2O5. B. H2SO4 đặc. C. CuO bột. D. NaOH rắn.
Đáp án: D
Bài 14: Trong các phản ứng sau, phản ứng nào NH3 đóng vai trồ là chất oxi hóa ?
A. 2NH3 + H2O2 +MnSO4 → MnO2 + (NH4)2SO4
B. 2NH3 + 3Cl2 → N2 + 6HCl
C. 4NH3 + 5O2 → 4NO + 6H2O
D. 2HN3 + 2 Na → 2NaNH2 + H2
Đáp án: D
Bài 15: Muối được làm bột nở trong thực phẩm là
A. (NH4)2CO3. B. Na2CO3. C. NH4HSO3. D. NH4Cl.
Đáp án: C
Bài 16: Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là :
A. HCl, O2, Cl2, FeCl5. B. H2SO4, Ba(OH)2, FeO, NaOH
C. HCl, HNO3, AlCl3, CaO D. KOH, HNO3, CuO, CuCl2
Đáp án: A
Trắc nghiệm Axit nitric và muối nitrat có đáp án – Hóa học lớp 11
Bài 1: Hòa tan 23,2 gam hỗn hợp X gồm Fe3O4 và CuO có cùng khối lượng vào dung dịch HNO3 vừa đủ chứa 0,77 mol HNO3 thu được bằng dung dịch Y và khí Z gồm NO và NO2. Khối lượng mol trung bình của Z bằng
A. 42. B. 38. C. 40,667. D. 35,333.
Đáp án: C
mFe3O4 = mCuO = 11,6 gam ⇒ nFe3O4 = 0,05 mol; nCuO = 0,145 mol
nNO = x mol; nNO2 = y mol
Bảo toàn e ta có: nFe3O4 = 3x + y = 0,05 (1)
Bảo toàn nguyên tố N: nHNO3 = 3nFe(NO3)3 + 2 nCu(NO3)2 + nNO + nNO2
0,77 = 3.0,15 + 2.0,145 + x + y ⇒ x + y = 0,03 mol (2)
Từ (1)(2) ⇒ x = 0,01 mol; y = 0,02 mol
Bài 2: Hòa tan hoàn toàn hỗn hợp X gồm 0,2 mol Mg và 0,03 mol MgO trong V lít dung dịch HNO3 0,5M vừa đủ thu được dung dịch Y và 0,896 lít (đktc) khi N2O duy nhất. Giá trị của V và tổng khối lượng muối thu được trong Y lần lượt là
A. 1,12 và 34,04 gam. B. 4,48 và 42,04 gam.
C. 1,12 và 34,84 gam. D. 2,24 và 34,04 gam.
Đáp án: C
nN2O = 0,04 mol
MgO + 2HNO3 → Mg(NO3)2 + H2O
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O
4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O
nHNO3 = 0,06 + 0,4 + 0,1 = 0,56 mol
V = 1,12l
mmuối = 0,23.148 + 0,01.80 = 34,84 (gam)
Bài 3: Hòa tan m gam hỗn hợp gồm FeO, Fe(OH)2,FeCO3, Fe3O4 (trong đó Fe3O4 chiếm 1/4 tổng số mol hỗn hợp) tác dụng với dung dịch HNO3 loãng dư thu được 15,68 lít hỗn hợp khí X gồm NO và CO2 (đktc) có tỉ kh so với H2 là 18 và dung dịch Y. Cô cạn dung dịch Y thu được (m + 280,80) gam muối khan. Giá trị của m là
A. 148,80. B. 173,60. C. 154,80. D. 43,20.
Đáp án: C
nNO + nCO2 = 0,7 mol.
Gọi x, y là số mol của NO và CO2, ta có:
30x + 44y = 18.2.0,7
x + y = 0,7
⇒ x = 0,4 mol; y = 0,3 mol
Coi Fe3O4 là một hỗn hợp FeO.Fe2O3, ta có:
Fe+2 → Fe+3 + 1e
N+5 + 3e → N+2
Theo bảo toàn electron ⇒ tổng số mol trong hỗn hợp chất rắn là 1,2 mol
nFe3O4 0,3 mol, nFe2+ trong dung dịch Y = 1,2 + 0,3.2 = 1,8 (mol)
⇒ m + 280,8 = 1,8.242 ⇒ m = 154,8 gam
Bài 4: Nung nóng AgNO3 được chất rắn X và khí Y. Dẫn khí Y vào cốc nước được dung dịch Z. Cho toàn bộ X vào Z thấy X tan một phần và thoát ra khí NO duy nhất. Giả thiết các phản ứng xảy ra hoàn toàn. Thành phần phần trăm khối lượng của X không tan trong Z là
A. 20%. B. 25%. C. 30%. D. 40%.
Đáp án: B
2AgNO3 (x) –toC→ 2Ag (x) + 2NO2 (x mol) + O2
dd Z: HNO3 x mol
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
Ag dư = x – 3/4x = 1/4x
⇒ %mkhông tan = 25%
Bài 5: Cho 30,6 gam hỗn hợp Cu, Fe, Zn tác dụng với dung dịch HNO3 loãng dư thu được dung dịch chứa 92,6 gam muối khan ( không chứa muối amoni ). Nung hỗn hợp muối đến khối lượng không đổi, thu được m gam rắn. Giá trị của m là
A. 38,6. B. 46,6. C. 84,6. D. 76,6.
Đáp án: A
mNO3– = 92,6 – 30,6 = 62 gam
⇒ nNO3– = 1 mol
Bảo toàn điện tích ta có: nO2- = 1/2. nNO3– = 0,5 mol
⇒ m = mKL + mO2- = 30,6 + 0,5.16 = 38,6 gam
Bài 6: Nhận định nào sau đây là sai ?
A. HNO3 phản ứng với tất cả bazơ.
B. HNO3 (loãng, đặc, nóng) phản ứng với hầu hết kim loại trừ Au, Pt.
C. Tất cả các muối amoni khi nhiệt phân đều tạo khí amoniac.
D. Hỗn hợp muối nitrat và hợp chất hữu cơ nóng chảy có thể bốc cháy.
Đáp án: C
Bài 7: Có các mệnh đề sau :
(1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh.
(2) Ion NO có tính oxi hóa trong môi trường axit.
(3) Khi nhiệt phâm muối nitrat rắn ta đều thu được khí NO2
(4) Hầu hết muối nitrat đều bền nhiệt.
Trong các mệnh đè trên, những mệnh đề đúng là
A. (1) và (3). B. (2) và (4). C. (2) và (3). D. (1) và (2).
Đáp án: D
Bài 8: Để điều chế 5 lít dung dịch HNO3 21% (D = 1,2g/ml) bằng phương pháp oxi hóa NH3 với hiệu suất toàn quá trình là 80%, thể tích khí NH3 (đktc) tối thiểu cần dùng là
A. 336 lít. B. 560 lít. C. 672 lít. D. 448 lít.
Đáp án: B
nNH3 = nHNO3 = 21%. 5. 103. 1,2 : 63 = 20 mol
H = 80% ⇒ VNH3 = 20. 22,4 : 80% = 560l
Bài 9: Cho 11,6 gam muối FeCO3 tác dụng vừa đủ với dung dịch HNO3 được hỗn hợp khí CO2, NO và dung dịch X. Khi thêm dung dịch HCl (dư) vào dung dịch X, thì dung dịch thu được hòa tan tối đa bao nhiêu bột đồng kim loại, biết rằng có khí NO bay ra?
A. 14,4 gam. B. 7,2 gam. C. 16 gam. D. 32 gam.
Đáp án: D
nFeCO3 = 0,1 mol ⇒ Fe(NO3)3 = 0,1 mol ⇒ nNO3– = 0,3 mol
3Cu + 8H+ + 2NO3– → Cu2+ + 2NO + 4H2O
nCu = 3/2. nNO3– = 0,45 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
nCu = 1/2. nFe3+ = 0,05
⇒ ∑nCu = 0,5 ⇒ mCu = 32 gam
Bài 10: Chia 20 gam hỗn hợp gồm Mg, Al, Zn thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một trong O2 dư thu được 21 gam hỗn hợp oxit. Phần hai hòa tan trong dung dịch HNO3 đặc, nóng dư thu được V (lít) NO2 (sản phẩm khử duy nhất, (đktc)). Giá trị của V là
A. 44,8. B. 89,6. C. 22.4. D. 30,8.
Đáp án: D
mKL + mO2 = moxit
⇒ mO2 = 21 – 10 = 11g
⇒ nO2 = 0,34375 mol
ne (O2)nhận = ne kim loại nhường = ne (N+5) nhận
O2 + 4e → 2O2-
N5+ + 1e → N+4
V = 1,375.22,4 = 30,8 (lít)
Bài 11:Trong phòng thí nghiệm người ta điều chế HNO3 từ
A. NH3 và O2 B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc. D. NaNO2 và HCl đặc.
Đáp án: C
Bài 12: Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa ?
A. ZnS + HNO3(đặc nóng) B. Fe2O3 + HNO3(đặc nóng)
C. FeSO4 + HNO3(loãng) D. Cu + HNO3(đặc nóng)
Đáp án: B
Bài 13: Chỉ sử dụng dung dịch HNO3 loãng, có thể nhận biết được bao nhiêu chất rắn riêng biệt sau : MgCO3, Fe3O4, CuO, Al2O3 ?
A. 1. B. 2. C. 3. D. 4.
Đáp án: D
Bài 14: HNO3 phản ứng với tất cả các chất trong nhóm nào sau đây ?
A. NH3, Al2O3, Cu2S, BaSO4.
B. Cu(OH)2, BaCO3, Au, Fe2O3.
C. CuS,Pt, SO2, Ag.
D. Fe(NO3)2, S, NH4HCO3, Mg(OH)2.
Đáp án: D
Bài 15: Khi nhiệt phân, nhóm các muối nitrat cho sản phẩm kim loại, khí NO2, O2 là
A. Cu(NO3)2 , Pb(NO3)2. B. Ca(NO3)2 , Hg(NO3)2, AgNO3.
C. Zn(NO3)2, AgNO3, LiNO3. D. Hg(NO3)2 , AgNO3.
Đáp án: D
Bài 16: Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm
A. FeO, NO2, O2. B. Fe2O3, NO2.
C. Fe, NO2, O2. D. Fe2O3, NO2 , O2.
Đáp án: D
Trắc nghiệm Photpho có đáp án – Hóa học lớp 11
Bài 1: Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phảm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32,0% tạo ra muối Na2HPO4. Gía trị của m là:
A. 25 B.50
C.75 D.100
Bài 2: Khi cho clo dư qua photpho nóng chảy, sẽ thu được sản phẩm nào sau đây:
A. PCl3 B. PCl5
C. PCl2 D. PCl
Đáp án: B
Bài 3: Photpho có mấy dạng thù hình quan trọng nhất:
A. 3 dạng: photpho đỏ, photpho trắng và photpho vàng
B. 2 dạng: photpho đỏ và photpho trắng
C. 1 dạng photpho đỏ
D. 1 dạng photpho trắng
Đáp án: B
Bài 4: Trong các nhận định sau nhận định nào đúng:
A. Mặc dù độ âm điện của photpho nhỏ hơn nitơ nhưng photpho hoạt động hóa học mạnh hơn nitơ là do liên kết trong phân tử photpho kém bền hơn trong phân tử nitơ
B. Nitơ hoạt động hóa học yếu hơn photpho là do nitơ có độ âm điện kém hơn photpho
C. Ở nhiệt độ thường Nitơ và photpho đều trơ về mặt hóa học
D. Nito có độ âm điện nhỏ hơn photpho nên hoạt động hóa học mạnh hơn
Đáp án: A
Bài 5: Hai khoáng vật chính của photpho là:
A. Apatit và hematit B. Pirit và photphorit
C. Apatit và photphorit D. Manhetit và apatit
Đáp án: C
Bài 6: trong bình kín chứa 2,24 lít khí Cl2 (đktc). Cho a gam P vào bình rồi nung nóng thu được 2 muối PCl3 và PCl5 có tỉ lệ mol 1 : 2 hạ nhiệt độ trong bình về 0oC, áp suất khí trong bình giảm còn 0,35 atm. Giá trị của a là
A. 1,55. B. 1,86. C. 0,93. D. 1,24.
Đáp án: C
P + Cl2 → PCl3 (x mol) + PCl5 (2x mol)
nCl2 dư = 0,035 mol
⇒ nCl2 p/ư = 6,5x = 0,065 mol
⇒ x = 0,01 mol
nP = 3x = 0,03 ⇒ a = 0,93 (gam)
Bài 7: Nung 1000gam loại quặng photphorit chứa Ca3(PO4)2 hàm lượng 77,5% với C và SiO2 đều lấy dư ở 1000oC. Biết hiệu suất phản ứng đạt 80%. Khối lượng P thu được là
A. 310 gam. B. 148 gam. C. 155 gam. D. 124 gam.
Đáp án: D
mCa3(PO4)2 = 77,5%. 1000 = 775 gam
Ca3(PO4)2 –C, SiO2, 1000oC→ 2P
310g → 62gam
775 gam –H = 80%→ 775. (62/310). 80% = 124 gam
Bài 8: Đốt cháy một lượng photpho (có khối lượng lớn hơn 2,48 gam) bằng oxi dư, lấy sản phẩm cho vào 75 gam dung dịch NaOH 8% rồi làm khô thu được m gam cặn khan X, trong đó có 7,1 gam Na2HPO4. Giá trị của m là
A. 13,1. B. 12,6. C. 8414,2. D. 15,6.
Đáp án: A
nH3PO4 = nP = 0,08 mol
nNaOH = 0,15 H3PO4
⇒ tạo muối axit
Bảo toàn nguyên tố Na ⇒ nNaH2PO4 = 0,05 mol
⇒ m = 7,1 + 120.0,05 = 13,1 (gam)
Bài 9: Magie photphua có công thức là:
A. Mg2P2O7 B. Mg2P3
C. Mg3P2 D. Mg3(PO4)2
Đáp án: C
Bài 10: Nhận định nào sau đây đúng:
A. Số oxi hóa cuả Photpho có thể tăng từ 0 đến +3 hoặc +5 nên photpho chỉ có tính khử
B. Photpho có thể giảm số oxi hóa từ 0 xuống -3 nên photpho chỉ có tính oxi hóa
C. Số oxi hóa của photpho có thể tăng từ 0 đến +3 hoặc +5, có thể giảm từ 0 đến -3 nên photpho thể hiện tính khử và tính oxi hóa
D. Photpho rất trơ về mặt hóa học nên không thay đổi số oxi hóa trong phản các phản ứng hóa học
Đáp án: C
Bài 11: Tìm phương trình hóa học viết sai.
A. 2P + 3Ca → Ca3P2 B. 4P + 5O2(dư) → 2P2O5
C. PCl3 + 3H2O → H3PO3 + 3HCl D. P2O3 + 3H2O → 2H3PO4
Đáp án: D
Bài 12: Cho photpho tác dụng với các chất sau : Ca, O2, Cl2, KClO3, HNO3 và H2SO4 đặc, nóng. Photpho tác dụng được với bao nhiêu chất trong số các chất trên ?
A. 6. B. 5. C. 4. D. 3.
Đáp án: A
Bài 13: Trong công nghiệp, photpho được điều chế từ phản ứng nung hỗn hợp các chất nào sau đây ?
A. quặng photphorit, đá xà vân và than cốc
B. quặng photphorit, cát và than cốc
C. diêm tiêu, than gỗ và lưu huỳnh
D. cát trắng, đá vôi và sođa
Đáp án: B
Bài 14: Thành phần chính của quặng apatit là
A. CaP2O7 B. Ca(PO3)2
C. 3Ca(PO4)2.CaFe2 D. Ca3(PO4)2
Đáp án: C
Bài 15: Phát biểu nào sau đây là sai ?
A. cấu hình electron nguyên tử của photpho là 1s22s22p63s23p6.
B. Photpho chỉ tồn tại ở 2 dạng thù hình photpho đỏ và photpho trắng.
C. Photpho trắng hoạt động mạnh hơn photpho đỏ
D. Ở nhiệt độ thường photpho hoạt động mạnh hơn nitơ.
Đáp án: B
Trắc nghiệm Axit photphoric và muối photphat có đáp án – Hóa học lớp 11
Bài 1: Hòa tan hoàn toàn 3,1 gam P trong 100 gam dung dịch HNO3 63% (đặc nóng) thu được dung dịch X và V lít (đktc) khí NO2 duy nhất. Giá trị của V là
A. 11,2. B. 5,6. C. 10,08. D. 8,96.
Đáp án: A
P (0,1) + 5HNO3 (0,5 mol) → H3PO4 + 5NO2 + H2O
⇒ HNO3 dư; nNO2 = 5nP = 0,5 mol
⇒ V = 11,2 lít
Bài 2: Thủy phân hoàn toàn 5,42 gam PX3 trong nước thu được dung dịch A. Trung hòa dung dịch A cần dùng 100 ml dung dịch NaOH 1M. Biết rằng H3PO3 là một axit 2 nấc. Công thức của PX3 là
A. PBr3. B. PI3. C. PF3. D. PCl3.
Đáp án: A
PX3 (x) + 3H2O → H3PO3 (x) + 3HX (3x mol)
2NaOH + H3PO3 → Na2HPO3 + 2H2O
NaOH + HX → NaX + H2O
nNaOH = 2nH3PO3 + nHX = 5x = 0,1 ⇒ x = 0,02 mol
PX3 = 5,42 : 0,02 = 271 ⇒ X = 80 ⇒ Br ⇒ PBr3
Bài 3: Lấy 124 gam P đem điều chế H3PO4với hiệu suất phản ứng đạt 100%. Thể tích dung dịch H3PO4 35% (D = 1,25 gam/ml) có thể thu được là
A. 1220ml. B. 936ml. C. 1000ml. D. 896ml.
Đáp án: D
Bảo toàn P: nH3PO4 = nP = 4 mol;
Bài 4: Lấy V ml dung dịch H3PO4 1M đem trộn với 100 ml dung dịch KOH 2M thu được dung dịch X có chứa 14,95 gam hỗn hợp muối.
a) Giá trị của V là
A. 85. B. 75. C. 125. D. 150.
b) Các muối trong dung dịch X là
A. K2HPO4 và KH2PO4 B. KH2PO4 và K3PO4
C. K3PO4 , K2HPO4 và KH2PO4 D. K3PO4 và K2HPO4.
Đáp án: a/ B; b/ D
Ta có: nH2O = nOH– = 0,2 mol
Áp dụng định luật bảo toàn khối lượng: mH3PO4 + mKOH = mMuối + mH2O
⇒ mH3PO4 = 14,95 + 0,2.18 – 0,2.56 = 7,35 gam ⇒ V = 7,35/98 : 1 = 0,075 = 75ml
Ta có: nOH– : nH3PO4 = 2,6 ⇒ Tạo 2 muối K3PO4 và K2HPO4
Bài 5: Cho dãy biến hóa sau :
Ca3(PO4)2 –+H2SO4→ H3PO4 –+Ca3PO4→ Ca(H2PO4)2
Biết hiệu suất 70% khối lượng dung dịch H2SO4 70% đã dùng đẻ điều chế được 467 gam Ca(H2PO4)2 theo sơ đồ biến hóa trên là
A. 800 gam. B. 350 gam. C. 400 gam. D. 700 gam.
Đáp án: C
Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
nH2SO4 = 2nCa(H2PO4)2 = (467/234) : 70% = 2,85 mol (H = 70%)
mdd = 2,85. 98 : 70% = 400 gam
Bài 6: Cho các chất sau : NaOH, H3PO4, NaH2PO4, Na2HPO4, Na3PO4. Trộn các chất trên với nhau theo từng đôi, số cặp xảy ra phản ứng là
A. 4. B. 4. C. 7. D. 6.
Đáp án: D
Bài 7: Cho sơ đồ sau : HCl + muối X → H3PO4 + NaCl
Hãy cho biết có bao nhiêu muối X thỏa mãn.
A. 2. B. 1. C. 4. D. 3.
Đáp án: D
Bài 8: Cho các phản ứng sau :
(1) Ca3(PO4)2 + C + SiO2 (lò điện); (2) NH3 + O2 (to cao)
(3) Cu(NO3)2 (to cao) (4) NH4Cl + NaOH.
Trong các phản ứng trên, những phản ứng tạo ra đơn chất là.
A.(1),(2),(4). B. (1),(3),(4).
C. (2),(3),(4). D. (1),(2),(3).
Đáp án: D
Bài 9: Cho dung dịch chưa a mol H2SO4 và dung dịch chứa 2,5a mol Na3PO4 thu được dung dịch X. các chất tan có trong dung dịch X là
A. Na3PO4, Na2HPO4 và Na2SO4 B. H3PO4, H2SO4 và Na2SO4
C. Na2HPO4 , H3PO4 và Na2SO4 D. Na2HPO4 Na2HPO4 và Na2SO4
Đáp án: A
Bài 10: cho sơ đò chuyển hóa : P2O5 → X → Y → Z.
Các chất X, Y, Z lần lượt là
A. KH2PO4, K2HPO4, K3PO4 B. KH2PO4, K3PO4, K2HPO4
C. K3PO4, KH2PO4, K2HPO4, D. K3PO4, K2HPO4, KH2PO4
Đáp án: C
Bài 11: Phản ứng nào sau đây được sử dụng để điều chế H3PO4 trong phòng thí nghiệm ?
A. P + HNO3 đặc, nóng B. Ca3(PO4)2 + H2SO4 đặc
C. P2O5 + H2O D. HPO3 + H2O
Đáp án: A
Bài 12: Khi đun nóng từ từ H3PO4 bị mất nước theo sơ đồ :
H3PO4 → X → Y → Z.
Các chất X, Y, Z lần lượt là
A. H2PO4, HPO3, H4P2O7 B. HPO3, H4P2O7, P2O5
C. H4P2O7, P2O5, HPO3 D. H4P2O7,HPO3, P2O5.
Đáp án: D
Bài 13: Thành phần chính của quặng photphorit là
A. CaPHO4 B. NH4H2PO4.
C. Ca(H2PO4)2. D. Ca3(PO4)2.
Đáp án: D
Bài 14: Cho 4 dung dịch sau : Na3PO4, Na2HPO4, NaH2PO4 và H3PO4 có cùng nồng độ mol, có các giá trị pH lần lượt là : pH1, pH2, pH3 và pH4. Sự sắp xếp nào sau đây đúng với sự tăng dần ph ?
A. pH1 2 3 4 B. pH4 3 2 1
C. pH3 4 1 2 D. pH2 1 4 3
Đáp án: B
Bài 15: Nhận xét nào sau đây đúng ?
A. Thành phần chính của quặng apatit là 3Ca3(PO4)2, CaF2.
B. Trong công nghiệp photpho được điều chế từ Ca3P2, SiO2 và C.
C. Ở điều kiện thường photpho đỏ tác dụng với O2 tạo ra sản phẩm P2O5.
D. Các muối Ca3(PO4)2 và CaHPO4 đều tan trong nước.
Đáp án: A
Trắc nghiệm Phân bón hóa học có đáp án – Hóa học lớp 11
Bài 1: Supephôtphat kép có công thức là:
A. Ca3(PO4)2 B. Ca(H2PO4)2
C. CaHPO4 D. Ca(H2PO4)2.CaSO4
Đáp án: B
Bài 2: Cho Cu và dung dịch H2SO4 loãng phản ứng với X (là một loại phân hoá học), thấy tạo ra khí không màu hoá nâu trong không khí. Nếu cho X phản ứng với dung dịch NaOH thì có khí mùi khai thoát ra. Tìm X:
A. urê B. natri nitrat
C. amoni nitrat D. amôphot
Đáp án: C
Bài 3: Loại phân bón nào có hàm lượng Nitơ cao nhất:
A. canxi nitrat B. amoni nitrat
C. amophot D. urê
Đáp án: D
Bài 4: Một loại phân supephotphat kép có chứa 69,62% muối canxi đihiđrophotphat, còn lại gồm các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là
A. 48,52% B. 39,76%
C. 42,25% D. 45,75%
Đáp án: C
Ca(H2PO4)2 → P2O5
234gam → 142 gam
69,62% → 69,62%. (142/234) = 42,25% ⇒ Độ dinh dưỡng = 42,25%
Bài 5: Một loại phân kali có thành phần chính là KCl (còn lại là các tạp chất không chứa kali) được sản xuất từ quặng xinvinit có độ dinh dưỡng 55%. Phần trăm khối lượng của KCl trong loại phân kali đó là:
A. 95,51%. B. 65,75%.
C. 87,18%. D. 88,52%.
Đáp án: C
Độ dinh dưỡng 55% ⇒ %K2O = 55%
2KCl → K2O
149 → 94 (gam)
55%. 149/94 = 87,18% ← 55%
Bài 6: Cho 44 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Sau khi phản ứng xảy ra hoàn toàn. Đem cô cạn dung dịch đến khô, thu được lượng muối khan là
A. 50 gam Na3PO4.
B. 15 gam Na2HPO4.
C. 19,2 gam NaH2PO4 và 14,2 gam NaH2PO4.
D. 14,2 gam NaH2PO4 và 49,2 gam Na3PO4.
Đáp án: D
nNaOH = 1,1 mol; nH3PO4 = 0,4 mol
2 NaOH : nH3PO4 ⇒ Tạo 2 muối Na3PO4 (x mol) và Na2HPO4 (y mol)
3NaOH (3x) + H3PO4 (x) → Na3PO4 (x mol) + 3H2O
2NaOH (2y) + H3PO4 (y) → Na2HPO4 (y mol) + 2H2O
nNaOH = 3x + 2y = 1,1 mol;
nH3PO4 = x + y = 0,4 mol
⇒ x = 0,3 mol → mNa3PO4 = 49,2 gam; y = 0,1 mol → mNa2HPO4 = 14,2 gam
Bài 7: Cho 2016 lít khí NH3 (đktc) vào dung dịch chứa a gam H3PO4. Sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch được hỗn hợp amophot chứa 3960 gam (NH4)2HPO4. Giá trị của a là
A. 8820. B. 4900. C. 5880. D. 7840.
Đáp án: C
Hỗn hợp amophot: (NH4)2HPO4 (30 mol) và NH4H2PO4 (x mol)
Bảo toàn nguyên tố N ⇒ x = 30
Bảo toàn nguyên tố P ⇒ nH3PO4 = 60 mol ⇒ a = 60.98 = 5880 (gam)
Bài 8: Một loại phân supephotphat kép có chứa 69,62% muối canxi đihiđrôphotphat, còn lại gồm các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là
A. 48,52%. B. 45,75%. C. 42,25%. D. 39,76%.
Đáp án: C
100 gam phân lân có 69,62 gam Ca(H2PO4)2 (≈ 0,2975 mol)
⇒ nP2O5 = 0,2975 mol
⇒ mP2O5 = 42,25g
Bài 9: Trong 20g supephôtphat đơn có chứa 5g Ca(H2PO4)2. Tính hàm lượng phần trăm của P2O5 có trong mẫu lân đó:
A. 10,23% B. 12,01%
C. 9,56% D. 15,17%
Đáp án: D
Ca(H2PO4)2 → P2O5
234gam → 142 gam
5g → 5.142/234 = 3,03 gam ⇒ %P2O5 = (3,03/20). 100% = 15,17%
Bài 10: Phát biểu nào sau đây đúng:
A. amophot là hỗn hợp các muối (NH4)2HPO4 và KNO3
B. phân hỗn hợp chứa nitơ; photpho; kali được gọi chung là NPK
C. Ure có công thức là (NH4)2CO3
D. phân lân cung cấp nitơ hoá hợp cho cây dưới dạng ion NO3– và ion NH4+
Đáp án: B
Bài 11: Loại phân đạm nào sau đây có đọ dinh dưỡng cao nhất ?
A. (NH4)2SO4. B. CO(NH2)2. C. NH4NO3. D. NH4Cl.
Đáp án: B
Bài 12: Cho các phản ứng sau :
A. Ca3(PO4)2 + 3H2SO4 đặc → 3CaSO4 + 2H3PO4 (1)
B. Ca3(PO4)2 + 2H2SO4 đặc → 2CaSO4 + Ca(H2PO4)2 (2)
C. Ca3(PO4)2 + 4H2SO4 đặc → 3 Ca(H2PO4)2 (3)
D. Ca3(OH)2 + 2H2SO4 đặc → Ca(H2PO4)2 + 2H2O (4)
Những phản ứng xảy ra trong quá trình điều chế supephotphat kép từ Ca(H2PO4)2 là
A. (2), (3). B. (1), (3). C. (2), (4). D. (1), (4).
Đáp án: B
Bài 13: Phát biểu nào sau đây không đúng ?
A. supephotphat kép cố độ dinh dưỡng thấp hơn supephotphat đơn.
B. Nitơ và photpho là hai nguyên tố không thể thiếu cho sự sống.
C. Tất cả các muối nitrat đều bị nhiệt phân hủy.
D. Tất cả các muối đihiđrophotphat đều rễ tan trong nước.
Đáp án: A
Bài 14: Cho các phát biểu sau :
(1) Độ dinh dưỡng của phân đạm,phân lân và phân kali tính theo phần trăm khối lượng tương ứng của N2O5 ; P2O5 và K2O3.
(2) Người ta không bón phân urê kèm với vôi.
(3) Phân lân chứa nhiều photpho nhât là supephootphat kép.
(4) Bón nhiều phân đạm amoni sẽ làm đất chua.
(5) Quặng photphorit có thành phần chính là Ca3(PO4)2.
Trong các phát biểu trên, số phất biểu đúng là
A. 5. B. 2. C. 3. D. 4.
Đáp án: D
Bài 15: Hàm lượng KCl có trong một loại phân kali có độ dinh dưỡng 50% là
A. 79,26%. B. 95.51%. C. 31,54%. D. 26,17%.
Đáp án: A
Độ dinh dưỡng 50% ⇒ %K2O = 50%
2KCl → K2O
149g → 94 gam
x ← 50% → x = 50%. (149/94) = 79,26%
Trắc nghiệm Luyện tập: Tính chất của nitơ, photpho có đáp án – Hóa học lớp 11
Bài 1: Cho m gam hỗn hợp X gồm Al và Mg tác dụng hết với dung dịch HCl dư tạo ra 8,96 lít khí H2 (đktc). Cũng m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư tạo ra 5,75 gam hỗn hợp khí Y gồm NO và N2O dung dịch thu được sau phản ứng chỉ có hai muối. Thể tích của hỗn hợp Y (đktc) là
A. 8,96 lít. B. 3,36 lít. C. 7,28 lít. D. 3,64 lít.
Đáp án: D
nNO = x mol; nN2O = y mol;
⇒ 30x + 44y = 5,75 g (1)
Bảo toàn e ta có: ne cho = ne nhận = 2nH2 = 0,8mol
⇒ 3x + 8y = 0,8 (2)
Từ (1)(2) ⇒ x = 0,1 mol; y = 0,0625 mol ⇒ VY = 3,64 lít
Bài 2: Nung 6,58 gam Cu(NO3)2 trong bình kín, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn hỗn hợp X vào nước được 300 ml dung dịch Y. pH của dung dịch Y là
A. 2,0. B. 1,7. C. 1,3. D. 1,0.
Đáp án: D
2Cu(NO3)2 –H = 80%→ 2CuO + 4NO2 (4x) + O2 (x mol)
mc/rắn giảm = mkhí = 6,58 – 4,96 = 1,62 gam ⇒ mNO2 + mO2 = 1,62
46. 4x + 32x = 1,62 ⇒ x = 0,0075 mol
nNO2 = nHNO3 = nH+ = 0,03 ⇒ [H+] = 0,1 ⇒ pH = 1,0
Bài 3: Supephotphat đơn được điều chế từ một loại bột quặng chứa 73% Ca(PO4)2, 26% CaCO3 và 1% SiO2. Khối lượng dung dịch H2SO4 65% tác dụng với 100kg quặng kẽm khi điều chế supephotphat đơn là
A. 110,2 kg. B. 106,5 kg. C. 74,7 kg. D. 71,0 kg.
Đáp án: A
nCa3(PO4)2 = 0,235 kmol; nCaCO3 = 0,26Kmol
Điều chế supephotphat đơn: nH2SO4 = 2 nCa3(PO4)2 + nCaCO3 = 0,73 kmol
⇒ mdd = 0,73. 98 : 65% = 110,2 kg
Bài 4: Cho a mol P2O5 vào 200ml dung dịch NaOH thì thu được dung dịch chúa 0,15 mol Na2HPO4 và 0,25 mol NaH2PO4. Giá trị của a và nồng độ mol của NaOH là
A. a = 0,2 và CM = 2,75M B. a = 0,4 và CM = 2,75M.
C. a = 0,4 và CM = 5,5M. D. a = 0,2 và CM = 5,5M.
Đáp án: A
Bảo toàn nguyên tố:
nP2O5 = 1/2. nNa2HPO4 + 1/2. nNaH2PO4 = 0,2 mol = a
nNaOH = 2nNa2HPO4 + nNaH2PO4 = 0,55 mol ⇒ CM NaOH = 2,75 mol
Bài 5: Thủy phân hoàn toàn 4,878 gam halogenua của photpho thu được hỗn hợp hai axit. Để trung hòa hoàn toàn hỗn hợp này cần 90 ml dung dịch NaOH 1M. Halogen đó là
A. F. B. Cl. C. Br. D. I.
Đáp án: C
PX3 (x) + 3H2O → 3HX (3x) + H3PO3 (x mol)
nNaOH = nHX + 2nH3PO3 = 5x = 0,09 mol (axit H3PO3 là axit 2 nấc )
⇒ x = 0,018 mol
⇒ PX3 = 4,878 : 0,018 = 271 ⇒ X = 80 (Br)
Bài 6: Để phân biệt các mẫu phân bón sau : (NH4)2SO4, NH4Cl và Ca(H2PO4)2 cần dùng thuốc thử là
A. dung dịch BaCl2. B. dung dịch Ba(OH)2.
C. dung dịch HCl. D. dung dịch NaOH.
Đáp án: B
Bài 7: Cho các mệnh đề sau :
(1) Amoniac được dùng để điều chế nhiên liệu cho tên lửa.
(2) NO2 vừa có tính oxi hóa vừa có tính khử.
(3) Trong phòng thí nghiệm , HNO3 được điều chế bằng cách đun nóng NaNO3 tinh thể với dung dịch H2SO4 đặc.
(4) Trong công nghiệp, photpho được sản xuất bằng cách nung nóng hỗn hợp quặng photphoric, cát và than cốc ở 1200oC trong lò điện.
(5) Phân supephotphat đơn có thành phần chính là Ca(H2PO4)2.
Trong các mênh đề trên, số mệnh đề đúng là
A. 4. B. 5. C. 2. D. 3.
Đáp án: A
Bài 8: Cho sơ đồ sau : X + H2O → H3PO4.
Số chất X thỏa mãn là
A. 1. B. 4. C. 2. D. 3.
Đáp án: D
Bài 9: Cho 2,64 gam (NH4)2SO4 tác dụng với dung dịch NaOH dư đun nóng thu được một sản phẩm khí. Hấp thụ hoàn toàn lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là
A. NH4H2PO4. B. (NH4)2HPO4.
C. (NH4)3PO4. D. NH4H2PO4.và (NH4)2HPO4.
Đáp án: A
nNH3 = 2n(NH4)2SO4 = 0,02 mol
nH3PO4 = 0,04 mol
nNH3 : nH3PO4 = 1 : 2 ⇒ tạo muối NH4H2PO4
Bài 10: Cho hỗn hợp X gồm Fe, FeO, Fe3O4 có khối lượng 4,04 gam phản ứng hết với dung dịch HNO3 dư thu được 336 ml NO (sản phẩm khử duy nhất (đktc)). Số mol axit tham gia phản ứng là
A. 0,06 mol. B. 0,0975 mol. C. 0,18 mol. D. 0,125 mol.
Đáp án: C
Bài 11: Cho các phản ứng sau :
(1) Cu(NO3)2 (2) NH4NO2
(3) NH3 + O2 (4) NH3 + Cl2
(5) NH4Cl (6) NH3 + CuO
Trong các phản ứng trên, những phản ứng tạo ra khí N2 là
A. (2),(4),(6). B. (3),(5),(6). C. (1),(3),(4). D. (1),(2),(5).
Đáp án: A
Bài 12: Cho các phản ứng sau :
(1) NH4Cl (2) NH4NO3
(3) NH4NO2 + NaOH (4) Cu + HCl + NaNO3
(5) (NH4)2CO3
Trong các phản ứng trên, số phản ứng tạo thành khí NH3 là
A. 2. B. 3. C. 4. D. 5.
Đáp án: A
Bài 13: Cho 2 muối X, Y thỏa mãn điều kiện sau:
X + Y → không xảy ra phản ứng.
X + Cu → không xảy ra phản ứng.
Y + Cu → không xảy ra phản ứng.
X +Y + Cu → xảy ra phản ứng.
X và Y là
A. Mg(NO3)2 và KNO3 B. Fe(NO3)3 và NaHSO4.
B. C…NaNO3 và NaHCO3 D. NaNO3 và NaHSO4.
Đáp án: D
Bài 14: Axit nitric và axit photphoric có cùng phản ứng với nhóm các chất nào sau đây ?
A. NaOH, K2CO3, CuCl2, NH3. B. NaOH, K2HPO4, Na2CO3, NH3.
C. NaOH, Na2CO3,KCl, K2S. D. KOH, MgO, CuSO4, NH3.
Bài 15: Để phân biệt các dung dịch axit HCl, HNO3, H2SO4 và H3PO4, người ta dùng thêm kim loại nào sau đây ?
A. Cu. B. Na. C. Ba. D. Fe.
Bài 16: Có các dung dịch sau : HCl, H3PO4, NaH2PO4, NaH2PO4và Na3PO4. Trộn các dung dịch đó với nhau theo từng đôi một, số cặp xảy ra phăn ứng là
A. 6. B. 4. C. 7 D. 5.
Đáp án: A