Giáo án Hóa học 10 Chân trời sáng tạo bản word trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 20k cho 1 bài Giáo án lẻ bất kì):
B1: – –
B2:
Xem thử tài liệu tại đây: Link tài liệu
|
Trường THPT …………. Tổ: ………………….. |
Họ và tên giáo viên ………………………….. |
|||
|
BÀI 14. TÍNH BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG HOÁ HỌC |
||||
|
Tuần: |
Tiết: |
Ngày soạn: |
Thời gian thực hiện: 3 tiết |
|
I. MỤC TIÊU
1. Năng lực chung
– Giao tiếp và hợp tác: Hoạt động nhóm theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia hoạt động hiệu quả.
– Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm, vận dụng năng lực tính toán để tính các giá trị enthalpy của phản ứng.
2. Năng lực hoá học
Nhận thức hoá học:
– Tính được ![]() của một phản ứng dựa vào bảng số liệu năng lượng liên kết, nhiệt tạo thành cho sẵn.
của một phản ứng dựa vào bảng số liệu năng lượng liên kết, nhiệt tạo thành cho sẵn.
– Vận dụng công thức: ![]()
![]()
Vận dụng kiến thức, kĩ năng đã học:
– Tìm hiểu và giải thích một số kiến thức liên quan đến enthalpy của phản ứng.
3. Phẩm chất
– Có trách nhiệm tham gia tích cực hoạt động nhóm và cặp đôi phù hợp với khả năng của bản thân;
– Có niềm say mê, hứng thú với việc khám phá và học tập.
II. ĐỒ DÙNG DẠY HỌC
– Hình ảnh trong SGK về sự cháy của methane, video liên quan đến bài học.
– Các phiếu học tập.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a) Mục tiêu:
– Tạo hứng thú và kích thích sự tò mò của học sinh vào chủ đề học tập. Học sinh tiếp nhận kiến thức chủ động, tích cực, hiệu quả.
b) Nội dung:
– GV sử dụng câu hỏi mở đầu – SGK Hoá học 10 để đặt vấn đề.
c) Sản phẩm: Các câu trả lời của HS, câu trả lời có thể đúng hoặc sai.
d) Tổ chức thực hiện:
– GV đặt vấn đề: Methane cháy tỏa nhiệt lớn nên được dùng làm nhiên liệu. Khi trộn methane và oxygen với tỉ lệ thích hợp thì sẽ tạo ra hỗn hợp nổ. Biến thiên enthalpy của phản ứng này được tính toán dựa trên các giá trị nào?
– HS trả lời, câu trả lời của HS có thể đúng hoặc sai, GV không nhận xét tính đúng, sai mà sử dụng nó để dẫn dắt vào bài mới: “Tiết học hôm nay cô sẽ cùng các em tìm hiểu các cách tính biến thiên enthalpy của một phản ứng hoá học”.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
a) Mục tiêu:
– Vận dụng được công thức tính biến thiên anthalpy của phản ứng dựa vào năng lượng liên kết.
b) Nội dung:
HS hoạt động theo nhóm, hoàn thành phiếu học tập và rút ra được cách tính enthalpy của phản ứng dựa vào năng lượng liên kết.
PHIẾU HỌC TẬP SỐ 1
1. Nêu cách tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết? Phạm vi áp dụng của cách tính này.
2. Để tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định số lượng và loại liên kết. Xác định số lượng mỗi loại liên kết trong các phân tử sau: CH4, CH3Cl, NH3, CO2.
3. Xác định ![]() của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
CH4(g) + Cl2(g) ![]() CH3Cl(g) + HCl(g)
CH3Cl(g) + HCl(g)
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
c) Sản phẩm:
– Bài trình bày kết quả thực hiện trong phiếu học tập và ghi vào vở.
PHIẾU HỌC TẬP SỐ 1
1.
– Cho phản ứng tổng quát ở điều kiện chuẩn:
aA (g) + bB (g) → mM (g) + nN (g)
Tính ![]() của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
![]()
Hay tổng quát: ![]()
Với ∑Eb (cđ); ∑Eb (sp): tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
– Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết được áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hóa trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
2.
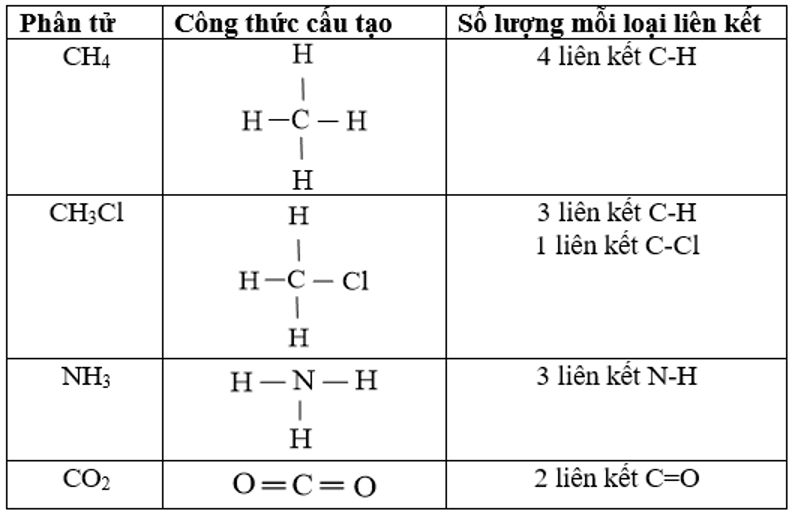
3.
![]() = Eb(CH4) + Eb(Cl2) – Eb(CH3Cl) – Eb(HCl)
= Eb(CH4) + Eb(Cl2) – Eb(CH3Cl) – Eb(HCl)
![]() = 4.Eb(C-H) + Eb(Cl-Cl) – 3Eb(C-H) – Eb(C-Cl) – Eb(H-Cl)
= 4.Eb(C-H) + Eb(Cl-Cl) – 3Eb(C-H) – Eb(C-Cl) – Eb(H-Cl)
![]() = 4.413 + 243 – 3.413 – 339 – 427
= 4.413 + 243 – 3.413 – 339 – 427
![]() = -110 kJ < 0
= -110 kJ < 0
⇒ Phản ứng tỏa nhiệt.
d) Tổ chức thực hiện:
|
Hoạt động của GV |
Hoạt động của HS |
|
Nhiệm vụ học tập: – Chia lớp thành 4 nhóm, giao các phiếu học tập cho các nhóm. – Yêu cầu HS thảo luận nhóm hoàn thành các phiếu học tập. |
HS nhận nhiệm vụ. |
|
Thực hiện nhiệm vụ: – GV đôn đốc và hỗ trợ các nhóm HS hoàn thành các phiếu học tập. |
– HS thảo luận và hoàn thiện kết quả theo hướng dẫn của GV.
|
|
Báo cáo kết quả Yêu cầu đại diện 1 nhóm báo cáo, các nhóm khác nhận xét, bổ sung. |
– Đại diện nhóm trình bày kết quả, nhóm khác bổ sung.
|
…………………………………………
…………………………………………
…………………………………………
Tài liệu có 9 trang, trên đây trình bày tóm tắt 4 trang của Giáo án Hóa hoc 10 Chân trời sáng tạo Bài 14: Tính biến thiên enthalpy của phản ứng hóa học.
Xem thêm các bài giáo án Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Giáo án Bài 13: Enthalpy tạo thành và sự biến thiên enthalpy của phản ứng hoá học
Giáo án Bài 14: Tính biến thiên enthalpy của phản ứng hoá học
Giáo án Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Giáo án Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học
Giáo án Bài 17: Tính chất vật lí và tính chất hóa học của nhóm VIIA
Để mua Giáo án Hóa học 10 Chân trời sáng tạo năm 2023 mới nhất, mời Thầy/Cô liên hệ https://tailieugiaovien.com.vn/