Giải bài tập Hóa Học lớp 11 Bài 12. Phân bón hóa học
Câu hỏi và bài tập (trang 58 sgk Hóa học 11)
Bài 1 trang 58 sgk hóa học 11: Cho các mẫu phân đạm sau đây: amoni sunfat , amoni clorua, natri nitrat. Hãy dùng các thuốc thử thích hợp để phân biệt chúng. Viết phương trình hóa học của các phản ứng đã dùng.
Phương pháp giải:
Có thể dùng các thuốc thử: dung dịch kiềm (NaOH) và dung dịch BaCl2, để nhận biết các chất (NH4)2SO4, NH4Cl, NaNO3.
Lời giải:
+ Cách 1:
Ta hòa tan một ít mẫu các phân đạm vào nước thì được 3 dung dịch muối: (NH4)2SO4, NH4Cl, NaNO3. Cho từ từ dung dịch Ba(OH)2 vào từng dung dịch:
+ Nếu thấy dung dịch nào có khí bay ra có mùi khai và xuất hiện kết tủa trắng là (NH4)2SO4
(NH4)2SO4 + Ba(OH)2 BaSO4 + 2NH3 + 2H2O
+ Nếu thấy dung dịch nào có khí bay ra có mùi khai là NH4Cl
2NH4Cl + Ba(OH)2 BaCl2 + 2NH3 + 2H2O
+ Dung dịch không có hiện tượng gì là NaNO3
+ Cách 2:
Lấy mỗi mẫu phân đạm 1 ít, cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng:
Cho lần lượt các mẫu thuốc thử vào các ống nghiệm trên ta có bảng sau:
|
|
Amoni sunfat (NH4)2SO4 |
Amoni clorua (NH4Cl) |
Natri nitrat (NaNO3) |
|
dd NaOH |
Khí NH3 mùi khai (1) |
Khí NH3 mùi khai (2) |
Không có hiện tượng gì Nhận ra NaNO3 |
|
dd BaCl2 |
BaSO4 kết tủa trắng (3) Đó là (NH4)2SO4 |
Không có hiện tượng gì. Đó là NH4Cl |
|
NaOH + (NH4)2SO4 → Na2SO4 + NH3↑ + H2O
NaOH + NH4Cl → NaCl + NH3↑ + H2O
BaCl2 + (NH4)2SO4 → BaSO4↓ + 2NH4Cl
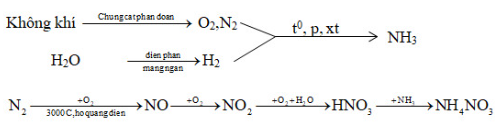
Bài 2 trang 58 sgk hóa học 11: Từ không khí, than, nước và các chất xúc tác cần thiết, hãy lập sơ đồ điều chế phân đạm NH4NO3.
Phương pháp giải:
Để điều chế phân đạm NH4NO3 cần phải có NH3 và HNO3.
Có thể điều chế theo sơ đồ sau:
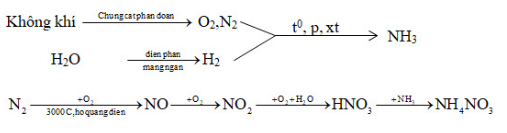
Lời giải:
Bài 3 trang 58 sgk hóa học 11: Một loại quặng photphat có chứa 35% Ca3(PO4)2. Hãy tính hàm lượng phần trăm P2O5 có trong quặng trên.
Phương pháp giải:
Cứ 1 mol Ca3PO4 ( hay có thể viết 3CaO.P2O5) thì có 1 mol P2O5
Hay 310 gam Ca3PO4 thì có 142 gam P2O5
Vậy 350 gam Ca3PO4 thì có x gam P2O5
=> x =? => phần trăm khối lượng của P2O5 có trong 1000 gam quặng là = ?
Lời giải:
Trong 1000 gam quặng có 1000.35% = 350 gam

Vậy phần trăm khối lượng của P2O5 có trong 1000 gam quặng là:
Bài 4 trang 58 sgk hóa học 11: Để sản xuất một lượng phân bón amophot đã dùng hết 6,000.103 mol H3PO4.
a) Tính thể tích khí ammoniac (đktc) cần dùng, biết rằng loại amophot này có tỉ lệ về số mol nNH4H2PO4: n(NH4)2 HPO4 = 1 : 1.
b) Tính khối lượng amophot thu được.
Phương pháp giải:
Viết PTHH xảy ra, tính số mol các muối thu được theo số mol của H3PO4.
PTHH: 2H3PO4 + 3NH3 → (NH4)2 HPO4 + NH4H2PO4
Lời giải:
H3PO4 + NH3 → NH4H2PO4
H3PO4 + 2NH3 → (NH4)2 HPO4
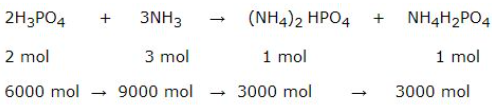
a) Thể tích khí ammoniac (đktc) cần dùng:
9000 x 22,40 = 20,16 x 104 (lít)
b) Tính khối lượng amophot thu được:
m(NH4)2 HPO4 + mNH4H2PO4 = 3000 . (132,0 + 115,0) = 7,410 . 105 gam = 741,0 kg
Lý thuyết Phân bón hóa học.
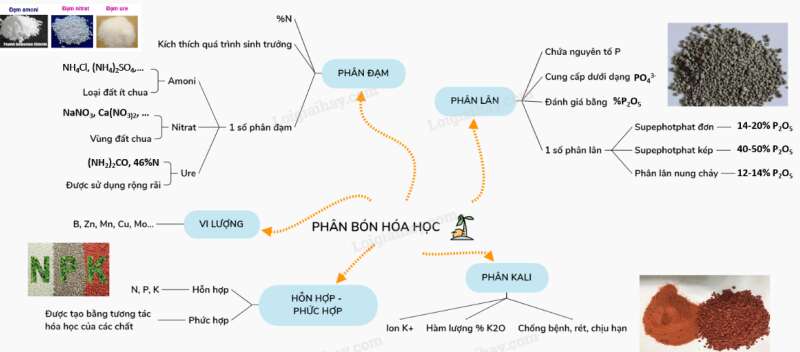
Phân bón hóa học là những hóa chất có chứa các nguyên tố dinh dưỡng cho cây trồng.
I. PHÂN ĐẠM
– Phân đạm là những hợp chất cung cấp Nitơ cho cây trồng.
– Tác dụng: kích thích quá trình sinh trưởng của cây, tăng tỉ lệ protêin thực vật.
– Độ dinh dưỡng đánh giá bằng %N trong phân.
1. Phân đạm Amoni
– Là các muối amoni: NH4Cl, (NH4)2SO4, NH4NO3, …
– Dùng bón cho các loại đất ít chua.
* Lưu ý: Khi tan trong nước, muối amoni thủy phân tạo môi trường axit nên chỉ thích hợp bón cho đất it chua hoặc đất đã được khử chua trước bằng vôi sống (CaO)
2. Phân đạm Nitrat
– Là các muối Nitrat: NaNO3, Ca(NO3)2, …
– Amoni có môi trường axit còn Nitrat có môi trường trung tính.
⇒ Vùng đất chua bón nitrat, vùng đất kiềm bón amoni.
3. Urê
– CTPT: (NH2)2CO, 46%N.
– Điều chế: CO2 + 2NH3 → (NH2)2CO + H2O.
– Tại sao Urê được sử dụng rộng rãi? Do urê trung tính và hàm lượng nitơ cao.
– Giai đoạn nào của cây trồng đòi hỏi nhiều phân đạm hơn? Giai đoạn sinh trưởng của cây.
II. PHÂN LÂN
– Phân có chứa nguyên tố P, có 2 loại.
– Cung cấp photpho cho cây dưới dạng ion photphat PO43-.
– Cần thiết cho cây ở thời kỳ sinh trưởng.
– Đánh giá bằng hàm lượng %P2O5 tương ứng với lượng photpho có trong thành phần của nó.
– Nguyên liệu: quặng photphoric và apatit.
– Các loại phân lân thường dùng là:
+ Supephotphat đơn: Ca(H2PO4)2.CaSO4(14-20% P2O5).
+ Supephotphat kép: Ca(H2PO4)2(40-50% P2O5).
+ Phân lân nung chảy: Hỗn hợp quặng apatit với đá xà vân và than cốc (12-14% P2O5).
III. PHÂN KALI
– Cung cấp nguyên tố Kali cho cây dưới dạng ion K+.
– Tác dụng: tăng cường sức chống bệnh, chống rét và chịu hạn của cây.
– Đánh giá bằng hàm lượng % K2O.
IV. PHÂN HỒN HỢP VÀ PHÂN PHỨC HỢP
1. Phân hỗn hợp
– Chứa cả ba nguyên tố N, P, K được gọi là phân NPK, là sản phẩm khi trộn lẫn các loại phân đơn theo tỉ lệ N : P : K khác nhau tùy theo loại đất và cây trồng.
VD: Nitrophotka là hỗn hợp của (NH4)2HPO4 và KNO3.
2. Phân phức hợp
– Là hỗn hợp các chất được tạo ra bằng tương tác hóa học của các chất.
VD: Amophot là hỗn hợp các muối NH4H2PO4 và (NH4)2HPO4 thu được khi cho amoniac tác dụng với axit photphoric.
V. PHÂN VI LƯỢNG
– Cung cấp cho cây các nguyên tố như bo (B), kẽm (Zn), mangan (Mn), đồng (Cu), molipđen (Mo), … ở dạng hợp chất.
Sơ đồ tư duy: Phân bón hóa học.