Giải SBT Hóa học 11 Bài 7: Sulfuric acid và muối sulfate
Bài 7.1 trang 22 SBT Hoá học 11: Những phát biểu nào sau đây là đúng?
(a) Sulfuric acid tan tốt trong nước, quá trình hoà tan toả nhiệt mạnh.
(b) Dung dịch sulfuric acid đặc hoà tan được tất cả các kim loại.
(c) Dung dịch sulfuric acid đặc có tính háo nước và tính oxi hoá mạnh.
(d) Dung dịch sulfuric acid loãng dễ bị phân huỷ bởi ánh sáng nên kém bền.
Lời giải:
Đáp án đúng là: (a), (c).
Bài 7.2 trang 23 SBT Hoá học 11: Những đặc điểm nào sau đây về muối sulfate là đúng?
(a) Nhiều muối sulfate tan tốt trong nước nhưng một số muối như CaSO4, BaSO4 rất ít tan trong nước.
(b) Magnesium sulfate được dùng làm thuốc điều trị bệnh liên quan đến hồng cầu, dùng làm chất hút mồ hôi tay cho các vận động viên,…
(c) Calcium sulfate là thành phần chính của các loại thạch cao. Phân tử chất này thường ngậm nước với số lượng các phân tử H2O khác nhau, tạo ra các loại thạch cao có ứng dụng khác nhau.
(d) Barium sulfate là chất rắn màu trắng, hầu như không tan trong nước. Chất này được dùng tạo màu trắng cho các loại giấy chất lượng cao.
Lời giải:
Đáp án đúng là: (a), (c), (d).
Bài 7.3 trang 23 SBT Hoá học 11: Nối những đặc điểm của chất ở cột B với tên chất ở cột A cho phù hợp.
|
Cột A |
Cột B |
|
a) Sulfuric acid |
1. Tan tốt trong nước. |
|
b) Thạch cao |
2. Là chất rắn ở điều kiện thường. |
|
c) Ammonium sulfate (thành phần chính trong một loại phân đạm) |
3. Dùng để cố định xương bị gãy (bó bột). |
|
4. Là chất điện li mạnh. |
|
|
5. Phản ứng dễ dàng với dung dịch base như nước vôi, barium hydroxide. |
|
|
6. Hòa tan được nhiều kim loại. |
Lời giải:
Đáp án đúng là: a – 1, 4, 5, 6; b – 2, 3; c – 1, 2, 4, 5.
Bài 7.4 trang 23 SBT Hoá học 11: Hình bên là công thức Lewis của H2SO4.
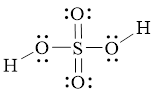
a) Dựa vào công thức Lewis của H2SO4, hãy cho biết số oxi hóa của nguyên tử sulfur trong phân tử.
b) Khi tham gia phản ứng, H2SO4 không thể tạo ra các sản phẩm chứa sulfur có số oxi hóa lớn hơn hoặc bằng 7. Giải thích.
c) Hydrogen iodide có tính khử khá mạnh. Hãy dự đoán khí này có phản ứng với sulfuric acid đặc không. Giải thích.
Lời giải:
a) Do 6 electron hóa trị của S bị lệch về phía các nguyên tử O nên S có số oxi hóa là +6.
b) S chỉ có 6 electron hóa trị nên không thể có số oxi hóa lớn hơn 6.
c) Có do H2SO4 cũng là chất có tính oxi hóa mạnh.
8HI + H2SO4 → H2S + 4I2 + 4H2O
Bài 7.5 trang 23 SBT Hoá học 11: Hãy mô tả hiện tượng xảy ra và hoàn thành phương trình hoá học của phản ứng xảy ra khi sulfuric acid loãng:
a) Tiếp xúc với lá kim loại hoạt động bị phủ bởi lớp oxide kim loại (chẳng hạn, lá kẽm (zinc) bị phủ bởi lớp zinc oxide).
b) Tiếp xúc vói mẩu đá vôi hay mẩu phấn viết bảng.
c) Tiếp xúc bột baking soda (sodium hydrogencarbonate).
d) Được cho vào nước vôi trong, Ca(OH)2.
Lời giải:
a) Lớp oxide tan dần, sau đó lá kim loại cũng tan và có bọt khí xuất hiện.
H2SO4(aq) + ZnO(s) → ZnSO4(aq) + H2O(l)
H2SO4(aq) + Zn(s) → ZnSO4(aq) + H2(g)
b) Mẩu đá vôi tan ra, dung dịch sủi bọt khí, dung dịch sau phản ứng có màu trắng đục, để lâu sẽ lắng thành lóp bột màu trắng.
H2SO4(aq) + CaCO3(s) → CaSO4(s) + CO2(g) + H2O(l)
c) Bột baking soda tan ra, dung dịch sủi bọt khí, sau phản ứng thu được dung dịch trong suốt.
H2SO4(aq) + 2NaHCO3(s) → Na2SO4(aq) + 2CO2(g) + 2H2O(l)
d) Nước vôi trong bị đục.
H2SO4(aq) + Ca(OH)2(aq) → CaSO4(s) + 2H2O(l)
Bài 7.6 trang 24 SBT Hoá học 11: Dưới đây là một số phản ứng minh hoạ tính oxi hoá của sulfuric acid và sulfur dioxide. Đa số các phản ứng này có ứng dụng trong phòng thí nghiệm, Hãy cân bằng phương trình hoá học các phản ứng bằng phương pháp thăng bằng electron.
a) Sulfuric acid đặc phản ứng với carbon trong than:
H2SO4(đặc) + C ⟶ CO2 + SO2 + H2O
b) Sulfur dioxide làm mất màu dung dịch bromine:
SO2 + Br2 + H2O → HBr + H2SO4
c) Sulfur dioxide làm mất màu dung dịch thuốc tím:
SO2 + KMnO4 + H2O ⟶ MnSO4 + K2SO4 + H2SO4
d) Sulfuric acid oxi hoá hợp chất Fe(II) thành hợp chất Fe(III):
H2SO4 + FeSO4 → Fe2(SO4)3 + SO2 + H2O
e) Phản ứng dùng để xác định nồng độ hợp chất Fe(II) bằng thuốc tím trong môi trường acid:
H2SO4 + FeSO4 + KMnO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
g) Phản ứng xác định nồng độ hợp chất Fe(II), dạng ion thu gọn:
H+ + Fe2+ + ⟶ Fe3+ + Mn2+ + H2O
Lời giải:
a) 2H2SO4(đặc) + C ⟶ CO2 + 2SO2 + 2H2O
b) SO2 + Br2 + 2H2O → 2HBr + H2SO4
c) 5SO2 + 2KMnO4 + 2H2O ⟶ 2MnSO4 + K2SO4 + 2H2SO4
d) 2H2SO4 + 2FeSO4 → Fe2(SO4)3 + SO2 + 2H2O
e) 8H2SO4 + 10FeSO4 + 2KMnO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
f) 8H+ + 5Fe2+ + ⟶ 5Fe3+ + Mn2+ + 4H2O
Bài 7.7 trang 24 SBT Hoá học 11: Nhiều hộ gia đình thường trữ một số hoá chất như baking soda (NaHCO3), thạch cao nung (CaSO4.0,5H2O) và phèn chua (hay phèn nhôm kali, K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O).
a) Hãy tìm hiểu các ứng dụng của mỗi hoá chất trên tại các hộ gia đình.
b) Có thể dùng nước để phân biệt các mẫu bột mịn của ba chất trên không? Giải thích.
c) Có thể dùng nước và quỳ tím để phân biệt các mẫu bột mịn của ba chất trên không? Giải thích.
Lời giải:
a) Gợi ý:
– Baking soda: làm bánh,…
– Thạch cao nung: đúc tượng,…
– Phèn chua: làm trong nước, tạo môi trường acid nhẹ.
b) Hoà tan một lượng nhỏ mỗi chất trên vào nước, chất không tan là thạch cao. Để yên dung dịch hai chất hoà tan một thời gian, dung dịch nào xuất hiện chất keo là phèn nhôm kali.
Al3+(aq) + H2O(l) ⇌ Al(OH)2+(aq) + H+(aq)
Al(OH)2+(aq) + H2O(l) ⇌ (aq) + H+(aq)
(aq) + H2O(l) ⇌ Al(OH)3(s) + H+(aq)
c) Dùng nước hoà tan các mẫu bột mịn tạo thành dung dịch, thạch cao nung tan khá ít. Có thể dùng quỳ tím để nhận biết nhanh hơn hai dung dịch còn lại, dung dịch làm quỳ hoá xanh là baking soda, hoá đỏ là phèn nhôm kali. Do dung dịch baking soda có quá trình:
(aq) + H2O(l) ⇌ H2CO3(aq) + OH−(aq)
Và dung dịch phèn nhôm kali tạo môi trường acid như đã nêu ở ý b).
Bài 7.8 trang 24, 25 SBT Hoá học 11: Sulfuric acid là một trong những hoá chất quan trọng nhất được sử dụng trong công nghiệp; được sản xuất hàng trăm triệu tấn mỗi năm, chiếm nhiều nhất trong ngành công nghiệp hoá chất. Phương pháp sản xuất sulfuric acid phổ biến nhất là phương pháp tiếp xúc, theo đó acid có thể được điều chế qua các giai đoạn sau:
(1) FeS2(s) + O2(g) Fe2O3(s) + SO2(g)
(2) SO2(g) + O2(g) SO3(g) = −196 kJ
(3) H2SO4(aq) + SO3(g) → H2SO4.nSO3(l)
(4) H2SO4.nSO3(l) + H2O(l) → H2SO4(aq)
a) Cân bằng phương trình hoá học của các phản ứng trên.
b) Theo nguyên lí chuyển dịch cân bằng, phản ứng (2) nên được thực hiện ở nhiệt độ cao hay thấp? Trong thực tế, phản ứng trên được thực hiện ở nhiệt độ khá cao (450oC), hãy giải thích điều này.
c) Người ta dùng sulfuric acid đặc H2SO4(aq) hấp thụ SO3(g) trong phản ứng (3), quá trình này được thực hiện trong tháp tiếp xúc. Cách thực hiện nào sau đây sẽ đạt hiệu quả tiếp xúc tốt nhất?
A. Cho SO3(g) lội qua dung dịch H2SO4(aq).
B. SO3(g) được phun vào từ phía trên tháp, H2SO4(aq) được bơm từ dưới lên.
C. SO3(g) được xả vào từ phía dưới tháp, H2SO4(aq) được phun từ trên xuống.
D. SO3(g) lội qua H2SO4(aq) được khuấy liên tục với tốc độ cao.
d) Để xác định công thức của oleum thu được, người ta pha loãng 8,36 gam oleum vào nước thành 1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ mỗi 10,0 mL dung dịch acid này bằng dung dịch NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,01 mL. Hãy xác định công thức của oleum trên.
Lời giải:
a) (1) 4FeS2(s) + 11O2(g) 2Fe2O3(s) + 8SO2(g)
(2) 2SO2(g) + O2(g) 2SO3(g)
(3)H2SO4(aq) + SO3(g) → H2SO4.nSO3(l)
(4) H2SO4.nSO3(l) + nH2O(l) → (n + 1)H2SO4(aq)
b) Phản ứng (2) toả nhiệt. Để cân bằng chuyển dịch theo chiều tạo ra nhiều sản phẩm hơn (chiều thuận), phản ứng nên được thực hiện ở nhiệt độ thấp. Tuy nhiên, thực tế phản ứng được thực hiện ở nhiệt độ cao nhằm tăng tốc độ phản ứng, tăng hiệu quả tạo thành sản phẩm trong một khoảng thời gian nhất định.
c) Đáp án đúng là: C
Lợi dụng tác dụng của trọng lực, SO3(g) là chất khí, xả vào từ bên dưới sẽ tự khuếch tán lên trên; H2SO4(aq) là chất lỏng được phun dưới dạng sưong roi từ trên xuống ngược chiều với SO3(g) làm tăng hiệu quả tiếp xúc.
d) H2SO4.nSO3(l) + nH2O(l) → (n + 1)H2SO4(aq)
x (n + 1)x (mol)
Số mol H2SO4 trong dung dịch sau pha loãng là: = (n+1)x
⇒ 0,10 = (n + 1). ⇒ n = 4. Vậy công thức của oleum là H2SO4.4SO3.
Bài 7.9 trang 25 SBT Hoá học 11: Trong công nghiệp, chất rắn copper(II) sulfate pentahydrate có thể được sản xuất từ copper(II) oxide theo hai giai đoạn của quá trình:
CuO(s) CuS(aq) CuSO4.5H2O(s)
a) Từ 1 tấn nguyên liệu chứa 96% copper(II) oxide theo khối lượng (còn lại là tạp chất trơ) sẽ thu được bao nhiêu kilôgam copper(II) sulfate pentahydrate rắn? Cho hiệu suất của quá trình là 85%.
b) Một ao nuôi thuỷ sản có diện tích bề mặt nước là 2 000 m2, độ sâu trung bình của nước trong ao là 0,7 m đang có hiện tượng phú dưỡng. Để xử lí tảo xanh có trong ao, người dân cho copper(II) sulfate pentahydrate vào ao trong 3 ngày, mỗi ngày một lần, mỗi lần là 0,25 g cho 1 m3 nước trong ao. Hãy cho biết tổng khối lượng (kg) copper(II) sulfate pentahydrate người dân cần sử dụng.
c) Có thể pha chế dung dịch copper(II) sulfate 10–4 M dùng để diệt một số loại vi sinh vật. Tính số mg copper(II) sulfate pentahydrate cần dùng để pha chế thành 1 L dung dịch copper(II) sulfate 10–4 M.
Lời giải:
a) Khối lượng CuO trong 1 tấn nguyên liệu là: 1 000.96% = 960 (kg).
Theo sơ đồ CuO → CuSO4.5H2O
Khối lượng copper(II) sulfate pentahydrate rắn thu được với hiệu suất 100% là:
.250 = 3 000 (kg).
Khối lượng copper(II) sulfate pentahydrate rắn thu được với hiệu suất 85% là:
3 000. 85% = 2 550 (kg).
b) Thể tích nước trong ao là:
2 000.0,7 = 1 400 (m3).
Khối lượng copper(II) sulfate pentahydrate người dân cần sử dụng là:
1 400.0,25.3 = 1 050 (g) = 1,050 kg.
c) = 10–4.1 = 10–4 (mol).
Vậy khối lượng của CuSO4.5H2O là: 10–4.250 = 0,0250 (g) = 25,0 mg.