Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
ĐỀ CƯƠNG ÔN TẬP THI GIỮA KÌ II MÔN HÓA HỌC 10
LÝ THUYẾT TRẮC NGHIỆM
Câu 1: Các nguyên tử halogen có cấu hình electron lớp ngoài cùng là
A. ns2. B. ns2np3. C. ns2np4. D. ns2np5.
Câu 2: Một chất ở thể rắn, dưới tác dụng của nhiệt độ sẽ chuyển thành hơi, không qua thể lỏng, gọi là hiện tượng thăng hoa. Halogen nào sau đây có tính thăng hoa?
A. Br2. B. Cl2. C. I2. D. F2.
Câu 3: Halogen có tính oxi hóa mạnh nhất là
A. Br2. B. Cl2. C. I2. D. F2.
Câu 4: Trong phản ứng với kim loại, nguyên tử halogen đã nhận hay nhường bao nhiêu electron?
A. Nhận thêm 1 electron. B. Nhận thêm 2 electron.
C. Nhường đi 1 electron. D. Nhường đi 7 electron.
Câu 5: Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen?
A. Ở điều kiện thường là chất khí.
B. Tác dụng mạnh với nước.
C. Vừa có tính oxi hoá, vừa có tính khử.
D. Có tính oxi hoá mạnh.
Câu 6: Khí nào sau đây được dùng để khử trùng cho nước sinh hoạt?
A. CO2. B. O2. C. Cl2. D. N2.
Câu 7: Clo không phản ứng được với dung dịch nào sau đây?
A. NaOH. B. NaCl. C. Ca(OH)2. D. NaBr.
Câu 8: Ở điều kiện thích hợp, clo không phản ứng với chất nào sau đây?
A. Fe. B. O2. C. H2. D. H2O.
Câu 9: Ở điều kiện thường, clo là chất khí, màu vàng lục, có mùi xốc và nặng hơn không khí
A. 1,25 lần. B. 2,45 lần. C. 1,26 lần. D. 2,25 lần.
Câu 10: Ở điều kiện thích hợp, hai khí nào sau đây không phản ứng với nhau?
A. H2 và O2. B. N2 và O2. C. Cl2 và O2. D. SO2 và O2.
Câu 11: Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là:
A. Cl2, H2O. B. HCl, HClO.
C. HCl, HClO, H2O. D. Cl2, HCl, HClO, H2O.
Câu 12: Trong phòng thí nghiệm khí clo thường được điều chế bằng cách oxi hóa hợp chất nào sau đây?
A. NaCl. B. KClO3. C. HCl. D. KMnO4.
Câu 13: Phản ứng nào sau đây được dùng để điều chế clo trong phòng thí nghiệm?
A. 2NaCl 2Na + Cl2.
B. 2NaCl + 2H2O H2 + 2NaOH + Cl2.
C. MnO2 + 4HCl đặc MnCl2 + Cl2 + 2H2O.
D. F2 + 2NaCl ® 2NaF + Cl2.
Câu 14: Chất nào sau đây không tác dụng với dung dịch HCl?
A. Al. B. KMnO4. C. Cu(OH)2. D. Ag.
Câu 15: Dung dịch HCl là tác dụng được với kim loại nào sau đây?
A. Cu. B. Fe. C. Ag. D. Au.
Câu 16: Kim loại nào sau đây tác dụng với khí Cl2 và dung dịch HCl tạo ra cùng một muối là
A. Cu. B. Mg. C. Fe. D. Ag.
Câu 17: Khí HCl có thể được điều chế bằng cách cho tinh thể muối ăn tác dụng với chất nào sau đây?
A. H2SO4 loãng. B. HNO3.
C. H2SO4 đậm đặc. D. NaOH.
Câu 18: Khí HCl khi tan trong nước tạo thành dung dịch axit clohiđric. Axit clohiđric khi tiếp xúc với quỳ tím làm quỳ tím
A. chuyển sang màu đỏ. B. chuyển sang màu xanh.
C. không chuyển màu. D. chuyển sang không màu.
Câu 19: Trong phân tử HCl, giữa hai nguyên tử H và Cl có liên kết
A. cộng hóa trị không cực. B. ion.
C. cộng hóa trị có cực. D. hiđro.
Câu 20: Sục khí clo vào lượng dung dịch NaOH ở nhiệt độ thường, sản phẩm là
A. NaCl, NaClO. B. NaCl, NaClO2.
C. NaCl, NaClO3. D. Chỉ có NaCl.
Câu 21: Clorua vôi là muối của kim loại canxi với hai loại gốc axit là clorua và hipoclorit . Clorua vôi được gọi là muối gì?
A. Muối trung hoà. B. Muối kép.
C. Muối của hai axit. D. Muối hỗn tạp.
Câu 22: Thành phần nước Gia-ven gồm:
A. NaCl, NaClO, Cl2, H2O. B. NaCl, H2O.
C. NaCl, NaClO3, H2O. D. NaCl, NaClO, H2O.
Câu 23: Cho phản ứng hóa học Cl2 + Ca(OH)2 CaOCl2 + H2O. Phản ứng này thuộc loại phản ứng
A. oxi hóa – khử. B. trao đổi. C. trung hòa. D. hóa hợp.
Câu 24: Trong phòng thí nghiệm nước Gia-ven được điều chế bằng cách:
A. Cho khí clo tác dụng với nước.
B. Cho khí clo tác dụng với dung dịch Ca(OH)2.
C. Cho khí clo sục vào dung dịch NaOH loãng.
D. Cho khí clo vào dung dịch KOH loãng rồi đun nóng 100oC.
Câu 25: Ứng dụng nào sau đây không phải là của clorua vôi?
A. Xử lí các chất độc. B. Tẩy trắng sợi, vải, giấy.
C. Tẩy uế chuồng trại chăn nuôi. D. Sản xuất vôi.
Câu 26: Trong hợp chất, flo có số oxi hóa là
A. 0. B. +1. C. -1. D. +3.
Câu 27: Chất nào sau đây chỉ có tính oxi hoá, không có tính khử?
A. F2. B. Cl2. C. Br2. D. I2.
Câu 28: Hỗn hợp khí nào sau đây không tồn tại ở nhiệt độ thường?
A. H2 và F2. B. Cl2 và O2. C. H2S và N2. D. CO và O2.
Câu 29: Phản ứng giữa hiđro và chất nào sau đây là phản ứng thuận nghịch?
A. Flo. B. Clo. C. Iot. D. Brom.
Câu 30: Khí nào sau đây có khả năng làm mất màu nước brom?
A. N2. B. CO2. C. H2. D. SO2.
Câu 31: Hóa chất nào sau đây không được đựng bằng lọ thủy tinh?
A. HNO3. B. HF. C. HCl. D. NaOH.
Câu 32: Muối iot là muối ăn có chứa thêm lượng nhỏ iot ở dạng
A. I2. B. MgI2. C. CaI2. D. KI hoặc KIO3.
Câu 33: Dung dịch nào sau đây không phản ứng với dung dịch AgNO3?
A. NaCl. B. NaF. C. CaCl2. D. NaBr.
Câu 34: Phản ứng nào sau đây xảy ra không tạo muối FeCl2?
A. Fe + HCl. B. Fe3O4 + HCl. C. Fe + Cl2. D. Fe + FeCl3.
Câu 35: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm oxi là
A. ns2np4. B. ns2np5. C. ns2np3. D. ns2np6.
Câu 36: X2 là chất khí, không màu, không mùi, nặng hơn không khí. X là khí
A. N2. B. O2. C. Cl2. D. Ar.
Câu 37: Chất khí màu xanh nhạt, có mùi đặc trưng là
A. Cl2. B. SO2. C. O3. D. H2S.
Câu 38: Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây?
A. Oxi. B. Lưu huỳnh. C. Clo. D. Flo.
Câu 39: Chất nào sau đây không phản ứng với O2 là
A. SO3. B. P. C. Ca. D. C2H5OH.
Câu 40: Oxi tác dụng với tất cả các chất trong nhóm nào dưới đây?
A. Mg, Cl2. B. Al, N2. C. Ca, F2. D. Au, S.
Câu 41: Ứng dụng nào sau đây không phải của ozon?
A. Tẩy trắng tinh bột, dầu ăn.
B. Điều chế oxi trong phòng thí nghiệm.
C. Sát trùng nước sinh hoạt.
D. Chữa sâu răng.
Câu 42: Trong sản xuất, oxi được dùng nhiều nhất
A. Để làm nhiên liệu tên lửa. B. Để luyện thép.
C. Trong công nghiệp hoá chất. D. Để hàn, cắt kim loại.
Câu 43: Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
A. Na. B. Cl. C. O. D. S.
Câu 44: Đơn chất vừa có tính oxi hóa vừa có tính khử là
A. F2. B. O3. C. S. D. O2.
Câu 45: Ở nhiệt độ thường, lưu huỳnh phản ứng với kim loại nào sau đây?
A. Hg. B. Fe. C. Cu. D. Al.
Câu 46: Số oxi hóa có thể có của lưu huỳnh trong hợp chất là
A. 0, 2, 4, 6. B. -2, 0, +4, +6.
C. 1, 3, 5, 7. D. -2, +4, +6.
Câu 47: Câu nào sau đây đúng khi nói về tính chất hoá học của lưu huỳnh?
A. Lưu huỳnh không có tính oxi hoá, tính khử.
B. Lưu huỳnh chỉ có tính oxi hoá.
C. Lưu huỳnh có tính oxi hoá và tính khử.
D. Lưu huỳnh chỉ có tính khử.
Câu 48: Công thức phân tử của clorua vôi là
A. Cl2.CaO. B. CaOCl2.
C. Ca(OH)2 và CaO. D. CaCl2.
Câu 49: Câu nào sau đây không đúng?
A. Các halogen là những phi kim mạnh nhất trong mỗi chu kỳ.
B. Khả năng oxi hoá của các halogen giảm từ flo đến iot.
C. Trong các hợp chất, các halogen đều có thể có số oxi hoá: –1, +1, +3, +5, +7.
D. Các halogen có nhiều điểm giống nhau về tính chất hoá học.
Câu 50: Hãy chỉ ra mệnh đề không đúng?
A. Tất cả muối AgX (X là halogen) đều không tan trong nước.
B. Ở điều kiện thường, tất cả các hiđro halogenua đều tồn tại ở thể khí.
C. Tất cả các hiđro halogenua khi tan vào nước đều cho dung dịch axit.
D. Các halogen (từ F2 đến I2) tác dụng trực tiếp với hầu hết các kim loại.
Câu 51: Trong phản ứng: Cl2 + H2O ![]() HCl + HClO, clo đóng vai trò gì?
HCl + HClO, clo đóng vai trò gì?
A. Chất tan. B. Chất khử.
C. Vừa là chất oxi hóa, vừa là chất khử. D. Chất oxi hóa.
Câu 52: Cho các phản ứng sau:
4HCl + MnO2 -> MnCl2 + Cl2 + 2H2O
2HCl + Fe -> FeCl2 + H2
14HCl + K2Cr2O7 -> 2KCl + 2CrCl3 + 3Cl2 + 7H2O
6HCl + 2Al -> 2AlCl3 + 3H2
16HCl + 2KMnO4 -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
A. 2. B. 1. C. 4. D. 3.
Câu 53: Trong phòng thí nghiệm, Cl2 thường được điều chế theo phản ứng:
HCl đặc + KMnO4 -> KCl + MnCl2 + Cl2 + H2O
Hệ số cân bằng của HCl là
A. 4. B. 8. C. 10. D. 16.
Câu 54: Cho các phản ứng sau :
(a) 4HCl + PbO2 -> PbCl2 + Cl2 + 2H2O;
(b) HCl + NH4HCO3 -> NH4Cl + CO2 + H2O;
(c) 2HCl + 2HNO3 -> 2NO2 + Cl2 + 2H2O;
(d) 2HCl + Zn -> ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2. B. 4. C. 1. D. 3.
Câu 55: Dãy các chất nào sau đây đều tác dụng với axit clohiđric?
A. Fe2O3, KMnO4, Cu, Fe, AgNO3. B. Fe, CuO, H2SO4, Ag, Mg(OH)2.
C. KMnO4, Cu, Fe, H2SO4, Mg(OH)2. D. Fe2O3, KMnO4, Fe, CuO, AgNO3.
Câu 56: Trong các phản ứng sau, phản ứng nào sai?
A. Zn + 2HCl -> ZnCl2 + H2. B. Cu + 2HCl -> CuCl2 + H2.
C. CuO + 2HCl -> CuCl2 + H2O. D. AgNO3 + HCl -> AgCl + HNO3.
Câu 57: Phản ứng hóa học nào không đúng?
A. NaCl (rắn) + H2SO4 (đặc) -> NaHSO4 + HCl.
B. 2NaCl (rắn) + H2SO4 (đặc) -> Na2SO4 + 2HCl.
C. 2NaCl (loãng) + H2SO4 (loãng) -> Na2SO4 + 2HCl.
D. H2 + Cl2 -> 2HCl.
Câu 58: Cho sơ đồ chuyển hoá: ![]()
(mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là:
A. NaCl, Cu(OH)2. B. HCl, NaOH.
C. Cl2, NaOH. D. HCl, Al(OH)3.
Câu 59: Phát biểu nào sau đây là sai?
A. Clo có bán kính nguyên tử lớn hơn flo.
B. Brom có độ âm điện lớn hơn iot.
C. Trong dãy HX (X là halogen), tính axit giảm dần từ HF đến HI.
D. Trong dãy HX (X là halogen), tính khử tăng dần từ HF đến HI.
Câu 60: Trong các phản ứng hoá học sau, brom đóng vai trò gì?
(1) SO2 + Br2 + 2H2O -> H2SO4 + 2HBr
(2) H2S + 4Br2 + 4H2O -> H2SO4 + 8HBr
A. Vừa là chất oxi hoá, vừa là chất khử.
B. Chất oxi hoá.
C. Chất khử.
D. Không là chất oxi hoá, không là chất khử.
Câu 61: Những hiđro halogenua có thể thu được khi cho H2SO4 đặc lần lượt tác dụng với các muối NaF, NaCl, NaBr, NaI là
A. HF, HCl, HBr, HI.
B. HF, HCl, HBr và một phần HI.
C. HF, HCl, HBr.
D. HF, HCl.
Câu 62: Trong muối NaCl có lẫn NaBr và NaI. Để loại hai muối này ra khỏi NaCl người ta có thể
A. Sục từ từ khí Cl2 cho đến dư vào dung dịch sau đó cô cạn dung dịch.
B. Tác dụng với dung dịch HCl đặc.
C. Tác dụng với Br2 dư sau đó cô cạn dung dịch.
D. Tác dụng với AgNO3 sau đó nhiệt phân kết tủa.
Câu 63: Các chất trong nhóm nào sau đây đều tác dụng với dung dịch HCl?
A. Quỳ tím, SiO2, Fe(OH)3, Zn, Na2CO3.
B. Quỳ tím, CuO, Cu(OH)2, Zn, Na2CO3.
C. Quỳ tím, CaO, NaOH, Ag, CaCO3.
D. Quỳ tím, FeO, NH3, Cu, CaCO3.
Câu 64: Cho các chất sau: KOH (1), Zn (2), Ag (3), Al(OH)3 (4), KMnO4 (5), K2SO4 (6). Axit HCl tác dụng được với các chất:
A. (1), (2), (4), (5). B. (3), (4), (5), (6).
C. (1), (2), (3), (4). D. (1), (2), (3), (5).
Câu 65: Dùng loại bình nào sau đây để đựng dung dịch HF?
A. Bình thuỷ tinh màu xanh. B. Bình thuỷ tinh mầu nâu.
C. Bình thuỷ tinh không màu. D. Bình nhựa teflon (chất dẻo).
Câu 66: Khẳng định nào sau đây về phản ứng H2S + 4Cl2 + 4H2O H2SO4 + 8HCl là đúng?
A. H2S là chất khử, H2O là chất oxi hoá.
B. Cl2 là chất oxi hoá, H2O là chất khử.
C. H2S là chất oxi hoá, Cl2 là chất khử.
D. Cl2 là chất oxi hoá, H2S là chất khử.
Câu 67: Phát biểu nào sau đây không đúng?
A. Flo có tính oxi hoá mạnh hơn clo.
B. Dung dịch HF hoà tan được SiO2.
C. Muối AgI không tan trong nước, muối AgF tan trong nước.
D. Trong các hợp chất, ngoài số oxi hoá -1, flo và clo còn có số oxi hoá +1, +3, +5, +7.
Câu 68: Cho các mệnh đề sau:
(a) Các halogen đều có số oxi hóa dương trong một số hợp chất.
(b) Halogen đứng trước đẩy được halogen đứng sau ra khỏi dung dịch muối.
(c) Các halogen đều tan được trong nước.
(d) Các halogen đều tác dụng được với hiđro.
Số mệnh đề sai là
A. 3. B. 2. C. 4. D. 1.
Câu 69: Chọn phát biểu sai:
A. Axit clohiđric vừa có tính khử vừa có tính oxi hoá.
B. Dung dịch axit clohiđric có tính axit mạnh.
C. Cu hòa tan trong dung dịch axit clohiđric khi có mặt O2.
D. Fe hòa tan trong dung dịch axit clohiđric tạo muối FeCl3.
Câu 70: Cho các phản ứng:
Ca(OH)2 + Cl2 -> CaOCl2 + H2O
2H2S + SO2 -> 3S + 2H2O
O3 -> O2 + O
2NO2 + 2NaOH -> NaNO3 + NaNO2 + H2O
4KClO3 -> KCl + 3KClO4
Số phản ứng oxi hoá – khử là
A. 5. B. 2. C. 3. D. 4.
Câu 71: Phát biểu nào sau đây sai?
A. Oxi là nguyên tố phi kim có tính oxi hóa mạnh.
B. Ozon có tính oxi hóa mạnh hơn oxi.
C. Oxi có số oxi hóa –2 trong mọi hợp chất.
D. Oxi là nguyên tố phổ biến nhất trên trái đất.
Câu 72: Cho các phương trình hóa học sau:
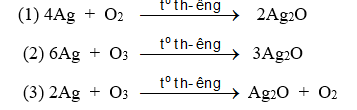
Số phương trình đúng là
A. 1. B. 3. C. 2. D. 4.
Câu 73: Ở điều kiện thích hợp, lưu huỳnh tác dụng được với các chất trong dãy nào sau đây?
A. Hg, O2, HCl. B. Pt, Cl2, KClO3.
C. Zn, O2, F2. D. Na, Br2, H2SO4 loãng.
Câu 74: Phản ứng hóa học nào sau đây không đúng?
A. Mg + S ![]() MgS.
MgS.
B. C2H5OH + 3O2 ![]() 2CO2 + 3H2O.
2CO2 + 3H2O.
C. 2Cl2 + 7O2 ![]() 2Cl2O7.
2Cl2O7.
D. 4P + 5O2 ![]() 2P2O5.
2P2O5.
Câu 75: Cho phản ứng hóa học: S + H2SO4 đặc ![]() X + H2O. Vậy X là chất nào sau đây?
X + H2O. Vậy X là chất nào sau đây?
A. SO2. B. H2S. C. H2SO3. D. SO3.
Câu 76: Kết luận gì có thể rút ra được từ 2 phản ứng sau:
H2 + S ![]() H2S (1)
H2S (1)
S + O2 ![]() SO2 (2)
SO2 (2)
A. S chỉ có tính khử.
B. S chỉ có tính oxi hóa.
C. S vừa có tính khử, vừa có tính oxi hóa.
D. S chỉ tác dụng với các phi kim.
Câu 77: Lưu huỳnh tác dụng với dung dịch kiềm nóng theo phản ứng sau:
S + KOH -> K2S + K2SO3 + H2O
Tỉ lệ số nguyên tử lưu huỳnh bị oxi hóa và số nguyên tử lưu huỳnh bị khử là
A. 2 : 1. B. 1 : 2. C. 1 : 3. D. 2 : 3.
BÀI TẬP TRẮC NGHIỆM
Câu 78: Cho 5,4 gam Al tác dụng hết với khí Cl2 (dư), thu được m gam muối. Giá trị của m là
A. 12,5. B. 25,0. C. 19,6. D. 26,7.
Câu 79: Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam muối. Giá trị của m là
A. 2,24. B. 2,80. C. 1,12. D. 0,56.
Câu 80: Đốt 3,36 gam kim loại M trong khí quyển clo, thu được 9,75 gam muối clorua. Kim loại M là
A. Cu. B. Zn. C. Fe. D. Al.
Câu 81: Thể tích của dung dịch NaOH 1M cần dùng để tác dụng hoàn toàn với 1,12 lít khí Cl2 (đktc) là
A. 0,2 lít. B. 0,3 lít. C. 0,4 lít. D. 0,1 lít.
Câu 82: Lượng clo thu được khi điện phân 200 gam dung dịch NaCl 35,1% sẽ tác dụng hết với bao nhiêu gam sắt?
A. 22,4 gam. B. 24,2 gam. C. 24 gam. D. 23 gam.
Câu 83: Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư, thu được bao nhiêu V lít khí Cl2 (đktc).Giá trị của V là
A. 4,48 lít. B. 6,72 lít. C. 17,92 lít. D. 13,44 lít.
Câu 84: Để chuyển 11,2 gam Fe thành FeCl3 thì thể tích khí clo (đktc) cần dùng là
A. 8,96 lít. B. 3,36 lít. C. 6,72 lít. D. 2,24 lít.
Câu 85: Cho 5,4 gam Al tác dụng hết với khí Cl2 (dư), thu được m gam muối. Giá trị của m là
A. 12,5. B. 25,0. C. 19,6. D. 26,7.
Câu 86: Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
A. 51. B. 5,1. C. 153. D. 15,3.
Câu 87: Để trung hòa 20 ml dung dịch HBr 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x là
A. 0,3. B. 0,4. C. 0,2. D. 0,1.
Câu 88: Để trung hoà 200 ml dung dịch NaOH 1,5M thì thể tích dung dịch HCl 0,5M cần dùng là bao nhiêu?
A. 0,5 lít. B. 0,4 lít. C. 0,3 lít. D. 0,6 lít.
Câu 89: Cho 50 gam CaCO3 tác dụng vừa đủ với dung dịch HCl 20% (d=1,2g/ml). Khối lượng dung dịch HCl đã dùng là
A. 152,08 gam. B. 55,0 gam. C. 180 gam. D. 182,5 gam.
Câu 90: Cho 26,5 gam M2CO3 tác dụng với một lượng dư dung dịch HCl. Sau phản ứng thu được 5,6 lít khí (đktc). Kim loại M là
A. Na. B. K. C. Li. D. Rb.
Câu 91: Cho 0,3 gam một kim loại X có hóa trị II tác dụng với dung dịch HBr dư, thu được 0,28 lít H2 (đktc). Kim loại X là
A. Ba B. Ca. C. Mg. D. Sr.
Câu 92: Cho dung dịch BaCl2 dư tác dụng với dung dịch AgNO3 2M, thu được 28,7 gam kết tủa. Thể tích dung dịch AgNO3 đã dùng là
A. 150 ml. B. 80 ml. C. 200 ml. D. 100 ml.
Câu 93: Oxi hoá hoàn toàn m gam hỗn hợp X gồm Cu và Al có tỉ lệ mol 1:1, thu được 13,1 gam hỗn hợp Y gồm các oxit. Giá trị của m là
A. 7,4. B. 8,7. C. 9,1. D. 10.
Câu 94: Đốt cháy hoàn toàn 13 gam một kim loại M hóa trị II trong oxi dư đến khối lượng không đổi, thu được 16,2 gam chất rắn X. Kim loại M là
A. Zn. B. Fe. C. Cu. D. Ca.
Câu 95: Tỉ khối của hỗn hợp X gồm oxi và ozon đối với He bằng 10,4. Thành phần phần trăm về thể tích của oxi trong hỗn hợp X là
A. 25%. B. 60%. C. 40%. D. 75%.
Câu 96: Nhiệt phân 55,3 gam KMnO4, sau một thời gian phản ứng thu được V lít khí O2 (đktc). Giá trị lớn nhất của V có thể là
A. 7,84. B. 3,36. C. 3,92. D. 6,72.
Câu 97: Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư, thu được 53,4 gam muối clorua. Kim loại M là
A. Mg. B. Al. C. Fe. D. Zn.
Câu 98: Cho một luồng khí clo dư tác dụng với 9,2 gam kim loại sinh ra 23,4 gam muối kim loại hoá trị I. Công thức của muối là
A. NaCl. B. KCl. C. LiCl. D. RbCl.
Câu 99: Cho 1,12 lít khí clo (đktc) vào dung dịch NaOH 0,5M. Sau khi phản ứng kết thúc, thể tích dung dịch NaOH cần dùng là
A. 0,1 lít. B. 0,15 lít. C. 0,2 lít. D. 0,25 lít.
Câu 100: Cho lượng dư dung dịch AgNO3 tác dụng với 100 ml dung dịch hỗn hợp NaF 0,05M và NaCl 0,1M. Khối lượng kết tủa thu được là
A. 1,345 gam. B. 3,345 gam. C. 2,875 gam. D. 1,435 gam.
Câu 101: Hoà tan hoàn toàn 10,05 gam hỗn hợp hai muối cacbonat kim loại hoá trị II và III vào dung dịch HCl, thu được dung dịch X và 0,672 lít khí (đktc). Khối lượng muối trong X là
A. 10,38 gam. B. 20,66 gam. C. 30,99 gam. D. 9,32 gam.
Câu 102: Chất X là muối canxi halogenua. Cho dung dịch X chứa 0,200 gam X tác dụng với dung dịch AgNO3 dư, thu được 0,376 gam kết tủa bạc halogenua. Công thức X là
A. CaCl2. B. CaBr2. C. CaI2. D. CaF2.
Câu 103: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 8,96 lít. B. 6,72 lít. C. 17,92 lít. D. 11,2 lít.
Câu 104: Hàng năm, thế giới cần tiêu thụ khoảng 46 triệu tấn clo. Nếu lượng clo chỉ được điều chế từ muối ăn NaCl thì cần ít nhất bao nhiêu tấn muối?
A. 7,7 triệu tấn. B. 77 triệu tấn. C. 7,58 triệu tấn. D. 75,8 triệu tấn.
Câu 105: Nung 17,55 gam NaCl với H2SO4 đặc, dư thu được bao nhiêu lít khí ở điều kiện tiêu chuẩn (biết hiệu suất của phản ứng là H= 90%)?
A. 0,672 lít. B. 6,72 lít. C. 6,048 lít. D. 5,6 lít.
Câu 106: Hòa tan hoàn toàn 20 gam hỗn hợp Mg và Fe bằng dung dịch HCl dư. Sau phản ứng thu được 11,2 lít khí (đktc) và dung dịch X. Cô cạn dung dịch X thì thu được bao nhiêu gam muối khan?
A. 55,5 gam. B. 91,0 gam. C. 90,0 gam. D. 71,0 gam.
Câu 107: Cho 6,05 gam hỗn hợp X gồm Fe và Zn phản ứng hoàn toàn với dung dịch HCl loãng (dư), thu được 0,1 mol khí H2. Khối lượng của Fe trong 6,05 gam X là
A. 1,12 gam. B. 2,80 gam. C. 4,75 gam. D. 5,60 gam.
Câu 108: Hoà tan hoàn toàn 3,80 gam hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp trong dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Hai kim loại kiềm đó là
A. Li và Na. B. Na và K. C. Rb và Cs. D. K và Rb.
Câu 109: Đốt cháy hết 13,6 gam hỗn hợp Mg, Fe trong bình khí clo dư, sau phản ứng thấy thể tích khí clo giảm 8,96 lít (đktc). Khối lượng muối clorua khan thu được là
A. 65,0 gam. B. 38,0 gam. C. 50,8 gam. D. 42,0 gam.
Câu 110: Cho m gam hỗn hợp Zn, Fe tác dụng với vừa đủ với 73 gam dung dịch HCl 10%. Cô cạn dung dịch thu được 13,15 gam muối. Giá trị m là
A. 7,05. B. 5,3. C. 4,3. D. 6,05.
Câu 111: Hòa tan hoàn toàn 20,6 gam hỗn hợp gồm Na2CO3 và CaCO3 bằng dung dịch HCl dư, thu được V lít khí CO2 (đktc) và dung dịch chứa 22,8 gam hỗn hợp muối. Giá trị của V là
A. 2,24. B. 4,48. C. 1,79. D. 5,6.
Câu 112: Cho hỗn hợp muối MgCO3 và CaCO3 tan trong dung dịch HBr vừa đủ, thu được 2,24 lít khí (đktc). Số mol muối cacbonat ban đầu là
A. 0,15 mol. B. 0,2 mol. C. 0,1 mol. D. 0,3 mol.
Câu 113: Hòa tan m gam Zn bằng dung dịch HBr vừa đủ, thu được dung dịch Y. Cô cạn dung dịch Y thu được 33,75 gam muối khan. Giá trị của m là
A. 6,5. B. 9,75. C. 13. D. 16,25.
Câu 114: Sục khí clo vào dung dịch chứa NaBr và NaI đến khi phản ứng hoàn toàn, thu được 1,17 gam NaCl. Số mol hỗn hợp NaBr và NaI có trong dung dịch đầu là
A. 0,02 mol. B. 0,01 mol. C. 0,03 mol. D. 0,04.
Câu 115: Hòa tan hoàn toàn m gam hỗn hợp Zn và ZnO cần dùng 100,8 ml dung dịch HCl 36,5% (D = 1,19 g/ml), thu được 8,96 lít khí (đktc). Thành phần phần trăm ZnO trong hỗn hợp ban đầu là
A. 38,4%. B. 60,9%. C. 86,52%. D. 39,1%.
Câu 116: Khi cho 100 ml dung dịch KOH 1M vào 100 ml dung dịch HCl thì phản ứng xảy ra vừa đủ. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 1,0M. B. 0,25M. C. 0,5M. D. 0,75M.
Câu 117: Hòa tan hoàn toàn 8,45 gam một kim loại M bằng dung dịch HCl. Cô cạn dung dịch sau phản ứng được 17,68 gam muối khan. Kim loại M là
A. Al. B. Zn. C. K. D. Ca.
Câu 118: Cho 8,8 gam một hỗn hợp gồm hai kim loại kiềm thổ ở hai chu kì liên tiếp tác dụng với dung dịch HCl dư thu được 6,72 lít khí H2 (ở đktc). Hai kim loại đó là
A. Ca và Sr. B. Be và Mg. C. Mg và Ca. D. Sr và Ba.
Câu 119: Nung một hỗn hợp gồm 4,8 gam bột Magie và 3,2 gam bột lưu huỳnh trong một ống nghiệm đậy kín. Khối lượng chất rắn thu được sau phản ứng là
A. 8,0 gam. B. 11,2 gam. C. 5,6 gam. D. 4,8 gam.
Câu 120: Khi nung nóng hỗn hợp bột gồm 9,6 gam lưu huỳnh và 22,4 gam sắt trong ống nghiệm kín, không chứa không khí, sau khi phản ứng hoàn toàn thu được rắn Y. Thành phần của rắn Y là
A. Fe. B. Fe và FeS. C. FeS. D. S và FeS.
Câu 121: Đốt cháy hoàn toàn 4,8 gam lưu huỳnh thành lưu huỳnh đioxit thì cần vừa đủ V lít không khí (đktc), biết trong không khí thì oxi chiếm 20% thể tích. Giá trị của V là
A. 17,8. B. 18,8. C. 15,8. D. 16,8.
Câu 122: Hoà tan hoàn toàn 7,8 gam hỗn hợp Mg và Al bằng dung dịch HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng thêm 7,0 gam so với ban đầu. Số mol axit đã tham gia phản ứng là
A. 0,8 mol. B. 0,08 mol. C. 0,04 mol. D. 0,4 mol.
Câu 123: Hoà tan hoàn toàn 25,12 gam hỗn hợp Mg, Al, Fe trong dung dịch HCl dư, thu được 13,44 lít khí H2 (đktc) và m gam muối. Giá trị của m là
A. 67,72. B. 46,42. C. 68,92 D. 47,02.
Câu 124: Cho 9,14 gam hỗn hợp gồm Mg, Al, Cu bằng dung dịch HCl dư, thu được 7,84 lít khí (đktc), dung dịch X và 2,54 gam chất rắn Y. Khối lượng muối trong X là
A. 32,15 gam. B. 31,45 gam. C. 33,25 gam. D. 30,35gam.
Câu 125: Cho 11,2 lít (đktc) hỗn hợp khí X gồm clo và oxi phản ứng vừa hết với 16,98 gam hỗn hợp Y gồm magie và nhôm, thu được 42,34 gam hỗn hợp các muối clorua và oxit hai kim loại. Phần trăm khối lượng của magie và nhôm trong hỗn hợp Y là
A. 48% và 52%. B. 77,74% và 22,26%.
C. 43,15% và 56,85%. D. 75% và 25%.
Câu 126: Cho 3 lít Cl2 tác dụng với 2 lít H2, hiệu suất phản ứng là 80%. Biết các thể tích khí được đo ở cùng điều kiện nhiệt độ và áp suất. Phần trăm thể tích Cl2 trong hỗn hợp khí sau phản ứng là
A. 28%. B. 64%. C. 60%. D. 8%.
Câu 127: Điều chế Cl2 theo phương trình sau: MnO2 + 4HCl MnCl2 + Cl2 + 2H2O. Thể tích khí clo thu được (đktc) khi cho 25 ml dung dịch HCl 8M tác dụng với một lượng dư MnO2 là
A. 5,6 lít. B. 8,4 lít. C. 11,2 lít. D. 16,8 lít.
Câu 128: Hỗn hợp khí X gồm clo và oxi. X phản ứng vừa hết với một hỗn hợp gồm 4,8 gam magie và 8,1 gam nhôm, thu được 37,05 gam hỗn hợp các muối clorua và oxit hai kim loại. Phần trăm thể tích của oxi và clo trong hỗn hợp X là:
A. 26,5% và 73,5%. B. 45% và 55%.
C. 44,44% và 55,56%. D. 25% và 75%.
Câu 129: Cho 10 lít H2 và 6,72 lít Cl2 tác dụng với nhau rồi hoà tan sản phẩm vào 385,4 gam nước, thu được dung dịch X. Lấy 50 gam dung dịch X tác dụng với dung dịch AgNO3 dư, thu được 7,175 gam kết tủa. Biết các thể tích khí đo ở điều kiện tiêu chuẩn. Hiệu suất phản ứng giữa H2 và Cl2 là
A. 33,33%. B. 45%. C. 50%. D. 66,67%.
Câu 130: Hoà tan hoàn toàn 28,4 gam hỗn hợp 3 kim loại hoá trị I và II bằng dung dịch HCl, thu được dung dịch X và V lít khí (đktc). Cô cạn dung dịch X thu được 49,7 gam hỗn hợp muối khan. Giá trị của V là
A. 8,96. B. 5,6. C. 6,72. D. 3,36.
Câu 131: Cho 0,03 mol hỗn hợp NaX và NaY (X, Y là hai halogen thuộc chu kì kế tiếp) tác dụng với lượng dư dung dịch AgNO3, thu được 4,75 gam kết tủa. Công thức hai muối trên là:
A. NaBr, NaI. B. NaF, NaCl. C. NaCl, NaBr. D. NaCl, NaI.
Câu 132: Đốt cháy hỗn hợp X gồm 3 kim loại Mg, Zn, Cu thu được 34,5 gam hỗn hợp rắn Y gồm các oxit kim loại. Để hòa tan hết hỗn hợp Y cần dùng vừa đủ dung dịch chứa 0,8 mol HCl. Khối lượng hỗn hợp X là
A. 31,3 gam. B. 24,9 gam. C. 21,7 gam. D. 28,1 gam.
Câu 133: Hỗn hợp X gồm Mg, MgO, Ca và CaO. Hòa tan 10,72 gam X vào dung dịch HCl vừa đủ thu được 3,248 lít khí (đktc) và dung dịch Y. Trong Y có 12,35 gam MgCl2 và m gam CaCl2. Giá trị m là
A. 33,3. B. 15,54. C. 13,32. D. 19,98.
Câu 134: Để cháy hoàn toàn hỗn hợp X gồm 3,84 gam Mg và 4,32 gam Al cần 5,824 lít hỗn hợp khí Y (đktc) gồm O2 và Cl2. Tính phần trăm thể tích Cl2 trong hỗn hợp Y?
A. 46,15%. B. 56,36%. C. 43,64%. D. 53,85%.
Câu 135: Đổ dung dịch chứa 2 gam HBr vào dung dịch chứa 2 gam NaOH. Sau đó nhúng giấy quỳ tím vào dung dịch thu được thì giấy quỳ tím chuyển sang màu gì?
A. Màu đỏ. B. Màu xanh.
C. Không đổi màu. D. Màu vàng.
Câu 136: Sục khí clo dư vào dung dịch chứa muối NaBr và KBr, thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam. Lượng clo đã tham gia phản ứng với hai muối trên là
A. 0,1 mol. B. 0,05 mol. C. 0,02 mol. D. 0,01 mol.
Câu 137: Cho 6 gam brom có lẫn tạp chất clo vào một dung dịch chứa 1,6 gam NaBr, thu được dung dịch X. Cô cạn dung dịch X, thu được 1,36 gam chất rắn khan. Hàm lượng phần trăm của clo trong 6 gam brom nói trên là
A. 2,19%. B. 3,19%. C. 4,19%. D. 1,19%.
Câu 138: Cho 0,03 mol hỗn hợp 2 muối NaX và NaY (X, Y là 2 halogen thuộc 2 chu kì liên tiếp) tác dụng với AgNO3 dư, thu được 4,75 gam kết tủa. X và Y là
A. F và Cl. B. Cl và Br. C. Br và I. D. I và At.
Câu 139: Hoà tan 8,075 gam hỗn hợp gồm NaX và NaY (X, Y là hai halogen kế tiếp) vào nước, thu được dung dịch Z. Cho Z phản ứng vừa đủ với dung dịch AgNO3, thu được 16,575 gam kết tủa. Phần trăm khối lượng của NaX và NaY lần lượt là:
A. 36,22% và 63,88%. B. 35,45% và 64,55%.
C. 35% và 65%. D. 34, 24% và 65,76%.
Câu 140: Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaY trong hỗn hợp ban đầu là
A. 52,8%. B. 58,2%. C. 47,2%. D. 41,8%.
Câu 141: Cho 37,6 gam hỗn hợp gồm CaO, CuO và Fe2O3 tác dụng vừa đủ với 0,6 lít dung dịch HCl 2M, rồi cô cạn dung dịch sau phản ứng thì số gam muối khan thu được là
A. 80,2. B. 70,6. C. 49,3 D. 61,0.
Câu 142: Cho 26,6 gam hỗn hợp KCl và NaCl hòa tan vào nước để được 500 gam dung dịch. Cho dung dịch trên tác dụng vừa đủ với AgNO3, thu được 57,4 gam kết tủa. Thành phần phần trăm theo khối lượng của KCl và NaCl trong hỗn hợp đầu là:
A. 56% và 44%. B. 60% và 40%. C. 70% và 30%. D. 65% và 35%.
Câu 143: Cho 2,7 gam hỗn hợp X gồm Al, Fe và Mg phản ứng hết với O2 dư, thu được 4,14 gam hỗn hợp Y gồm 3 oxit. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 0,3M. Giá trị của V là
A. 0,30. B. 0,15. C. 0,60. D. 0,12.
Câu 144: Hỗn hợp khí X gồm ozon và oxi có tỉ khối đối với hiđro bằng 18. Phần trăm theo thể tích mỗi khí trong hỗn hợp X lần lượt là:
A. 25% và 75%. B. 30% và 70%.
C. 35% và 65%. D. 40% và 60%.
Câu 145: Phóng điện qua O2 được hỗn hợp khí có khối lượng mol trung bình là 33 gam/mol. Hiệu suất của phản ứng ozon hóa là
A. 7,09%. B. 9,09%. C. 11,09%. D. 13,09%.
Câu 146: Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 20. Để đốt cháy hoàn toàn 4,48 lít khí CH4 cần V lít hỗn hợp khí X. Các khí đo ở điều kiện tiêu chuẩn. Giá trị của V là
A. 3,584. B. 4,480. C. 8,960. D. 7,168.
Câu 147: Nung 316 gam KMnO4 sau một thời gian, thấy còn lại 300 gam chất rắn. Hiệu suất phản ứng nhiệt phân là
A. 25%. B. 30%. C. 40%. D. 50%.
Câu 148: Nhiệt phân hoàn toàn 24,5 gam muối vô cơ X thấy thoát ra 6,72 lít O2 (đktc), phần rắn còn lại chứa 52,35% kali và 47,65% clo. Công thức phân tử của muối X là
A. KClO. B. KClO2. C. KClO3. D. KClO4.
Câu 149: Đốt cháy hoàn toàn m gam cacbon trong V lít khí oxi dư (đktc), thu được hỗn hợp khí X có tỉ khối đối với oxi là 1,25. Thành phần phần trăm theo thể tích của CO2 trong hỗn hợp X là
A. 75,00%. B. 66,67%. C. 33,33%. D. 25,00%.
Xem thêm