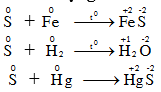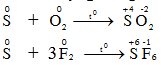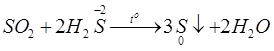Mời các quý thầy cô cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Tiết 52-57: Lưu huỳnh và hợp chất của lưu huỳnh.
A. Lưu huỳnh
I. Mục tiêu
1. Về kiến thức
a. Kiến thức:
– Hs trình bày được vị trí, cấu hình electron lớp electron ngoài cùng của nguyên tử lưu huỳnh.
– HS mô tả được hai dạng thù hình phổ biến.
– HS trình bày được ứng dụng và sản xuất lưu huỳnh.
– HS giải thích được vì sao lưu huỳnh vừa có tính oxi hoá và tính khử?
– HS viết các PTHH chứng minh tính oxi hoá mạnh của lưu huỳnh.
– HS giải thích được một số hiện tượng vật lý, hoá học liên quan đến lưu huỳnh.
b. Về kỹ năng:
– Viết thành thạo cấu hình electron của nguyên tử.
– Dự đoán tính chất, kiểm tra. kết luận được về tính chất hoá học của lưu huỳnh.
– Luyện khả năng học tập, tư duy theo phương pháp quan sát, nhận xét, suy luận logic.
– Tính khổi lượng lưu huỳnh, hợp chất của lưu huỳnh tham gia và tạo thành trong phản ứng.
c. Về tình cảm, thái độ:
– Giúp HS hiểu được tầm quan trọng của lưu huỳnh trong công nghiệp.
– Lưu huỳnh độc, cần cẩn thận khi tiếp xúc.
– Củng cố niềm tin vào khoa học thông qua thí nghiệm biểu diển, tạo hứng thú cho HS, yêu môn hoá học hơn và khuyến khích sự tìm tòi, sáng tạo để chiếm lĩnh tri thức.
2. Định hướng các năng lực có thể hình thành và phát triển
– Năng lực sử dụng ngôn ngữ hóa học
– Năng lực tự học, năng lực hợp tác
– Năng lực phát hiện và giải quyết vấn đề thông qua môn hóa học
– Năng lực tính toán hóa học
– Năng lực vận dụng kiến thức hóa học vào cuộc sống….
II. Phương pháp và kĩ thuật dạy học
1. Phương pháp dạy học
– Phương pháp đàm thoại tìm tòi.
– Phương pháp thuyết trình.
– Phương pháp dạy học hợp tác
2. Kĩ thuật dạy học
– Kĩ thuật đặt câu hỏi.
– Sử dụng thí nghiệm trực quan.
III.Chuẩn bị của GV và HS
1.GV:
Máy tính, máy chiếu, các phiếu học tập.
2.HS:
Chuẩn bị bài tâp được giao từ tiết trước
IV. Chuỗi các hoạt động học
A.Hoạt động kết nối
Buổi trước, lớp chúng ta đã tìm hiểu về oxi-ozon (hai dạng thù hình rất quan trọng của nguyên tố oxi). Hôm nay, cô trò chúng ta sẽ tiếp tục tìm hiểu nguyên tố hóa học khác cũng thuộc nhóm VIA. Đó là nguyên tố Lưu huỳnh. Ngoài tên gọi lưu huỳnh, trên thị trường còn có tên gọi khác như diêm sinh, sinh diêm vàng hoặc lưu hoạt.
B. Hoạt động hình thành kiến thức.
Hoạt động 1: Vị trí, cấu hình electron nguyên tử lưu huỳnh.
|
Hoạt động của giáo viên và học sinh |
Nội dung |
|
Yêu cầu học sinh nghiên cứu sgk và cho biết: • Kí hiệu nguyên tử • Số hiệu nguyên tử • Nguyên tử khối • Cấu hình electron • Vị trí nguyên tử
|
I. Vị trí, cấu hình electron nguyên tử. – Kí hiệu hóa học: S – Cấu hình electron: 1s22s22p63s23p4 – Vị trí: Ô thứ 16, chu kì 3, nhóm VIA |
Hoạt động 2: Tính chất vật lí của lưu huỳnh
|
Hoạt động của giáo viên và sinh viên |
Nội dung |
||||||||||||||||||
|
– GV yêu cầu học sinh thảo luận nhóm theo bàn và hoàn thiện phiếu học tập. – Hs hoạt động nhóm và hoàn thiện phiếu học tập. – Gv gọi bất kì hs để hoàn thiện nội dung phiếu học tập và củng cố lại tính chất vật lý.
|
|
||||||||||||||||||
Hoạt động 3: Tính chất hóa học
|
Hoạt của giáo viên và học sinh |
Nội dung |
|
|
– GV chia lớp thành 4 nhóm thảo luận câu hỏi trong phiếu học tập.
– HS hoạt động theo nhóm và hoàn thành nhiệm vụ. – GV làm thí nghiệm về Fe + S và S + O2 cho hs quan sát hiện tượng. |
III. Tính chất hóa học – S-2 S0 S+4 S+6
à Lưu huỳnh có tính oxi hóa và tính khử. – Các số oxi hoá: -2, 0, +2, +4, +6. 1. Tác dụng với kim loại và hidro.
S thể hiện tính oxi hóa 2. Tác dụng với phi kim
S thể hiện tính khử. 3. Tác dụng với 1 số hợp chất có tính oxi hóa mạnh S + HNO3 → H2SO4+6NO2+2H2O S + H2SO4đ → SO 2 + H2O S + KClO3 → KCl + SO 2
|
Hoạt động 4: Ứng dụng của S, trạng thái tự nhiên và sản xuất lưu huỳnh.
– Gv yêu cầu hs tự học và tìm hiểu thêm.
Hoạt động 5: Luyện tập
PHIẾU HỌC TẬP SỐ 3
Bài tập: S tác dụng được với chất nào trong các chất sau? Viết phương trình phản ứng và xác định vai trò của các chất: Fe, Cu, Au, HCl, H2SO4, O2, F2, Ar.
Câu 1: Dạng thù hình nào của lưu huỳnh bền ở nhiệt độ dưới 95,50C ?
A. Lưu huỳnh dẻo. B. Lưu huỳnh hoa.
C. Lưu huỳnh đơn tà. D. Lưu huỳnh tà phương.
Câu 2: Các nguyên tố nhóm VIA có cấu hình electron lớp ngoài cùng là :
A. ns2np3 B. ns2np5 C. ns2np4 D. ns2np6
Câu 3. Câu nào sau đây diễn tả đúng tính chất hóa học của lưu huỳnh?
A. Lưu huỳnh chỉ có tính oxi hóa. B. Lưu huỳnh chỉ có tính khử.
C. Lưu huỳnh vừa có tính khử, vừa có tính oxi hóa. D. Tất cả đều sai.
Câu 4. Cho cấu hình electron của các nguyên tử sau:
a) 1s2 2s2 2p4 . b) 1s2 2s2 2p6 3s2 3p4. c) 1s2 2s2 2p5.
Cấu hình electron trên lần lượt của các nguyên tử:
A. O, S, F. B. O, F, S. C. S, F, O. D. F, S, O.
Câu 5: Cho 10,4g hỗn hợp gồm Fe và Mg tác dụng vừa đủ với 9,6g S. % khối lượng của Fe và Mg trong hỗn hợp là:
A. 52,76% và 47,24% B. 53,85% và 46,15%
C. 63,8% và 36,2% D. 72% và 28%
Câu 6: Cho phương trình hóa học sau: S + 2H2SO4 → 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ giữa số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hóa là:
A. 1 : 2 B. 1 : 3 C. 3 : 1 D. 2 : 1
A. Hợp chất của lưu huỳnh.
I. Mục tiêu bài học
1. Về kiến thức.
a. Kiến thức
– Nêu được tính chất vật lí, trạng thái tự nhiên và cách điều chế hiđro sunfua.
– Biết được dung dịch H2S có tính axit yếu.
– Trình bày được những tính chất hóa học đặc trưng của hidro sunfua.
– Chứng minh được tính khử mạnh của hidro sunfua.
– Giải thích được vì sao SO2 vừa có tính oxi hóa và tính khử, còn SO3 có tính axit mạnh.
b. Kĩ năng
– Viết pthh minh họa cho tính chất hóa học của các hợp chất lưu huỳnh.
– Dự đoán, kiểm tra, kết luận được về tính chất hoá học của H2S, SO2, SO3
– Phân biệt H2S, SO2 với khí khác đã biết.
– Tính % thể tích khí H2S, SO2 trong hỗn hợp.
c . Thái độ
Khả năng tư duy logic, tạo hứng thú nghiên cứu bộ môn
2. Định hướng các năng lực có thể hình thành và phát triển
– Năng lực sử dụng ngôn ngữ hóa học
– Năng lực thực hành hóa học
– Năng lực tự học, năng lực hợp tác
– Năng lực phát hiện và giải quyết vấn đề thông qua môn hóa học
– Năng lực tính toán hóa học
– Năng lực vận dụng kiến thức hóa học vào cuộc sống
II. Chuẩn bị của GV và HS:
1. GV:
Chuẩn bị phiếu học tập và chuẩn bị nội dung, bài giải của các phiếu học tập
2. HS:
Học bài lưu huỳnh và chuẩn bị nội dung bài học
III. phương pháp và kĩ thuật
1.Phương pháp dạy học.
– Phương pháp đàm thoại phát hiện.
– Phương pháp thuyết trình.
– Phương pháp hợp tác.
2.Kĩ thuật dạy học.
Kĩ thuật đặt câu hỏi.
IV.Chuỗi các hoạt động học
A. Hoạt động trải nghiệm, kết nối.
– GV: yêu cầu HS kể tên một số hợp chất của lưu huỳnh?
– HS: kể tên các hợp chất của lưu huỳnh
– GV: những hợp chất của lưu huỳnh mà chúng ta vừa kể ở trên có tính chất như thế nào. Cô và lớp mình cùng tìm hiểu về bài học hôm nay.
B. Hoạt động hình thành kiến thức
1. Tìm hiểu về hidro sunfua.
|
Hoạt động của giáo viên và học sinh. |
Nội dung ghi bảng |
|
– GV: yêu cầu học sinh tìm hiểu sgk và trình bày tính chất vật lý của hidro sunfua theo các tiêu chí sau: + Trạng thái tự nhiên, màu sắc. + Tỉ khối so với KK + Độ tan, tính độc.
– GV giới thiệu: khí hidro sunfua khi tan trong nước tạo thành dung dịch axit sunfuhidric và nghiên cứu được rằng tính axit của H2S còn yếu hơn cả axit H2CO3. Vậy các em có nhận xét gì về tính axit của H2S. -HS: lắng nghe và trả lời. – GV: yêu cầu HS nhắc lại tính chất của một axit. – HS: làm đổi màu quỳ, tác dụng với kim loại, oxit bazo, dd bazo và muối. – GV đặt vấn đề: Theo các em, axit H2S có làm đổi màu quỳ tím không? Nêu tính chất hóa học của H2S? GV: H2S là axit hai lần axit, vậy phản ứng với kiềm sẽ tạo những muốn nào? Nhận xét và căn cứ vào tỉ lệ mol giữa H2S và NaOH để biết muối nào hình thành. -GV: yêu cầu HS nhắc lại các số oxi hóa có thể có của S. Xác định số oxi hóa của S trong hợp chất H2S. -HS: Các số oxi hóa của S là -2, 0, +4, +6. Trong hợp chất H2S, S có số oxi hóa là -2, và trong các phản ứng thì có khả năng tăng lên 0, +4, +6. -HS: thể hiện tính khử, tác dụng được với những chất oxi hóa như oxi, halogen, các chất oxh mạnh H2SO4, HNO3. -GV: yêu cầu học sinh viết các phương trình hóa học minh họa cho tính chất của H2S. -HS: viết pthh và xác định số OXH của S trong các phản ứng. – GV: yêu cầu học sinh nghiên cứu sgk và cho biết trạng thái tự nhiên và điều chế H2S.
|
I. HIDRO SUNFUA 1. TÍNH CHẤT VẬT LÝ – Hidro sunfua (H2SÓ) là chất khí, không màu, mùi trứng thối, nặng hơn không khí – Rất độc, tan ít trong nước 2. TÍNH CHẤT HÓA HỌC a. Tính axit yếu H2S(K) H2S(dd) khí hidro sunfua axit sunfuhidric – Không làm đổi màu quỳ tím. – Tác dụng với KL: – Tác dụng với oxit bazo: ZnO + H2S → ZnS + H2O – Tác dụng với dung dịch bazo (kiềm): NaOH + H2Sdư → NaHS + H2O 2NaOHdư + H2S → Na2S + 2H2O – Tác dụng với muối: H2S + CuSO4 → CuS + H2SO4 b. Tính khử mạnh – Tác dụng với oxi • Ở t°C cao, H2S cháy trong không khí với ngọn lửa xanh nhạt. • Đốt trong oxi thiếu hoặc t°C không cao hoặc H2S để trong không khí: 2 H2S + O2 → 2S + 2H2O H2S + 3H2SO4 đặc → 4SO2 +4H2O H2S + 8HNO3 đặc → H2SO4 +8NO2 + 4H2O 3. TRẠNG THÁI TỰ NHIÊN VÀ ĐIỀU CHẾ a. Trạng thái tự nhiên Khí hidro sunfua có trong nước suối, khí núi lửa, xác động vật bị thối rữa,… b. Điều chế trong phòng thí nghiệm
|
2.Tìm hiểu về lưu huỳnh dioxit.
|
Hoạt động của giáo viên và học sinh |
Nội dung ghi bảng |
|
– GV: yêu cầu học sinh nghiên cứu sgk và cho biết tính chất vật lý của lưu huỳnh dioxit. + trạng thái màu sắc. + độ tan. + tính độc. – GV tổ chức HS hoạt động theo cá nhân. +1HS xác định số oxi hóa của lưu huỳnh trong SO2 và nhận xét về số oxi hóa đó. + 1HS SO2 là oxit nào? – HS: lắng nghe và trả lời câu hỏi. – GV mời các hs khác nhận xét bổ sung, góp ý. – GV kết luận SO2 là một oxit axit vừa có tính khử vừa có tính oxi hóa: + SO2 có đầy đủ tính chất của oxit axit. + Số oxi hóa của S trong SO2 là +4 là số oxi hóa trung gian của S nên H2S thể hiện tính khử vừa có tính oxi hóa. – GV tổ chức HS hoạt động theo nhóm. Các nhóm hoàn thành phiếu học tập số 1: (GVchia lớp thành 4 nhóm) Nhóm 1: chứng minh SO2 có đầy đủ tính chất của một oxit axit. Nhóm 2: chứng minh tính khử của SO2 bằng PTPU. Nhóm 3: chứng minh tính oxi hóa của SO2 bằng PUHH. Nhóm 4: trình bày pp điều chế lưu huỳnh dioxit. -HS: thảo luận nhóm, trình bày ra bảng nhóm và lên bảng thuyết trình về kết quả của nhóm mình, các nhóm còn lại nghiên cứu nhận xét bổ xung ý kiến. – GV: quan sát hoạt động nhóm của nhóm và nhận xét tổng hợp lại kiến thức. |
II. LƯU HUỲNH ĐIOXIT 1. Tính chất vật lý. – Khí không màu, mùa hắc, nặng hơn 2 lần không khí – Hóa lỏng ở -10oC – Tan nhiều trong nước, độc. 2. Tính chất hóa học. a. SO2 là oxit axit – SO2 tan trong nước tạo dd axit sunfuro SO2 +H2O H2SO3 à H2SO3 là một axit yếu (mạnh hơn H2S, H2CO3) và không bền. – SO2 tác dụng với dung dịch bazơ tạo 2 muối: muối trung hòa (ion sunfit SO32-), muối axit (ion hidro sunfit HSO3–) b. SO2 là chất khử và là chất oxi hóa – SO2 là chất khử:
– SO2 là chất oxi hóa : 3. ỨNG DỤNG VÀ ĐIỀU CHẾ a. Ứng dụng: – Sản xuất H2SO4 – Tẩy trắng bột giấy – Chống nấm mốc cho lương thực, thực phẩm b. Điều chế Trong phòng thí nghiệm:
Trong công nghiệp: |
3.Tìm hiểu về lưu huỳnh trioxit.
|
Hoạt động của giáo viên và học sinh. |
Nội dung ghi bảng |
|
– GV: yêu cầu hs đọc sgk và cho biết tính chất vật lý của lưu huỳnh trioxit. + trạng thái, màu sắc. + độ tan + tính độc. – HS nghiên cứu sgk và tl câu hỏi. – GV: SO3 là oxit axit hay oxit bazo. Từ đó, dự đoán tính chất hóa học của SO3. -HS: SO3 là oxit axit, có thể tác dụng với nước, oxit bazo, bazo. -GV: yêu cầu học sinh viết pthh minh họa. -HS: viết pthh minh họa cho tchh của SO3. – GV: yêu cầu hs cho biết ứng dụng và cách sản xuất SO3 trong công nghiệp. -HS: +ứng dụng trong sản xuất axit sunfuric. + được sản xuất bằng cách oxi hóa lưu huỳnh đioxit. |
III. LƯU HUỲNH TRIOXIT 1. TÍNH CHẤT a. Tính chất vật lý – Lỏng không màu – Tan vô hạn trong nước và trong H2SO4 – Độc b. Tính chất hóa học – SO3 là oxit axit, tác dụng rất mạnh với nước tạo dd axit sunfuric và tỏa nhiều nhiệt SO3 +H2O H2SO4 – SO3 tác dụng với oxit bazơ, bazơ tạo muối: muối sunfat (ion SO42-)
II. ỨNG DỤNG VÀ SẢN XUẤT a) Ứng dụng: SO3 ít có ứng dụng thực tiễn mà chỉ là sản phẩm trung gian để sản xuất H2SO4
b) Trong công nghiệp: Oxi hóa SO2 ở nhiệt độ cao (450 – 500oC) có xúc tác V2O5
|
B. Axit sunfuric và muối sunfat.
I. Mục tiêu bài học
1. Về kiến thức, kỹ năng, thái độ
a. Kiến thức
– Trình bày được tính chất vật lý và tính chất hóa học của H2SO4.
– Giải thích được tại sao H2SO4 đặc ngoài tính axit còn có tính oxi hóa mạnh.
– Phân biệt được muối sunfat và cách nhận biết các ion sunfat.
– Trình bày được các ứng dụng của axit sunfuric và cách điều chế.
b. Kĩ năng
-Viết pthh minh họa cho tính chất hóa học của H2SO4
– Kĩ năng quan sát và nhận xét các hiện tượng hóa học.
c . Thái độ: Khả năng tư duy logic, tạo hứng thú nghiên cứu bộ môn
2. Định hướng các năng lực có thể hình thành và phát triển
– Năng lực sử dụng ngôn ngữ hóa học
– Năng lực thực hành hóa học
– Năng lực tự học, năng lực hợp tác
– Năng lực phát hiện và giải quyết vấn đề thông qua môn hóa học
– Năng lực tính toán hóa học
– Năng lực vận dụng kiến thức hóa học vào cuộc sống….
II. Phương pháp và kĩ thuật dạy học.
1. Phương pháp dạy học
– Phương pháp trực quan.
– Phương pháp đàm thoại.
– Phương pháp thuyết trình.
2. Kĩ thuật dạy học
Kĩ thuật đặt câu hỏi.
III. Chuẩn bị của GV và HS:
1. GV:
– Chuẩn bị phiếu học tập và chuẩn bị nội dung, bài giải của các phiếu học tập
2. HS:
Học chuẩn bị nội dung bài học
IV. Chuỗi các hoạt động học
Hoạt động 1: Tìm hiểu tính chất vật lí H2SO4
|
Hoạt động của giáo viên và học sinh |
Nội dung bài giảng |
|
– Gv: yêu cầu học sinh cho biết tính chất vật lý của axit sunfuric. + trạng thái, màu sắc. + tỉ khối so với nước. + độ tan. -HS nghiên cứu sgk và tl câu hỏi. – GV: treo tranh lên bảng, yêu cầu hs quan sát và cho biết cách pha loãng axit. – HS quan sát và trả lời câu hỏi. |
I. axit sunfuric. 1. tính chất vật lý. – H2SO4 là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gấp 2 lần nước. – Tan vô hạn trong nước và tỏa nhiệt mạnh. – Cách pha loãng : rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh. |
Hoạt động 2: Tìm hiểu tính chất hóa học của H2SO4 loãng
|
Hoạt động của giáo viên và học sinh |
Nội dung ghi bảng. |
|
– GV: yêu cầu hs nhắc lại tính chất hóa học của axit và từ đó dự đoán tchh của H2SO4 loãng. – HS: axit có tc như đổi màu quỳ tím, tác dụng với kim loại, oxit bazo, bazow, muối. -GV: yêu cầu hs lên bảng viết các pthh minh họa. -HS viết pthh minh họa. -Gv làm thí nghiệm minh họa : Fe+H2SO4 Cu +H2SO4 – HS quan sát và nhận xét hiện tượng. |
2. Tính chất hóa học. a. Tính chất của dd axit sunfuric loãng. – Làm đổi màu quỳ tím sang đỏ. – Tác dụng với kl hoạt động đứng trước H2. – Tác dụng với oxit bazo và bazo. – Tác dụng với muối.
|
Hoạt động 3: Tìm hiểu tính chất hóa học của H2SO4 đặc
|
Hoạt động của giáo viên và học sinh |
Nội dung ghi bảng. |
|
– GV giới thiệu: trong H2SO4, lưu huỳnh có số oxh là +6, yêu cầu hs dự đoán tchh của axit sunfuric. – HS: axit sunfuric ngoài có tính axit mạnh còn có tính oxi hóa mạnh, nó oxh được hầu hết kim loại, nhiều phi kim và hợp chất. – GV: yêu cầu hs lên bảng hoàn thành các pthh và xác định số oxh của lưu huỳnh. – HS hoàn thiện các pthh và xác định số oxh của lưu huỳnh. -Gv: H2SO4 ngoài có tính oxi hóa mạnh còn có tính háo nước. GV viết pthh minh họa cho hs
|
b, Tính chất của axit sunfuric đặc. – Tính oxi hóa mạnh Cu+2H2SO4(đ) → CuSO4 + 2H2O +SO2 2Fe + 6H2SO4(đ nguội)→ 2FeO + 4H2SO4(đ) →Fe2(SO4)3 +SO2 +4H2O S + 2H2SO4(đ)→3SO2 +2H2O 2KBr + 2H2SO4(đ)→ Br2 +SO2 +2H2O +K2SO4 – tính háo nước. C12H22O11 12C +11H2O C+ 2H2SO4 CO2 +2SO2 +2H2O Khi sử dụng axit sunfuric phải hết sức cẩn thận.
|
Hoạt động 4 : Tìm hiểu về ứng dụng và điều chế H2SO4
|
Hoạt động của giáo viên và học sinh |
Nội dung ghi bảng |
|
– GV yêu cầu HS trình bày ứng dụng của H2SO4. -Hs lắng nghe và ghi bài. -Gv giới thiệu về quy trình sx axit sunfuric, gồm 3 giai đoạn. -HS lắng nghe và ghi chép bài.
|
3. Ứng dụng sx phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp. 4.Sản xuất. Gồm 3 giai đoạn chính: – sx lưu huỳnh đioxit + đốt cháy lưu huỳnh: S+ O2 SO2 + Đốt quặng pirit sắt FeS2 4FeS2+11O2 2Fe2O3 +8SO2 – sx lưu huỳnh trioxit 2SO2 +O2 2SO3 – hấp thụ SO3 bằng H2SO4 H2SO4 +n SO3 H2SO4.nSO3 H2SO4.nSO3 + n H2O (n+1) H2SO4 |
|
Hoạt động 2 : Tìm hiểu về muối sunfat . Nhận biết ion sunfat |
|
|
Hoạt động của giáo viên và học sinh |
Nôi dung ghi bảng |
|
– GV: Thế nào là muối trung hòa và muối axit ? Cho VD -HS : + Muối trung hòa là muối có gốc axit không còn nguyên tử hiđro. (Na2CO3 , K2SO4 … ) – Muối axit là muối có gốc axit còn nguyên tử hiđro. (NaHSO4, KHCO3 …) – GV: Gọi HS lên bảng viết phản ứng khi cho H2SO4 tác dụng dd KOH tạo muối trung hòa và muối axit. -HS : Viết pthh – GV: nhận xét các ptpứ – Gv: Để nhận biết ion SO42- ta dùng thuốc thử nào ? -Hs: dung dd muối bari PTHH: H2SO4 + BaCl2 BaSO4 trắng + 2HCl Na2SO4 + Ba(NO3)2 BaSO4 + 2NaNO3
Bài tập vận dụng : Chỉ dùng thêm giấy quì tím hãy nhận biết các lọ chứa các dung dịch mất nhãn sau: H2SO4 ,Na2SO4 , BaCl2 ,NaCl. Viết phương trình hoá học xảy ra .
|
5. Muối sunfat. Nhận biết ion sunfat a. Muối sunfat – Muối trung hòa (muối sunfat) chứa ion SO42- H2SO4 + 2NaOH Na2SO4 + 2H2O Phần lớn muối sunfat đều tan trừ BaSO4 , PbSO4 và SrSO4 không tan, Ag2SO4 , CaSO4 ít tan – Muối axit (muối hiđrosunfat) chứa ion HSO4— . H2SO4 + NaOH NaHSO4 + H2O
b. Nhận biết ion sunfat SO42- Thuốc thử là ion Ba2+ : H2SO4 + BaCl2 BaSO4 trắng + 2HCl Na2SO4 + Ba(OH)2 BaSO4 + 2NaOH Chú ý: Khi nhận biết thì nhận biết gốc SO42— trước gốc Cl— .
|
Hoạt động 5 : Vận dụng và tìm tòi mở rộng
a. Mức độ nhận biết
Câu1.Kim loại bị thụ động trong H2SO4 đặc, nguội là
A. Al, Cu B. Zn, Cu, Cr C. Fe, Ag D. Fe, Al, Cr
Câu 2 Trong các chất sau, chọn hợp chất chứa hàm lượng S cao nhất
A. CuS B. FeS C. FeS2 D. CuFeS2
Câu 3: Cho các chất riêng biệt sau: FeSO4, AgNO3, Na2SO3, H2S, HI, Fe3O4, Fe2O3 tác dụng với dung dịch H2SO4 đặc, nóng. Số trường hợp xảy ra phản ứng oxi hoá – khử là
A. 6. B. 3. C. 4. D. 5.
Câu 24 Cho phương trình hóa học :
a Al + b H2SO4 → Al2(SO4)3 + dSO2 + eH2O.
Tỉ lệ a : b là A. 1 : 2 B. 1 : 3 C. 1 : 1 D . 2 : 3
Câu 5: Tổng hệ số (các số nguyên, tối giản) của tất cả các chất trong PT pư giữa Cu với dd
H2SO4 đặc, nóng là
A. 10. B. 8. C. 9. D. 11
b. Mức độ thông hiểu
Câu 1. Cho 0,2 mol Cu tan hết trong dung dịch H2SO4 đặc, nóng. Thể tích khí thu được (đktc) là
A.1,12lít B. 2,24lít C. 4,48lít D. 6,72lít
Câu 2. Cho 0,15 mol hỗn hợp Cu và Zn tác dụng với H2SO4 đặc, nóng thu được 1,344 lít SO2 (đktc).Số mol H2SO4 đã tham gia phản ứng là
A. 0,3 mol B. 0,12 mol C. 0,15 mol D. 0,06 mol
Câu 3. Cho 3,2g bột S tan hết trong dung dịch H2SO4 đặc, nóng thu được V lít khí (đktc), giá trị của V là
A. 4,48 B. 6,72 C. 2,24 D. 3,36
c. Mức độ vận dụng
Câu 1. Cho 104g dung dịch BaCl2 10% tác dụng với dung dịch H2SO4 dư. Lượng kết tủa thu được là
A. 11,25g B. 11,65g C. 116,5g D. 1165g
Câu 2: Để nhận biết ba axit đặc, nguội: HCl, H2SO4, HNO3 đựng riêng biệt trong ba lọ bị mất nhãn, ta dùng thuốc thử là
A. Fe. B. CuO. C. Al. D. Cu.
Câu 3: Hoà tan 5,6 gam Fe bằng dd H2SO4 loãng (dư), thu được dd X. dd X phản ứng vừa đủ với V ml dd KMnO4 0,5M. Giá trị của V là (cho Fe = 56)
A. 80. B. 40. C. 20. D. 60.
d. mức độ vận dụng cao
Câu 1: Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dd H2SO4 đặc, nóng thu được dd X và 3,248 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Cô cạn dd X, thu được m gam muối sunfat khan. Giá trị của m là
A. 52,2. B. 54,0. C. 58,0. D. 48,4.
Câu 2: Cho m gam hh Mg, Al vào 250 ml dd X chứa hh axit HCl 1M và axit H2SO4 0,5M, thu được 5,32 lít H2 (ở đktc) và dd Y (coi thể tích dd không đổi). dd Y có pH là
A. 1. B. 6. C. 7. D. 2.
Câu 3: Hoà tan hoàn toàn 2,81 gam hh gồm Fe2O3, MgO, ZnO trong 500 ml axit H2SO4 0,1M (vừa đủ). Sauphản ứng, hh muối sunfat khan thu được khi cô cạn dd có khối lượng là (cho H = 1, O = 16, Mg = 24, S = 32, Fe = 56, Zn = 65)
A. 6,81 gam. B. 4,81 gam. C. 3,81 gam. D. 5,81 gam
Rút kinh nghiệm:
Xem thêm