Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
TÀI LIỆU GIẢNG DẠY HÓA HỌC 10
NĂM HỌC 2020 – 2021
CHƯƠNG 5: NHÓM HALOGEN
CĐ1: Đại cương về phi kim. Khái quát về nhóm halogen
CĐ2: Clo
CĐ3: Hiđroclorua – Axit clohiđric và muối clorua
CĐ4: Hợp chất chứa oxi của clo
CĐ5: Flo, brom, iot và hợp chất
CĐ6: Ôn tập nhóm halogen
CHUYÊN ĐỀ 1: ĐẠI CƯƠNG VỀ PHI KIM
KHÁI QUÁT VỀ NHÓM HALOGEN
|
KIẾN THỨC CẦN NHỚ 1. Vị trí của phi kim trong bảng tuần hoàn – Nhóm VIIA: F, Cl, Br, I; Nhóm VIA: O, S, Se, Te; Nhóm VA: N, P, As; Nhóm IVA: C, Si và một số nguyên tố khác như H (IA), B (IIIA). 2. Tính chất của phi kim – Đơn chất phi kim vừa có tính oxi hóa, vừa có tính khử. + Tính oxi hóa: Tác dụng với các chất khử như: Kim loại, H2, hợp chất khử: NH3, H2S, … + Tính khử: Tác dụng với các chất oxi hóa như: O2, hợp chất oxi hóa: oxit kim loại, HNO3, H2SO4 đặc, … 3. Khái quát về nhóm halogen (nhóm VIIA) – Nhóm halogen (nhóm VIIA) gồm: F, Cl, Br, I, At* (At là nguyên tố phóng xạ nên không xét). – Cấu hình của các nguyên tố halogen có dạng: ns2np5. Các nguyên tố halogen có tính oxi hóa mạnh. – Từ F2 (khí, lục nhạt) → Cl2 (khí, vàng lục) → Br2 (lỏng, nâu đỏ) → I2 (rắn, đen tím): màu sắc đậm dần, trạng thái chuyển từ khí → lỏng → rắn. – Từ F → Cl → Br → I: Tính phi kim, độ âm điện của các nguyên tố giảm dần. – Từ F2 → Cl2 → Br2 → I2: Tính oxi hóa giảm dần. – Trong các hợp chất F chỉ có SOH -1; các nguyên tố khác ngoài SOH -1 còn có các SOH +1, +3, +5, +7. |
❖ BÀI TẬP TỰ LUẬN
Câu 1: Cho các nguyên tố: Na, C, Cl, Mg, O, S, P, Ca, N, F, Al, Br, H, I, Au, Cl.
(a) Những nguyên tố phi kim gồm: ………………………………………………………………..
(b) Những nguyên tố thuộc nhóm halogen gồm: …………………………………………………..
Câu 2:
(a) Xác định số oxi hóa của Cl, F trong các chất sau: NaF, KCl, HCl, HClO, HClO2, HClO3, HClO4.
(b) Cho các nguyên tố: Cl, Br, I, F. Thứ tự độ âm điện tăng dần là ……………………………….
(c) Từ F2 → Cl2 → Br2 → I2: Màu sắc: …………….; tính oxi hóa ………………; trạng thái chuyển từ
………….. → …………… → ………………
Câu 3: Hoàn thành các phương trình hóa học sau:
(a) ….Al + ….O2 ………………………………
(b) ….Fe + ….Cl2 ………………………..……
(c) ….H2S + ….O2 dư …………………….……
(d) ….C + ….O2 ………………………………
(e) ….C + ….CuO …………………….………
(g) ….C + ….H2SO4 đặc ………………………
❖ BÀI TẬP TRẮC NGHIỆM
1. Mức độ nhận biết (rất dễ và dễ)
Câu 1. Nguyên tố nào sau đây là phi kim?
A. Mg. B. Cu. C. C. D. Ca.
Câu 2. Nguyên tố nào sau đây là kim loại?
A. F. B. O. C. H. D. K.
Câu 3. Cấu hình e lớp ngoài cùng của các nguyên tử các nguyên tố halogen là
A. ns2np4. B. ns2np5. C. ns2np3. D. ns2np6.
Câu 4: Cấu hình electron của nguyên tử Cl (Z = 17) là
A. [Ne]3s23p5. B. [Ne]3s23p6. C. [Ne]3s23p4. D. [Ar]3s23p6.
Câu 5: (M.15): Nguyên tố hóa học nào sau đây thuộc nhóm halogen?
A. Clo. B. Oxi. C. Nitơ. D. Cacbon.
Câu 6: Các nguyên tố nhóm halogen được nghiên cứu bao gồm
A. F, O, Cl, Br. B. S, O, Br, I. C. F, Cl, Br, I. D. Ne, Ar, Br, Kr.
Câu 7. Khi đốt cháy lưu huỳnh trong oxi ta thu được sản phẩm là
A. CO2. B. SO2. C. SO3. D. H2SO4.
Câu 8. Sản phẩm tạo thành khi cho sắt tác dụng với khí clo là
A. FeCl2. B. AlCl3. C. FeCl3. D. CuCl2.
Câu 9. Theo chiều tăng điện tích hạt nhân thì khả năng oxi hóa của các halogen đơn chất:
A. tăng dần. B. giảm dần. C. không thay đổi. D. vừa tăng, vừa giảm.
Câu 10. Theo chiều từ F → Cl → Br →I, bán kính nguyên tử:
A. tăng dần. B. giảm dần.
C. không đổi. D. không có quy luật chung.
Câu 11. Theo chiều từ F → Cl → Br →I, giá trị độ âm điện của các nguyên tố
A. không đổi. B. tăng dần.
C. giảm dần. D. không có quy luật chung.
Câu 12. Nguyên tố có độ âm điện lớn nhất là
A. Clo. B. Natri. C. Iot. D. Flo.
Câu 13: Đơn chất halogen tồn tại thể lỏng điều kiện thường là
A. F2. B. Cl2. C. Br2. D. I2.
Câu 14: Phi kim X2 tồn tại ở thể rắn và rất dễ thăng hoa. X2 là
A. F2. B. Cl2. C. Br2. D. I2.
2. Mức độ thông hiểu (trung bình)
Câu 15. Dãy nào sau đây gồm các nguyên tố đều là phi kim?
A. F, O, Na, N. B. O, Cl, Br, H. C. H, N, O, K. D. K, Na, Mg, Al.
Câu 16. Sản phẩm tạo thành khi cho C, H2, S lần lượt tác dụng với oxi là
A. CO2, HCl, SO2. B. CO, H2O, H2S. C. CO2, H2O, SO2. D. CO2, H2O, H2S.
Câu 17. Sản phẩm tạo thành khi cho N2, S, O2 lần lượt tác dụng với hiđro ở điều kiện thích hợp là
A. NH3, H2S, H2O. B. NH3, SO2, H2O. C. NO, H2S, H2O2. D. N2O, SO2, H2O.
Câu 18: Số oxi hóa của clo trong các chất Cl2, NaCl, NaClO lần lượt là
A. 0, +1, –1. B. 0, –1, +1. C. –1, –1, +1. D. –1, –1, –1.
Câu 19: Số oxi hóa của clo trong các hợp chất HCl, NaClO và KClO3 lần lượt là
A. +1, +1, +5. B. –1, +1, +7. C. +1, -1, +7. D. –1, +1, +5.
Câu 20. Liên kết trong các phân tử đơn chất halogen thuộc loại liên kết
A. cộng hóa trị không phân cực. B. cộng hóa trị có phân cực.
C. liên kết ion. D. liên kết cho nhận.
Câu 21. Nhận xét nào dưới đây là không đúng ?
A. F có số oxi hóa -1. B. F có số oxi hóa -1 trong các hợp chất.
C. F có số oxi hóa 0 và -1. D. F không có số oxi hóa dương.
Câu 22: Phát biểu nào sau đây không đúng?
A. Trong tất cả các hợp chất, flo chỉ có số oxi hóa -1.
B. Trong tất cả các hợp chất, các halogen chỉ có số oxi hóa -1.
C. Tính oxi hóa của các halogen giảm dần từ flo đến iot.
D. Trong hợp chất với hiđro và kim loại, các halogen luôn thể hiện số oxi hóa -1.
Câu 23. Đặc điểm nào không phải là đặc điểm chung của các halogen?
A. Đều là chất khí ở điều kiện thường.
B. Đều có tính oxi hóa mạnh.
C. Tác dụng với hầu hết các kim loại và phi kim.
D. Khử năng tác dụng với nước giảm dần tử F2 đến I2.
Câu 24. Đặc điểm nào dưới đây không phải là đặc điểm của các nguyên tố halogen (F, Cl, Br, I)?
A. Nguyên tử chỉ có khả năng thu thêm 1 electron.
B. Tạo ra hợp chất liên kết cộng hóa trị có cực với hiđro.
C. Có số oxi hóa –1 trong mọi hợp chất.
D. Lớp electron ngoài cùng của nguyên tử có 7 electron.
Câu 25. Câu nào sau đây không đúng?
A. Các halogen là những phi kim mạnh nhất trong mỗi chu kỳ.
B. Các halogen đều có số oxi hóa là -1; 0; +1; +3; +5; +7.
C. Các halogen đều có 7 electron lớp ngoài cùng thuộc phân lớp s và p.
D. Tính oxi hoá của các halogen giảm dần từ flo đến iot.
3. Mức độ vận dụng (khá)
CHUYÊN ĐỀ 2: CLO
|
KIẾN THỨC CẦN NHỚ 1. Tính chất vật lí – Là chất khí, màu vàng lục, mùi sốc, rất độc. – Nặng hơn không khí, tan trong nước → nước clo có màu vàng. 2. Tính chất hóa học – Clo là một phi kim rất hoạt động, có tính oxi hóa mạnh, trong một số phản ứng cũng thể hiện tính khử. + Tính oxi hóa: ⬥ Tác dụng với kim loại → muối (KL có hóa trị cao). ⬥ Tác dụng với H2 → HCl. ⬥ Tác dụng với muối của halogen khác (Trừ F2, các halogen mạnh đẩy halogen yếu ra khỏi muối). ⬥ Tác dụng với hợp chất khử: 2FeCl2 + Cl2 2FeCl3 + Vừa oxi hóa, vừa khử: ⬥ Tác dụng với nước: Cl2 + H2O HCl + HClO ⬥ Tác dụng với dung dịch kiềm: Cl2 + 2NaOH → NaCl + NaClO + H2O 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O 3. Điều chế clo – Trong PTN: Cho HCl đặc tác dụng với MnO2 to, KMnO4, KClO3, … MnO2 + 4HClđặc → MnO2 + Cl2 + 2H2O 2KMnO4 + 16HClđặc → 2KCl + 2MnCl2 + 5Cl2 + 8H2O – Trong CN: Điện phân dung dịch NaCl: 2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑ |
❖ BÀI TẬP TỰ LUẬN
Câu 1: Viết PTHH xảy ra khi cho Cl2 lần lượt tác dụng với Mg; Fe; H2; NaBr; KI; FeCl2; SO2/H2O;
NaOH; Ca(OH)2; KOH, to.
(1) ………………………………………………………..…..
(2) ………………………………………………………..…..
(3) ………………………………………………………..…..
(4) ………………………………………………………..…..
(5) ………………………………………………………..…..
(6) ………………………………………………………..…..
(7) ………………………………………………………..…..
(8) ………………………………………………………..…..
(9) …………………………………………………………….
(10) …………………………………………………………..
Câu 2: Hoàn thành chuỗi phản ứng sau:
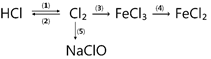
(a)
(1) ………………………………………………………..…..
(2) ………………………………………………………..…..
(3) ………………………………………………………..…..
(4) ………………………………………………………..…..
(5) ………………………………………………………..…..
(b) 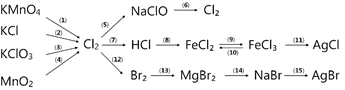
(1) ………………………………………………………..…..
(2) ………………………………………………………..…..
(3) ………………………………………………………..…..
(4) ………………………………………………………..…..
(5) ………………………………………………………..…..
(6) ………………………………………………………..…..
(7) ………………………………………………………..…..
(8) ………………………………………………………..…..
(9) …………………………………………………………….
(10) …………………………………………………………..
(11) …………………………………………………………..
(12) …………………………………………………………..
(13) …………………………………………………………..
(14) …………………………………………………………..
(15) …………………………………………………………..
Câu 3: Nhận biết các chất khí: Cl2, O2, N2, HCl.
|
|
Cl2 |
O2 |
N2 |
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
❖ BÀI TẬP TRẮC NGHIỆM
1. Mức độ nhận biết (rất dễ và dễ)
Câu 1. Cấu hình electron lớp ngoài cùng của clo là
A. 3s2 3p5. B. 2s2 2p5. C. 4s2 4p5. D. ns2 np5.
Câu 2. Liên kết hóa học trong phân tử clo là
A. liên kết ion. B. liên cộng hóa trị.
C. liên kết cộng hóa trị phân cực. D. liên kết cộng hóa trị không phân cực.
Câu 3. Ở điều kiện thường, clo là chất khí màu
A. lục nhạt. B. vàng lục. C. nâu đỏ. D. đen tím.
Câu 4. Ở điều kiện thường, clo là chất khí, màu vàng lục, có mùi xốc và nặng hơn không khí
A. 1,25 lần. B. 2,45 lần. C. 1,26 lần. D. 2,25 lần.
Câu 5. Trong hợp chất clo có các số oxi hóa nào sau đây?
A. -2, 0, +4, +6. B. -1, 0, +1, +3, +5, +7.
C. -1, +1, +3, +5, +7. D. -1, 0, +1, +2, +3, +5, +7.
Câu 6: Trong các phản ứng hóa học, clo thể hiện
A. tính oxi hóa. B. tính khử.
C. tính axit. D. cả tính oxi hóa và tính khử.
Câu 7. Clo chỉ thể hiện tính oxi hóa khi tác dụng với chất nào sau đây?
A. O2. B. H2O. C. Fe. D. NaOH.
Câu 8: Phương trình nào sau đây biểu diễn đúng khi cho dây sắt nóng đỏ cháy trong clo?
A. 2Fe + 3Cl2 → 2FeCl3. B. 3Fe + 4Cl2 FeCl2 + FeCl3.
C. Fe + Cl2 → FeCl2. D. Tùy điều kiện mà A, B hoặc C có thể xảy ra.
Câu 9: Trong phản ứng: Cl2 + H2O HCl + HClO. Clo thể hiện tính chất nào sau đây?
A. Tính oxi hóa. B. Tính khử.
C. Tính axit. D. Vừa có tính oxi hóa vừa có tính khử.
Câu 10. Vai trò của clo trong phản ứng với nước là
A. chất oxi hóa. B. chất khử.
C. vừa là chất oxi hóa và chất khử. D. môi trường.
Câu 11. Trong dung dịch nước clo có chứa các chất nào sau đây?
A. HCl, HClO, Cl2. B. Cl2 và H2O.
C. HCl và Cl2. D. HCl, HClO, Cl2 và H2O.
Câu 12: Sục Cl2 vào dung dịch NaOH loãng, ở nhiệt độ thường thu được dịch X. Trong X chứa
A. NaCl. B. NaClO. C. NaCl, NaClO. D. NaCl, NaClO3
Câu 13. Cho phản ứng: Cl2+ 2 NaBr 2 NaCl + Br2. Trong phản ứng trên clo
A. chỉ bị oxi hóa. B. chỉ bị khử.
C. vừa bị oxi, vừa bị khử. D. không bị oxi hóa, không bị khử.
Câu 14. Cho phản ứng: SO2 + Cl2 + 2H2O 2HCl + H2SO4. Trong phản ứng trên, clo là chất
A. oxi hóa. B. khử.
C. vừa oxi hóa, vừa khử. D. Không oxi hóa khử
Câu 15. Clo không phản ứng với chất nào sau đây?
A. NaOH. B. NaCl. C. Ca(OH)2. D. NaBr.
Câu 16. Trong thiên nhiên, clo chủ yếu tồn tại dưới dạng
A. đơn chất Cl2. B. muối NaCl có trong nước biển.
C. khoáng vật cacnalit (KCl.MgCl2.6H2O). D. khoáng vật sinvinit (KCl.NaCl).
Câu 17. Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách oxi hóa hợp chất nào sau đây?
A. NaCl. B. HCl. C. KClO3. D. KMnO4.
2. Mức độ thông hiểu (trung bình)
Câu 18. Cho hai khí với thể tích là 1:1 ra ngoài ánh sáng mặt trời thì có hiện tượng nổ, hai khí đó là
A. N2 và H2. B. H2 và O2. C. Cl2 và H2. D. H2S và Cl2.
Câu 19 (C.07): Các khí có thể cùng tồn tại trong một hỗn hợp là
A. NH3 và HCl. B. H2S và Cl2. C. Cl2 và O2. D. HI và O3.
Câu 20. Khi mở vòi nước máy, nếu chú ý một chút sẽ phát hiện mùi lạ. Đó là do nước máy còn lưu giữ vết tích của thuốc sát trùng. Đó chính là clo và người ta giải thích khả năng diệt khuẩn là do
A. clo độc nên có tính sát trùng.
B. clo có tính oxi hóa mạnh.
C. clo tác dụng với nước tạo ra HClO chất này có tính oxi hóa mạnh.
D. một nguyên nhân khác.
Câu 21. Cho sơ đồ chuyển hoá: Fe FeCl3 Fe(OH)3 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là:
A. NaCl, Cu(OH)2. B. HCl, NaOH. C. Cl2, NaOH. D. HCl, Al(OH)3.
Câu 22 (A.07): Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. điện phân dung dịch NaCl có màng ngăn.
D. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Câu 23. Phương pháp điều chế khí clo trong công nghiệp là
A. cho HCl tác dụng với chất oxi hóa mạnh.
B. điện phân dung dịch NaCl không có màng ngăn xốp.
C. điện phân dung dịch NaCl có màng ngăn xốp.
D. Điện phân nóng chảy NaCl.
Câu 24. Phản ứng nào sau đây được dùng để điều chế clo trong phòng thí nghiệm ?
A. 2NaCl → 2Na + Cl2
B. 2NaCl + 2H2O → H2 + 2NaOH + Cl2
C. MnO2 + 4HClđặc → MnCl2 + Cl2 + 2H2O
D. F2 + 2NaCl → 2NaF + Cl2
Câu 25. Cho phương trình hóa học: KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O. Hệ số cần bằng của các chất lần lượt là:
A. 2, 12, 2, 2, 3, 6. B. 2, 14, 2, 2, 4, 7. C. 2, 8, 2, 2, 1, 4. D. 2, 16, 2, 2, 5, 8.
Câu 26. Để điều chế clo trong công nghiệp ta phải dùng bình điện phân có màng ngăn cách hai điện cực với mục đích
A. Tránh Cl2 tiếp xúc với dung dịch NaOH. B. Thu được dung dịch nước Giaven.
C. Bảo vệ các điện cực không bị ăn mòn. D. Cả A, B và C đều đúng.
3. Mức độ vận dụng (khá)
Câu 27. Cho dãy các chất sau: dung dịch NaOH, KF, NaBr, H2O, Ca, Fe, Cu. Khí clo tác dụng trực tiếp với bao nhiêu chất trong dãy trên?
A. 7. B. 4. C. 5. D. 6.
Câu 28 (C.09): Chất dùng để làm khô khí Cl2 ẩm là
A. Na2SO3 khan. B. dung dịch NaOH đặc.
C. dung dịch H2SO4 đậm đặc. D. CaO.
Câu 29. [Thanh Chương I – Nghệ An – Lần 1/2019] Người ta thu khí X sau khi điều chế như hình vẽ bên dưới đây:
Trong các khí: N2, Cl2, SO2, NO2, số chất thoả mãn là
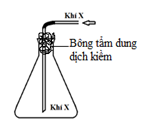
A. 4. B. 1. C. 3. D. 2.
Câu 30 (B.14): Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
Khí Cl2 sinh ra thường lẫn hơi nước và hiđro clorua. Để thu được khí Cl2 khô thì bình (1) và bình (2) lần lượt đựng
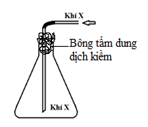
A. dung dịch NaCl và dung dịch H2SO4 đặc. B. dung dịch H2SO4 đặc và dung dịch NaCl.
C. dung dịch H2SO4 đặc và dung dịch AgNO3.D. dung dịch NaOH và dung dịch H2SO4 đặc.
Câu 31. Cho các phản ứng:
(1) Cl2 + dung dịch KI vừa đủ → (2) Cl2 + H2O
(3) MnO2 + HCl đặc (4) Cl2 (khí) + H2S (khí) →
Các phản ứng tạo ra đơn chất là:
A. (1), (2), (3). B. (1), (3), (4). C. (2), (3), (4). D. (1), (2), (4).
Câu 32. Cho các phản ứng sau:
(1) A + HCl → MnCl2 + B↑ + H2O (2) B + C → nước gia-ven
(3) C + HCl → D + H2O (4) D + H2O → C + B↑+ E↑
Chất Khí E là chất nào sau đây?
A. O2. B. H2. C. Cl2O. D. Cl2.
Câu 33. Cho sơ đồ biến hoá sau: Cl2 → A → B → C → A → Cl2. Trong đó A, B, C đều là những chất rắn, B và C đều là hợp chất của Na. A, B, C trong chuỗi biến hoá có thể là các chất nào dưới đây ?
A. NaCl, NaBr, Na2CO3 B. NaBr, NaOH, Na2CO3
C. NaCl, Na2CO3, NaOH D. NaCl, NaOH, Na2CO3
Câu 34: Có các nhận xét sau về clo và hợp chất của clo
(1) Nước Gia-ven có khả năng tẩy mầu và sát khuẩn.
(2) Cho giấy quì tím vào dung dịch nước clo thì quì tím chuyển mầu hồng sau đó lại mất mầu.
(3) Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
(4) Trong công nghiệp, Cl2 được điều chế bằng cách điện phân dung dịch NaCl (màng ngăn, điện cực trơ).
Trong các nhận xét trên, số nhận xét đúng là
A. 2. B. 3. C. 4. D. 1
Câu 35. Cho các phát biểu sau:
(1) Clo được dùng sản xuất kaliclorat, nước Gia-ven, cloruavôi.
(2) Clo được dùng tẩy trắng sợi, giấy, vải và sát trùng nước sinh hoạt
(3) Số oxi hoá của clo trong các chất: NaCl, NaClO, KClO3, Cl2, KClO4 lần lượt là: –1, +1, +3, 0, +7.
(4) Hoà tan khí Cl2 vào dung dịch KOH loãng, nguội, dư, dung dịch thu được có các chất KCl, KClO3, KOH, H2O.
(5) Clo tác dụng được với tất cả các chất H2, Na, O2, Cu ở điều kiện thích hợp.
(6) Trong phòng thí nghiệm người ta có thể điều chế Cl2 từ HCl đặc và các chất như MnO2, KMnO4, KClO3.
(7) Trong tự nhiên clo chủ yếu tồn tại ở dạng đơn chất.
(8) Trong công nghiệp người ta sản xuất clo bằng cách điện phân dung dịch NaCl có màng ngăn xốp.
Số phát biểu đúng là
A. 3. B. 4. C. 5. D. 6.
_____HẾT_____
CĐ3: HIĐRO CLORUA – AXIT CLOHIĐRIC VÀ MUỐI CLORUA
|
KIẾN THỨC CẦN NHỚ 1. Tính chất của hiđroclorua và axit clohiđric – Hiđro clorua là chất khí không màu, mùi xốc, nặng hơn không khí, tan nhiều trong nước → dung dịch axit clohiđric. – Axit clohiđric có tính axit và tính khử: (a) Tính axit ⬥ Đổi màu quì tím → đỏ. ⬥ Tác dụng với kim loại → Muối (KL hóa trị thấp) + H2. ⬥ Tác dụng với oxit bazơ, bazơ → Muối + H2O. ⬥ Tác dụng với muối → muối mới + axit mới. (b) Tính khử: Tác dụng với các chất oxi hóa mạnh: MnO2, KMnO4, KClO3, K2Cr2O7 … MnO2 + 4HClđặc → MnO2 + Cl2 + 2H2O 2KMnO4 + 16HClđặc → 2KCl + 2MnCl2 + 5Cl2 + 8H2O K2Cr2O7 + 14HClđặc → 2KCl + 2CrCl3 + 3Cl2 + 7H2O 2. Điều chế axit clohiđric – Trong PTN: PP sunfat: NaCl rắn + H2SO4 đặc → Na2SO4 + HCl. – Trong CN: H2 + Cl2 → 2HCl hoặc PP sunfat như trong PTN. 3. Muối halogenua và nhận biết – Đặc điểm của muối bạc halogenua:
– Các bước làm bài tập nhận biết dung dịch: Bước 1: Dùng qùi tím (hoặc phenolphtalein) chia thành 3 nhóm: ▪ Dung dịch có môi trường axit (làm qùi tím hóa đỏ). ▪ Dung dịch có môi trường bazơ (làm qùi tím hóa xanh). ▪ Dung dịch có môi trường trung tính (không đổi màu qùi tím). Bước 2: Dùng thuốc thử thích hợp (tạo kết tủa, hợp chất có màu hoặc chất khí để nhận biết ra các ion trong từng nhóm (tham khảo phụ lục). |
❖ BÀI TẬP TỰ LUẬN
Câu 1: Hoàn thành chuỗi phản ứng:
(1) ………………………………………………………..…..
(2) ………………………………………………………..…..
(3) ………………………………………………………..…..
(4) ………………………………………………………..…..
(5) ………………………………………………………..…..
(6) ………………………………………………………..…..
Câu 2: Nhận biết các dung dịch mất nhãn sau:
(a) H2SO4, KOH, NaCl, Ca(OH)2.
|
|
H2SO4 |
KOH |
NaCl |
Ca(OH)2 |
|
|
|
|
|
|
|
|
|
|
|
|
PTHH: …………………………………………………………………….
(b) HCl, KOH, NaI, NaCl, NaNO3.
|
|
HCl |
KOH |
NaI |
NaCl |
NaNO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PTHH: (1) …………………………………………………………………….
(2) …………………………………………………………………….
(c) NaCl, NaBr, KI, HCl, H2SO4, KOH.
|
|
NaCl |
NaBr |
KI |
HCl |
H2SO4 |
KOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PTHH: (1) …………………………………………………………………….
(2) …………………………………………………………………….
(3) …………………………………………………………………….
(d) MgCl2, AlCl3, FeCl2, FeCl3, CuCl2, NaCl (chỉ sử dụng thêm một thuốc thử).
|
|
MgCl2 |
AlCl3 |
FeCl2 |
FeCl3 |
CuCl2 |
NaCl |
|
|
|
|
|
|
|
|
PTHH: (1) …………………………………………………………………….
(2) …………………………………………………………………….
(3) …………………………………………………………………….
(4) …………………………………………………………………….
(5) …………………………………………………………………….
(e) NaCl, H2SO4, CuSO4, BaCl2, NaOH (không sử dụng thêm thuốc thử).
|
|
NaCl |
H2SO4 |
CuSO4 |
BaCl2 |
NaOH |
|
NaCl |
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
CuSO4 |
|
|
|
|
|
|
BaCl2 |
|
|
|
|
|
|
NaOH |
|
|
|
|
|
Kết luận: ……………………………………………………………………………………………………….
……………………………………………………………………………………………………….
……………………………………………………………………………………………………….
……………………………………………………………………………………………………….
……………………………………………………………………………………………………….
Câu 2: Nhận biết các khí sau:
(a) HCl, NH3, H2, N2.
|
|
HCl |
NH3 |
H2 |
N2 |
|
|
|
|
|
|
|
|
|
|
|
|
(b) Cl2, HCl, O2, H2, N2.
|
|
Cl2 |
HCl |
O2 |
H2 |
N2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
❖ BÀI TẬP TRẮC NGHIỆM
1. Mức độ nhận biết (rất dễ và dễ)
Câu 1. Số oxi hóa của clo trong hợp chất HCl là
A. +1. B. -1. C. 0. D. +2.
Câu 2. Khí hiđro clorua có công thức hóa học là
A. HCl. B. HClO2. C. KCl. D. NaClO.
Câu 3. Khí HCl khô khi gặp quỳ tím thì làm quỳ tím
A. chuyển sang màu đỏ. B. chuyển sang màu xanh.
C. không chuyển màu D. chuyển sang không màu.
Câu 4. Khí HCl khi tan trong nước tạo thành dung dịch axit clohiđric. Axit clohiđric khi tiếp xúc với quỳ tím làm quỳ tím
A. chuyển sang màu đỏ B. chuyển sang màu xanh.
C. không chuyển màu. D. chuyển sang không màu.
Câu 5: Chất nào sau đây không tác dụng với dung dịch HCl?
A. Al. B. KMnO4. C. Cu(OH)2. D. Cu.
Câu 6. [QG.19 – 201] Kim loại nào sau đây không tan được trong dung dịch HCl?
A. Al. B. Ag. C. Zn. D. Mg.
Câu 7: Trong các phản ứng sau, phản ứng nào sai?
A. Zn + 2HCl → ZnCl2 + H2. B. Cu + 2HCl → CuCl2 + H2.
C. CuO + 2HCl → CuCl2 + H2O. D. AgNO3 + HCl → AgCl + HNO3.
Câu 8: Dãy gồm các kim loại đều tác dụng được với dung dịch HCl là
A. Cu, Fe, Al. B. Fe, Mg, Al. C. Cu, Pb, Ag. D. Fe, Au, Cr.
Câu 9. Thuốc thử của axit clohiđric và muối clorua là dung dịch
A. AgNO3. B. Na2CO3. C. NaOH. D. phenolphthalein.
Câu 10. Trong phòng thí nghiệm người ta thường điều chế khí HCl bằng cách
A. clo hoá các hợp chất hữu cơ. B. cho clo tác dụng với hiđro.
C. đun nóng dung dịch HCl đặc. D. cho NaCl rắn tác dụng với H2SO4 đặc.
Câu 11. Phản ứng nào sau đây được dùng để điều chế khí hiđro clorua trong phòng thí nghiệm?
A. H2 + Cl2 → 2HCl B. Cl2 + H2O → HCl + HClO
C. Cl2 + SO2 + 2H2O → 2HCl + H2SO4 D. NaClrắn + H2SO4 đặc → NaHSO4 + HCl
Câu 12. X là một loại muối clorua, là nguyên liệu quan trọng trong công nghiệp hóa chất để điều chế Cl2, H2, NaOH, nước Gia-ven,.. đặc biệt quan trọng trong bảo quản thực phẩm và làm gia vị thức ăn. X là
A. ZnCl2 B. AlCl3 C. NaCl D. KCl
2. Mức độ thông hiểu (trung bình)
Câu 13: Nhận xét nào sau đây về hiđro clorua là không đúng?
A. Có tính axit. B. Là chất khí ở điều kiện thường.
C. Mùi xốc. D. Tan tốt trong nước.
Câu 14: Phản ứng nào sau đây xảy ra không tạo muối FeCl2?
A. Fe + HCl. B. Fe3O4 + HCl. C. Fe + Cl2. D. Fe + FeCl3.
Câu 15. [MH3.2017] Oxit nào sau đây tác dụng với dung dịch HCl sinh ra hỗn hợp muối?
A. Al2O3. B. Fe3O4. C. CaO. D. Na2O.
Câu 16. Kim loại nào sau đây tác dụng với dung dịch HCl loãng và khí Cl2 cho cùng một muối clorua?
A. Fe. B. Zn. C. Cu. D. Ag.
Câu 17: Phản ứng nào sau đây HCl thể hiện tính khử?
A. HCl + NaOH → NaCl + H2O. B. 2HCl + CaCO3 → CaCl2 + CO2 + H2O.
C. 2HCl + Mg → MgCl2 + H2. D. 4HCl + MnO2 → MnCl2 + Cl2 + H2O.
Câu 18: Phản ứng nào sau đây HCl thể hiện tính oxi hóa?
A. CuO + 2HCl ⟶ CuCl2 + H2O. B. Fe + 2HCl ⟶ FeCl2 + H2.
C. Fe(OH)2 + 2HCl ⟶ FeCl2 + H2O. D. KClO3 + 6HCl ⟶ KCl + 3Cl2 + 3H2O.
Câu 19: Trong các dãy chất dưới đây, dãy nào gồm các chất đều tác dụng được với dung dịch HCl?
A. Fe2O3, KMnO4, Cu. B. Fe, CuO, Ba(OH)2.
C. CaCO3, H2SO4, Mg(OH)2. D. AgNO3, MgCO3, BaSO4.
Câu 20. Axit clohiđric có thể tham gia phản ứng oxi hóa khử với vai trò
A. chất khử. B. chất oxi hóa. C. môi trường. D. tất cả đều đúng.
Câu 21. Cho kim loại M tác dụng với Cl2 được muối X; cho kim loại M tác dụng với dung dịch HCl được muối Y. Nếu cho kim loại M tác dụng với dung dịch muối X ta cũng được muối Y. Kim loại M có thể là
A. Al. B. Zn. C. Cu. D. Fe.
Câu 22. Dãy các chất nào sau đây đều tác dụng với axit clohidric?
A. Fe2O3, KMnO4, Cu, Fe, AgNO3. B. Fe2O3, KMnO4¸Fe, CuO, AgNO3.
C. Fe, CuO, H2SO4, Ag, Mg(OH)2. D. KMnO4, Cu, Fe, H2SO4, Mg(OH)2.
Câu 23. Cho các chất sau: KOH (1), Zn (2), Ag (3), Al(OH)3 (4), KMnO4 (5), K2SO4 (6). Axit HCl tác dụng được với các chất:
A. (1), (2), (4), (5). B. (3), (4), (5), (6). C. (1), (2), (3), (4). D. (1), (2), (3), (5).
3. Mức độ vận dụng (khá)
Câu 24. Tiến hành thí nghiệm như hình vẽ. Khí A trong bình có thể là khí nào dưới đây?
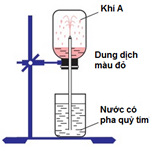
A. H2S B. NH3 C. SO2 D. HCl
Câu 25. [Chu Văn An HN – Lần 1/2019] Trong phòng thí nghiệm, khí X được điều chế và thu theo hình vẽ bên. Phản ứng nào sau đây không áp dụng được với cách thu khí này?
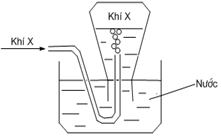
A. NaCl(r) + H2SO4(đặc) → HCl(k) + NaHSO4.
B. CaC2 + 2H2O → Ca(OH)2 + C2H2.
C. 2KClO3 → 2KCl + 3O2.
D. Fe + HCl → FeCl2 + H2↑
Câu 26. Quan sát mô hình thí nghiệm thực hành dưới đây với các dung dịch loãng cùng nồng độ:
Hãy cho biết hiện tượng xảy ra trong từng ống nghiệm
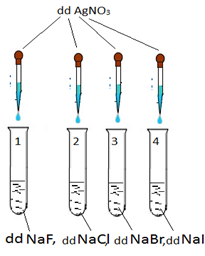
A. ống 1 không thấy hiện tượng gì, ống 2 cho kết tủa trắng, ống 3 cho kết tủa vàng nhạt, ống 4 cho kết tủa vàng đậm
B. ống 1,2 cho kết tủa trắng, ống 3 cho kết tủa vàng nhạt, ống 4 cho kết tủa vàng đậm
C. ống 1, 2 cho kết tủa trắng, ống 3, 4 cho kết tủa vàng đậm
D. ống 1 không thấy hiện tượng gì, ống 2 cho kết tủa trắng xanh, ống 3, 4 cho kết tủa vàng nhạt.
Câu 27: Cho phản ứng: 2KMnO4 +16 HCl (đặc) → 2KCl + 2MnCl2 + 5Cl2 +8 H2O
Hệ số cân bằng phản ứng là các số tối giản. Số phân tử HCl đóng vai trò chất khử là:
A. 16. B. 5. C. 10. D. 8.
Câu 28 (A.10): Trong phản ứng: 1K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 +2 KCl + 7H2O
Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là
A. 3/14. B. 4/7. C. 1/7. D. 3/7.
Câu 29. Có các hóa chất sau đựng riêng biệt trong các lọ mất nhãn: KCl, MgCl2, FeCl2, FeCl3, AlCl3, NH4Cl, (NH4)2SO4. Thuốc thử có thể dùng để nhận biết các hóa chất trên là
A. NaOH. B. Ba(OH)2. C. Ba(NO3)2. D. AgNO3.
Câu 30 (B.09): Cho các phản ứng sau:
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2. B. 3. C. 1. D. 4.
Câu 31 (A.08): Cho các phản ứng sau:
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
2HCl + Fe → FeCl2 + H2.
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O.
6HCl + 2Al → 2AlCl3 + 3H2.
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
A. 2. B. 1. C. 4. D. 3.
Câu 32: Cho các phản ứng sau:
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2HCl + Fe → FeCl2 + H2
6HCl + 2Al → 2AlCl3 + 3H2
Số phản ứng trong đó HCl thể hiện tính khử là
A. 3. B. 4. C. 2. D. 1.
_____HẾT_____
CHUYÊN ĐỀ 4: HỢP CHẤT CHỨA OXI CỦA CLO
|
KIẾN THỨC CẦN NHỚ 1. Axit chứa oxi của clo
2. Nước Gia – ven, clorua vôi, kali clorat
|
|||||||||||||||||||||||||||||||||||
❖ BÀI TẬP TỰ LUẬN
Câu 1: Hoàn thành bảng sau:
|
Công thức |
Tên gọi |
Số oxi hóa của clo |
|
HClO |
|
|
|
HClO2 |
|
|
|
HClO3 |
|
|
|
HClO4 |
|
|
|
NaClO |
|
|
|
Ca(ClO)2 |
|
|
|
CaOCl2 |
|
|
|
KClO3 |
|
|
Câu 2: Hoàn thành chuỗi phản ứng sau:
(1) ………………………………………………………..…..
(2) ………………………………………………………..…..
(3) ………………………………………………………..…..
(4) ………………………………………………………..…..
(5) ………………………………………………………..…..
(6) ………………………………………………………..…..
Câu 3: Từ NaCl, MnO2, NaOH, KOH, Ca(OH)2 và H2SO4 đặc hãy viết PTHH điều chế nước Gia – ven, clorua vôi và kali clorat.
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
Câu 4: Trong phòng thí nghiệm có CaO, H2O, H2SO4 70% (D = 1,61 g/ml) và NaCl. Hỏi cần phải dùng những chất gì và với khối lượng là bao nhiêu để điều chế 254 gam clorua vôi?
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
❖ BÀI TẬP TRẮC NGHIỆM
1. Mức độ nhận biết (rất dễ và dễ)
Câu 1. Axit pecloric có công thức
A. HClO. B. HClO2. C. HClO3. D. HClO4.
Câu 2. Axit cloric có công thức
A. HClO. B. HClO2. C. HClO3. D. HClO4.
Câu 3. Hợp chất nào có tính oxi hóa mạnh nhất?
A. HClO. B. HClO2. C. HClO3. D. HClO4.
Câu 4. Hợp chất nào có tính axit mạnh nhất?
A. HClO. B. HClO2. C. HClO3. D. HClO4.
Câu 5. NaClO có tên gọi là
A. Natri clorua. B. Natri clorat. C. Natri hipoclorit. D. Natri clorit.
Câu 6. Hỗn hợp nào sau đây được gọi là nước Gia-ven?
A. KCl + KClO3. B. NaCl + NaClO. C. CaCl2 + Ca(OCl)2. D. NaCl + NaClO3.
Câu 7. Clorua vôi là tên gọi của hợp chất nào sau đây?
A. CaCl2. B. CaClO2. C. Ca(OCl)2. D. CaOCl2.
2. Mức độ thông hiểu (trung bình)
Câu 8. Clorua vôi được điều chế bằng cách nào sau đây?
A. Cho clo tác dụng với nước.
B. Cho clo tác dụng với dung dịch NaOH loãng nguội
C. Cho clo tác dụng với Ca(OH)2 đặc ở 30oC.
D. Cho clo tác dụng với Ca(OH)2 đặc ở 100oC.
Câu 9. Nước Gia-ven được điều chế bằng cách nào sau đây?
A. Cho clo tác dụng với nước.
B. Cho clo tác dụng với dung dịch NaOH loãng nguội
C. Cho clo tác dụng với dung dịch Ca(OH)2.
D. Cho clo tác dụng với dung dịch KOH.
Câu 10. Xét phản ứng: 2Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
Trong phản ứng trên, Cl2 đóng vai trò
A. chất khử. B. vừa là chất oxi hóa, vừa là chất khử.
C. chất oxi hóa. D. môi trường.
Câu 11. Phản ứng nào là phản ứng tự oxi hóa – khử?
A. MnO2 + 4HCl → 2MnCl2 + Cl2 + 2H2O
B. 2KI + O3 + H2O → 2KOH + I2 + O2
C. 2Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
D. Fe2O3 + 2Al→ Al2O3 + 2Fe
Câu 12. Phương trình phản ứng nào sau đây không đúng?
A. 2NaOH(loãng) + Cl2 → NaCl + NaClO + 2H2O
B. 2NaOH(loãng) + Cl2 → NaCl + NaClO + 2H2O
C. 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
D. 2Ca(OH)2(loãng) + 2Cl2 → CaCl2 + Ca(OCl)2 + 2H2O
Câu 13. Phương trình phản ứng nào sau đây biểu diễn đúng?
A. Ca(OH)2(khan) + Cl2 → CaOCl2 + 2H2O
B. Ca(OH)2(loãng) + Cl2 → CaOCl2 + 2H2O
C. 3Cl2 + 6NaOH(khan) → 5NaCl + NaClO3 + 3H2O
D. Ba(OH)2(loãng) + Cl2 → BaOCl2 + 2H2O
Câu 14. Hòa tan hết khí Cl2 vào dung dịch KOH loãng, dư, ở nhiệt độ phòng. Dung dịch thu được chứa các chất thuộc dãy nào dưới đây?
A. KCl, KClO, H2O. B. KCl, KClO, KOH, H2O.
C. KCl, KClO3, KOH. D. KCl, KClO3.
Câu 15. Hòa tan khí Cl2 vào dung dịch KOH đặc, nóng, lấy dư. Dung dịch thu được chứa các chất thuộc dãy nào dưới đây?
A. KCl, KClO3, Cl2. B. KCl, KClO, KOH, H2O.
C. KCl, KClO3, KOH, H2O. D. KCl, KClO3.
Câu 16. Clorua vôi là
A. muối tạo bởi kim loại liên kết với một gốc axit.
B. muối tạo bởi kim loại liên kết với hai gốc axit.
C. muối tạo bởi hai kim loại liên kết với một gốc axit.
D. muối tạo bởi hai kim loại liên kết với hai gốc axit.
Câu 17. Phát biểu nào sau đây là không đúng?
A. Clorua vôi có công thức CaOCl2.
B. Nước Gia – ven và clorua vôi đều có khả năng tẩy trùng và sát khuẩn.
C. Khả năng sát khuẩn, tẩy màu của nước clo là do axit hipoclorơ có tính oxi hóa mạnh.
D. Kali clorat được điều chế bằng cách sục clo vào dung dịch KOH ở nhiệt độ thường.
Câu 18. Clorua vôi được sử dụng để sát trùng, tẩy uế phổ biến hơn nước Gia – ven không phải do nguyên nhân nào sau đây?
A. Clorua vôi rẻ tiền hơn. B. Clorua vôi dễ bảo quản.
C. Clorua vôi có hàm lượng clorua lớn hơn. D. Clorua vôi dễ sử dụng hơn.
❖ Mức độ vận dụng
Câu 19. Trong phản ứng: CaOCl2 + 2HCl → CaCl2 + Cl2↑ + H2O, CaOCl2 đóng vai trò
A. chất khử. B. vừa là chất khử, vừa là chất oxi hóa.
C. chất oxi hóa. D. không là chất khử, không là chất oxi hóa
Câu 20. Cho các phát biểu sau
(a) Nước clo có tính tẩy màu vì chứa HCl có tính khử mạnh
(b) Clorua vôi là muối hỗn tạp vì chứa 2 loại gốc axit
(c) Clorua vôi được điều chế bằng cách cho vôi sữa hoặc vôi tôi tác dụng với Clo.
(d) Clorua vôi và nước Gia-vel đều có tính oxi hóa.
Số phát biểu sai là
A. 1 B. 2 C. 3 D. 4
Câu 21. Cho phản ứng hóa học: 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O. Tỉ lệ giữa số nguyên tử clo đóng vai trò chất oxi hóa và số nguyên tử clo đóng vai trò chất khử trong phương trình hóa học của phản ứng đã cho tương ứng là
A. 3 : 1. B. 1 : 3. C. 5 : 1. D. 1 : 5.
_____HẾT_____
Xem thêm