Giáo án Hóa học 10 Chân trời sáng tạo bản word trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 20k cho 1 bài Giáo án lẻ bất kì):
B1: – –
B2:
Xem thử tài liệu tại đây: Link tài liệu
|
Trường THPT …………. Tổ: ………………….. |
Họ và tên giáo viên
|
|||
|
BÀI 5. CẤU TẠO BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC |
||||
|
Tuần: |
Tiết: |
Ngày soạn: |
Thời gian thực hiện: 3 tiết |
|
I. MỤC TIÊU
1. Năng lực chung
– Tự chủ và tự học: Chủ động, tích cực tìm hiểu về cấu tạo bảng tuần hoàn các nguyên tố hóa học.
– Giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học; Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
– Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
2. Năng lực hoá học
Nhận thức hoá học:
– Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hóa học và nêu được các khái niệm liên quan (ô, chu kì, nhóm);
– Nêu được nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hóa học (dựa theo cấu hình electron);
– Phân loại được nguyên tố (dựa theo cấu hình electron; nguyên tố s, p, d, f; dựa theo tính chất hóa học: kim loại, phi kim, khí hiếm).
Tìm hiểu thế giới tự nhiên dưới góc độ hoá học:
– Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
Vận dụng kiến thức, kĩ năng đã học:
– Phân loại được nguyên tố (dựa theo cấu hình electron: nguyên tố s, p, d, f; dựa theo tính chất hóa học: kim loại, phi kim, khí hiếm); Xác định được vị trí của nguyên tố trong bảng tuần hoàn dựa vào cấu hình electron.
3. Phẩm chất
– Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân;
– Hình thành thói quen tư duy, vận dụng các kiến thức đã học với thực tiễn cuộc sống;
– Có niềm say mê, hứng thú với việc khám phá và học tập hóa học.
II. ĐỒ DÙNG DẠY HỌC
– Hình ảnh về bảng tuần hoàn các nguyên tố hóa học; Hình ảnh phóng to của các hình 5.3; 5.4; 5.5 trong SGK Hoá học 10.
– Phiếu học tập.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a) Mục tiêu: Tạo tình huống có vấn đề, tạo hứng thú HS tìm hiểu về cấu tạo bảng tuần hoàn.
b) Nội dung: GV sử dụng câu hỏi mở đầu trong SGK để dẫn dắt vào bài.
c) Sản phẩm: HS xác định được mục tiêu học tập.
d) Tổ chức thực hiện:
– GV nêu vấn đề: Cách đây hàng nghìn năm, người ta chỉ biết đến một số nguyên tố như đồng (copper), bạc (silver) và vàng (gold). Mãi đến năm 1700, cũng chỉ mới có 13 nguyên tố được xác định. Khi đó, các nhà hóa học nghi ngờ rằng vẫn còn nhiều nguyên tố bí ẩn khác chưa được khám phá. Bằng việc sử dụng các phương pháp khoa học hiện đại, chỉ trong một thập kỉ (1765 – 1775) đã có thêm 5 nguyên tố hóa học được xác định. Trong đó, có 3 khí không màu là hydrogen, nitrogen và oxygen. Tính đến năm 2016, tổng cộng đã có 118 nguyên tố hóa học được xác định trên bảng tuần hoàn các nguyên tố hóa học. Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc nào và có mối liên hệ như thế nào với cấu hình electron nguyên tử của nguyên tố đó? Chúng ta cùng tìm hiểu vấn đề này trong bài học hôm nay.
– HS xác định mục tiêu bài học.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu về lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học
a) Mục tiêu:
Trình bày được cách sắp xếp các nguyên tố hóa học theo bảng tuần hoàn Mendeleev và theo bảng tuần hoàn hiện đại ngày nay.
b) Nội dung:
Từ việc quan sát Hình 5.1 và 5.2 trong SGK, GV yêu cầu HS dự đoán nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn của Mendeleev. Qua đó tìm hiểu lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
c) Sản phẩm:
– Kết quả phiếu học tập số 1.
– Bài trình bày nguyên tắc sắp xếp các nguyên tố hóa học theo bảng tuần hoàn Mendeleev và theo bảng tuần hoàn hiện đại ngày nay.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV |
HOẠT ĐỘNG CỦA HS |
|
GV giao nhiệm vụ: – Chia lớp thành 4 nhóm, yêu cầu HS quan sát hình 5.1 và 5.2 trong SGK, thảo luận, hoàn thiện phiếu học tập số 1: PHIẾU HỌC TẬP SỐ 1 1. Quan sát Hình 5.1, hãy mô tả bảng tuần hoàn các nguyên tố hóa học theo Mendeleev. Nhận xét về cách sắp xếp các nguyên tố hóa học theo chiều từ trên xuống dưới trong cùng một cột. 2. Quan sát hai nguyên tố Te và I trong hình 5.1, em nhận thấy điều gì khác thường? 3. Hãy cho biết dấu chấm hỏi trong bảng tuần hoàn ở hình 5.1 có hàm ý gì? 4. Quan sát hình 5.2, hãy cho biết 3 nguyên tố Sc, Ga và Ge nằm ở vị trí nào trong bảng tuần hoàn Mendeleev (Hình 5.1)?
– GV yêu cầu đại diện nhóm trình bày, các nhóm khác nhận xét, bổ sung. – GV tổng kết, chuẩn hoá kiến thức. |
HS nhận nhiệm vụ, thảo luận, điền kết quả vào phiếu học tập: PHIẾU HỌC TẬP SỐ 1 1. Bảng tuần hoàn các nguyên tố hóa học của Mendeleev gồm kí hiệu các nguyên tố hóa học và khối lượng nguyên tử của chúng. Cách sắp xếp các nguyên tố theo Mendeleev: Các nguyên tố được sắp xếp vào các hàng và các cột theo chiều tăng dần khối lượng nguyên tử, bắt đầu mỗi hàng khi tính chất của nguyên tố bắt đầu lặp lại. 2. Quan sát hai nguyên tố Te và I trong Hình 5.1 ta thấy: Nguyên tố Te có khối lượng nguyên tử (bằng 128) lớn hơn khối lượng nguyên tử I (bằng 127) nhưng được xếp trên I. 3. Các dấu chấm hỏi trong bảng tuần hoàn ở hình 5.1 (cụ thể 10 dấu chấm hỏi) là các dự đoán của Mendeleev về các nguyên tố mới (gồm 10 nguyên tố). Trong đó có 3 nguyên tố (sau này chính là Sc; Ga và Ge) được ông miêu tả khá tỉ mỉ về tính chất vật lí của đơn chất và một số hợp chất của chúng. 4. – Dựa vào bảng tuần hoàn (Hình 5.2) ta thấy: + Sc nằm giữa Ca (khối lượng nguyên tử bằng 40) và Er (khối lượng nguyên tử bằng 56). + Ga được dự đoán có khối lượng nguyên tử bằng 68 và nằm ngay dưới Zn (khối lượng nguyên tử bằng 65,2), cạnh Al. + Ge được dự đoán có khối lượng nguyên tử bằng 70, nằm ngay trên As (khối lượng nguyên tử bằng 75) và nằm dưới Ga. – Đại diện nhóm trình bày, các nhóm khác theo dõi nhận xét. |
|
Kiến thức trọng tâm – Năm 1869, nhà hoá học Mendeleev đã công bố bảng tuần hoàn các nguyên tố hoá học, trong đó, các nguyên tố đã được sắp xếp theo thứ tự tăng dần khối lượng nguyên tử. – Bảng tuần hoàn hiện đại ngày nay được xây dựng trên cơ sở mối liên hệ giữa số hiệu nguyên tử và tính chất của nguyên tố, các nguyên tố được sấp xếp theo thứ tự tăng dần số hiệu nguyên tử. |
|
Hoạt động 2: Tìm hiểu ô nguyên tố
a) Mục tiêu
Mô tả được: khái niệm ô nguyên tố, các thông tin của nguyên tố trong ô nguyên tố, cách xác định số thứ tự của ô nguyên tố.
b) Nội dung
Từ việc quan sát hình 5.3 trong SGK, GV hướng dẫn HS hiểu được khái niệm ô nguyên tố và các thông tin của nguyên tố trong ô nguyên tố.
c) Sản phẩm:
– Bài trình bày các thông tin của nguyên tố trong ô nguyên tố.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV |
HOẠT ĐỘNG CỦA HS |
|
Nhiệm vụ học tập: – Quan sát một ô nguyên tố ở hình 5.3 trong SGK, thảo luận và thực hiện nhiệm vụ: |
HS nhận nhiệm vụ. |
|
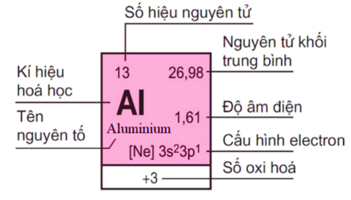
Thực hiện nhiệm vụ 1: Yêu cầu HS thảo luận và trả lời câu hỏi. 5. Quan sát hình 5.3, em hãy nêu các thông tin có trong ô nguyên tố aluminium.
Sau khi HS trình bày báo cáo nhiệm vụ, GV hướng dẫn HS rút ra khái niệm ô nguyên tố và cách xác định số thứ tự của ô nguyên tố. |
– HS thảo luận theo cặp. – Trình bày câu trả lời hoặc nhận xét, bổ sung. 5. Các thông tin có trong ô nguyên tố aluminium: – Số hiệu nguyên tử: 13. – Kí hiệu hóa học: Al. – Tên nguyên tố: Aluminium. – Số oxi hóa: +3. – Cấu hình electron: [Ne] 3s23p1. – Độ âm điện: 1,61. – Nguyên tử khối trung bình: 26,98.
|
…………………………………………
…………………………………………
…………………………………………
Tài liệu có 14 trang, trên đây trình bày tóm tắt 5 trang của Giáo án Hóa hoc 10 Chân trời sáng tạo Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học.
Xem thêm các bài giáo án Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Giáo án Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Giáo án Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Giáo án Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kỳ và nhóm
Giáo án Bài 7: Định luật tuần hoàn. Ý nghĩa bảng tuần hoàn các nguyên tố hóa học
Giáo án Bài 8: Quy tắc octet
Để mua Giáo án Hóa học 10 Chân trời sáng tạo năm 2023 mới nhất, mời Thầy/Cô liên hệ https://tailieugiaovien.com.vn/