Giải SBT Hoá học lớp 10 Bài 14: Ôn tập chương 3
Nhận biết
Bài 14.1 trang 36 SBT Hóa học 10: Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
A. H2S
B. PCl5
C. SiO2
D. Br2
Lời giải
Đáp án đúng là: B
Quy tắc octet không đúng với trường hợp phân tử PCl5 vì xung quanh P có 10 electron liên kết.
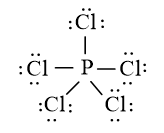
Bài 14.2 trang 36 SBT Hóa học 10: Phát biểu nào sau đây không đúng về liên kết có trong phân tử HCl?
A. Giữa nguyên tử H và Cl có một liên kết đơn.
B. Các electron tham gia liên kết đồng thời bị hút về phía hai hạt nhân.
C. Phân tử có một momen lưỡng cực.
D. Một electron của nguyên tử hydrogen và một electron của nguyên tử chlorine được góp chung và cách đều hai nguyên tử.
Lời giải
Đáp án đúng là: D
Phát biểu D là sai vì một electron của nguyên tử hydrogen và một electron của nguyên tử chlorine được góp chung và bị lệch về phía nguyên tử chlorine vì nguyên tử chlorine có độ âm điện lớn hơn.
Bài 14.3 trang 36 SBT Hóa học 10: Liên kết ion khác với liên kết cộng hóa trị ở điểm nào sau đây?
A. Tính bão hòa lớp electron ở vỏ nguyên tử.
B. Tuân theo quy tắc octet.
C. Tạo ra hợp chất bền vững hơn.
D. Tính không định hướng.
Lời giải
Đáp án đúng là: D
Liên kết ion khác với liên kết cộng hóa trị là liên kết cộng hóa trị có tính định hướng trong không gian.
Liên kết cộng hóa trị được tạo thành do sự xen phủ các orbital theo trục liên kết (s, px, py, pz).
Bài 14.4 trang 36 SBT Hóa học 10: Cho chất hữu cơ A có công thức cấu tạo sau:
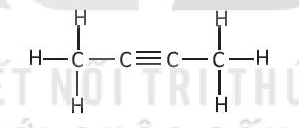
Số liên kết σ trong phân tử A là
A. 6
B. 8
C. 9
D. 11
Lời giải
Đáp án đúng là: C
Cách 1:
Hợp chất A gồm 8 liên kết đơn là liên kết σ.
Liên kết ba C≡C gồm 1 liên kết σ và 2 liên kết π.
Vậy tổng số liên kết σ trong hợp chất A là 9.
Cách 2:
Công thức phân tử của hợp chất: C4H6
Số liên kết σ = số C + số H – 1 = 4 + 6 – 1 = 9.
Bài 14.5 trang 36 SBT Hóa học 10: Cho giá trị độ âm điện của một số nguyên tố sau: Na (0,93); Li (0,98); Mg (1,31); Al (1,61); P (2,19); S (2,58); Br (2,96) và Cl (3,16).
Phân tử nào sau đây có liên kết ion?
A. Na3P
B. MgS
C. AlCl3
D. LiBr
Lời giải
Đáp án đúng là: D
∆χ(Na3P) = |0,93 – 2,19| = 1,26
∆χ(MgS) = |1,31 – 2,58| =1,27
∆χ(AlCl3) = |1,61 – 3,16| = 1,55
∆χ(LiBr) = |0,98 – 2,96| = 1,98 > 1,7 ⇒ Liên kết ion.
Bài 14.6 trang 36 SBT Hóa học 10: Cho hai chất hữu cơ X và Y có công thức cấu tạo sau:
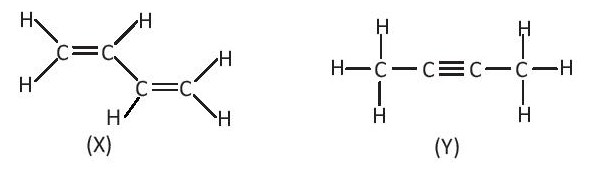
Nhận xét nào sau đây là đúng?
A. X và Y có số liên kết σ và số liên kết π bằng nhau.
B. X có số liên kết σ và số liên kết π nhiều hơn Y.
C. X có số liên kết σ nhiều hơn, nhưng số liên kêt π ít hơn Y.
D. X có số liên kết σ ít hơn, nhưng số liên kết π nhiều hơn Y.
Lời giải
Đáp án đúng là: A
X có 9 liên kết σ và 2 liên kết π.
Y có 9 liên kết σ và 2 liên kết π.
⇒ X và Y có số liên kết σ và số liên kết π bằng nhau.
Bài 14.7 trang 37 SBT Hóa học 10: Nguyên tố X ở nhóm IA và nguyên tố Y ở nhóm VIIA của bảng tuần hoàn. X và Y có thể tạo thành hợp chất R. Liên kết giữa các nguyên tử trong R thuộc loại liên kết nào sau đây?
A. Ion
B. Cộng hóa trị phân cực
C. Cộng hóa trị không phân cực
D. Hydrogen
Lời giải
Đáp án đúng là: A
X là kim loại điển hình, Y là phi kim điển hình ⇒ Liên kết giữa X và Y là liên kết ion.
Thông hiểu
Bài 14.8 trang 37 SBT Hóa học 10: X, Y, Z là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 19, 16. Các cặp nguyên tố có thể tạo thành liên kết ion và cộng hóa trị phân cực lần lượt là
A. (X, Y); (X, Z) và (Y, Z)
B. (X, Z); (Y, Z) và (X, Y).
C. (X, Y); (Y, Z) và (X, Z)
D. (Z, Y); (Y, X) và (X, Z)
Lời giải
Đáp án đúng là: C
X có cấu hình electron là: 1s22s22p4 ⇒ X thuộc nhóm VIA, chu kì 2, là phi kim.
Y có cấu hình electron là: 1s22s22p63s23p64s1 ⇒ Y thuộc nhóm IA, chu kì 4, là kim loaị điển hình.
Z có cấu hình electron là: 1s22s22p63s23p4 ⇒ Z thuộc nhóm VIA, chu kì 3, là phi kim.
⇒ Các cặp nguyên tố có thể tạo thành liên kết ion là (X, Y); (Y, Z)
Cặp nguyên tố có thể tạo thành liên kết cộng hóa trị phân cực là (X, Z).
Bài 14.9 trang 37 SBT Hóa học 10: Cho các chất sau: N2, H2, NH3, NaCl, HCl, H2O
Số chất mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là
A. 2
B. 4
C. 5
D. 3
Lời giải
Đáp án đúng là: A
Chất mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là: N2, H2 (hiệu độ âm điện bằng 0).
Bài 14.10 trang 37 SBT Hóa học 10: Cho các chất sau:
(1) H2S; (2) SO2; (3) NaCl; (4) CaO;
(5) NH3; (6) HBr; (7) CO2; (8) K2S;
Dãy nào sau đây gồm các chất có liên kết cộng hóa trị?
A. (1); (2); (3); (4); (7).
B. (1); (2); (5); (6); (7).
C. (1); (3); (5); (6); (7).
D. (1); (2); (5); (7); (8).
Lời giải
Đáp án đúng là: B
Các chất có liên kết cộng hóa trị là:
(1) H2S; (2) SO2;
(5) NH3; (6) HBr; (7) CO2;
Các chất còn lại có liên kết ion.
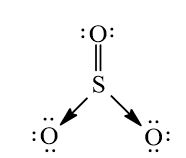
Bài 14.11 trang 37 SBT Hóa học 10: Dùng công thức Lewis để biểu diễn phân tử SO3 sao cho phù hợp với quy tắc octet. Chỉ rõ các liên kết trong phân tử thuộc loại liên kết nào.
Lời giải
Nguyên tử trung tâm S có 6 electron lớp ngoài cùng và nguyên tử O cũng có 6 electron lớp ngoài cùng. Khi tạo thành phân tử SO3, nguyên tử S và 1 nguyên tử O dùng chung 2 cặp electron để tạo 2 liên kết cộng hóa trị kép phân cực. Để thỏa mãn quy tắc octet, liên kết cộng hóa trị giữa nguyên tử S và 2 nguyên tử O còn lại được thực hiện bằng sự cho – nhận 2 cặp electron của nguyên tử S. Kết quả, trong phân tử SO3, các nguyên tử S và O đều có 8 electron lớp ngoài cùng thỏa mãn quy tắc octet.
Công thức Lewis:
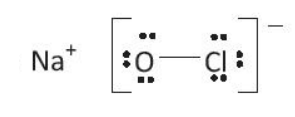
Bài 14.12 trang 37 SBT Hóa học 10: Hợp chất NaClO là thành phần của chất tẩy rửa, sát trùng có tên gọi là ‘Nước Javen”. Áp dụng quy tắc octet để giải thích sự hình thành các liên kết trong hợp chất đó.
Lời giải
Sự hình thành các liên kết trong phân tử NaClO:
Nguyên tử Na có 1 electron lớp ngoài cùng, nguyên tử O có 6 electron lớp ngoài cùng và nguyên tử Cl có 7 electron lớp ngoài cùng.
Nguyên tử Na nhường đi 1 electron để trở thành ion Na+, có cấu hình electron bền vững của khí hiếm Ne. Nhóm nguyên tử OCl nhận thêm 1 electron để trở thành ion OCl–. Các ion này mang điện trái dấu sẽ hút nhau tạo thành liên kết ion.
Ion OCl– có 14 electron hóa trị:
6 (đối với O) + 7 (đối với Cl) + 1 (đối với điện tích âm) = 14 hay 7 cặp electron hóa trị. Sau khi tạo thành liên kết O-Cl và phân bố 6 electron còn lại chưa liên kết vào các nguyên tử, cả hai nguyên tử đều có 8 electron lớp ngoài cùng.
Công thức Lewis:
Vận dụng
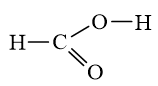
Bài 14.13 trang 38 SBT Hóa học 10: Tính số liên kết σ và liên kết π trong các phân tử sau:
a) C2H4;
b) C2H2;
c) HCN;
d) HCOOH.
Lời giải
a) C2H4 có 5 liên kết σ và 1 liên kết π.
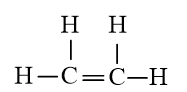
b) C2H2 có 3 liên kết σ và 2 liên kết π.
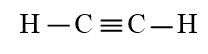
c) HCN có 2 liên kết σ và 2 liên kết π.
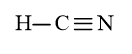
d) HCOOH có 4 liên kết σ và 1 liên kết π.
Bài 14.14 trang 38 SBT Hóa học 10: Dựa vào giá trị của độ âm điện ở Bảng 6.2 trong sách giáo khoa Hóa học 10, hãy nêu bản chất liên kết trong các phân tử và ion sau: HClO, KHS, HCO3–, K2SO4.
Lời giải
Bản chất các liên kết phụ thuộc vào hiệu độ âm điện giữa hai nguyên tử của hai nguyên tố tạo liên kết. Viết công thức cấu tạo các phân tử và tính hiệu độ âm điện để suy ra bản chất liên kết.
H-Cl=O có hiệu độ âm điện H-Cl là 0,96 ⇒ Liên kết cộng hóa trị phân cực;
Cl-O là 0,28 ⇒ Liên kết cộng hóa trị không phân cực.
K+ và [S-H]– có hiệu độ âm điện K và S là 1,76 ⇒ liên kết ion;
S-H là 0,38 ⇒ liên kết cộng hóa trị phân cực.
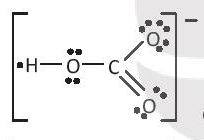 có hiệu độ âm điện H và O là 1,24 ⇒ liên kết cộng hóa trị phân cực;
có hiệu độ âm điện H và O là 1,24 ⇒ liên kết cộng hóa trị phân cực;
C-O có hiệu độ âm điện là 0,89 ⇒ liên kết cộng hóa trị phân cực.
* K+ và 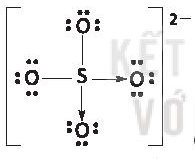 có hiệu độ âm điện K-O là 2,62 ⇒ liên kết ion;
có hiệu độ âm điện K-O là 2,62 ⇒ liên kết ion;
S-O là 1,54 ⇒ liên kết cộng hóa trị phân cực.
Bài 14.15 trang 38 SBT Hóa học 10: Cho dãy các chất kèm theo nhiệt độ sôi (oC) sau:
HF (19,5); HCl (-85); HBr (-66); HI (-35).
a) Nêu xu hướng biến đổi nhiệt độ sôi trong dãy chất trên.
b) Đề xuất lí do nhiệt độ sôi của HF không theo xu hướng này.
Lời giải
a) Nhiệt độ sôi của HF cao hơn hẳn so với HCl, HBr, HI.
Sự tăng nhiệt độ sôi từ HCl đến HI do khối lượng phân tử tăng.
b) HF có liên kết hydrogen làm cho các phân tử liên kết với nhau chặt chẽ hơn nên nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI.
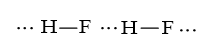
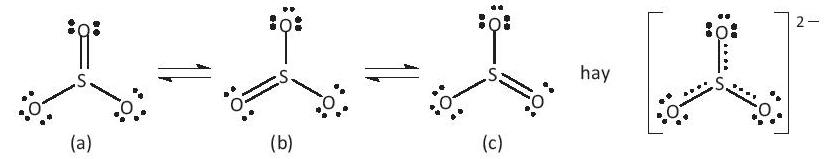
Bài 14.16 trang 38 SBT Hóa học 10: Cho biết tổng số electron trong anion là 42. Trong các hạt nhân A cũng như B có số proton bằng số neutron.
a) Tính số khối của A, B
b) Đề xuất cấu tạo Lewis cho anion AB32- sao cho phù hợp với quy tắc octet.
Lời giải
a) Coi x và y là số proton (số electron) ở nguyên tử A và B tương ứng.
Ta có: x + 3y = 42 – 2 = 40 ⇒ y < = 13,33.
B thuộc chu kì 2 và là một phi kim (tạo anion) nên B chỉ có thể là F, O hoặc N.
– Nếu B là F thì y = 9, trong có A với số oxi hóa bằng +1
⇒ x = 40 – (3.9) = 13 ~ Al (không hợp lí vì Al không có số oxi hóa bằng +1)
– Khi B là O thì = = 8, trong có A với số oxi hóa bằng +4
⇒ x = 40 – (3.8) = 16 ~ S (lưu huỳnh) ⇒ Anion là
– Khi B là N thì y = 7, trong có A với số oxi hóa bằng +7
⇒ x = 40 – (3.7) = 19 ~ K (không hợp lí vì K không có số oxi hóa bằng +7).
b) Cấu tạo Lewis:
Bài 14.17 trang 38 SBT Hóa học 10: Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp nhãn ra hoa, … X có khối lượng mol bằng 122,5 g/mol, chứa ba nguyên tố, trong đó nguyên tố s có 7 electron s, nguyên tố p có 11 electron p và nguyên tố p có 4 electron p. Thành phần phần trăm khối lượng nguyên tố có 4 electron p trong X bằng 39,19%.
a) Xác định công thức phân tử của X.
b) Viết công thức cấu tạo Lewis, chỉ rõ loại liên kết có trong X.
Lời giải
a) Nguyên tố s có 7 electron s là K (1s22s22p63s23p64s1);
Nguyên tố p có 11 electron p là Cl (1s22s22p63s23p5);
Nguyên tố p có 4 electron p là O (1s22s22p4);
Khối lượng O trong X là: 122,5.0,3919 ≈ 48 (amu) ứng với 3 nguyên tử O.
Công thức X có dạng KxClyO3.
Theo bài ra ta có: 39x + 35,5y = 122,5 – 48 = 74,5
⇒ x = y = 1 ⇒ Công thức X: KClO3.
b) Cấu tạo X:
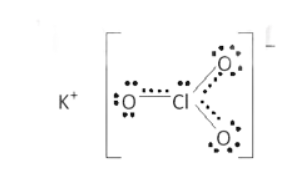
Gồm liên kết K+ và ClO3– là liên kết ion; liên kết đơn Cl-O và liên kết kép Cl=O là các liên kết công hóa trị phân cực
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 13: Liên kết hydrogen và tương tác van der Waals
Bài 14: Ôn tập chương 3
Bài 15: Phản ứng oxi hóa – khử
Bài 16: Ôn tập chương 4
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học