Trắc nghiệm Hóa học 10 Bài 13: Liên kết hydrogen và tương tác van der waals
Phần 1: Trắc nghiệm Liên kết hydrogen và tương tác van der waals
Câu 1. Liên kết hydrogen
A. làm tăng nhiệt độ nóng chảy và làm giảm nhiệt độ sôi của nước.
B. làm giảm nhiệt độ nóng chảy và làm tăng nhiệt độ sôi của nước.
C. làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
D. làm giảm nhiệt độ nóng chảy, nhiệt độ sôi của nước.
Đáp án: C
Giải thích:
Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
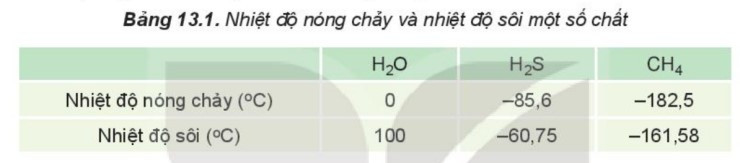
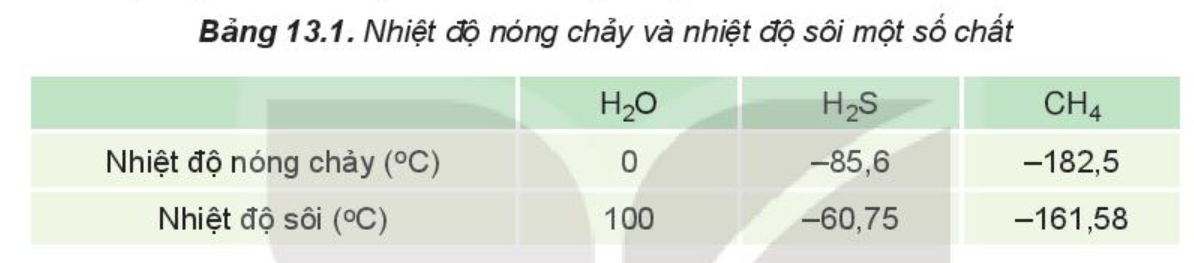
Ví dụ: Do ảnh hưởng của liên kết hydrogen nên nhiệt độ nóng chảy và nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4.
Câu 2. Tương tác van der Waals là
A. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
B. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
C. nhiệt lượng cần cung cấp cho một phản ứng hóa học.
D. nhiệt lượng tỏa ra trong một phản ứng hóa học.
Đáp án: A
Giải thích:
Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Câu 3. Cùng là phân tử phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí còn bromine là chất lỏng. Đó là do
A. phân tử bromine có khối lượng lớn hơn.
B. ở trạng thái lỏng, giữa các phân tử bromine tồn tại một tương tác yếu, đó là tương tác van der Waals.
C. ở trạng thái lỏng, giữa các phân tử bromine tồn tại một tương tác yếu, đó là liên kết hydrogen.
D. phân tử bromine có kích thước lớn hơn.
Đáp án: B
Giải thích:
Cùng là phân tử phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí còn bromine là chất lỏng. Như vậy, ở trạng thái lỏng, giữa các phân tử bromine tồn tại một tương tác yếu. Tương tác yếu đó gọi là tương tác van der Waals.
Câu 4. Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Đó là do
A. nguyên tử khí hiếm có cấu hình electron bền vững.
B. nguyên tử khí hiếm khó tham gia vào các phản ứng hóa học.
C. ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng.
D. ở nhiệt độ thấp, giữa các nguyên tử khí hiếm có thể liên kết với nhau bằng liên kết hydrogen.
Đáp án: C
Giải thích:
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
Câu 5. Tương tác van der Waals làm
A. tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
B. giảm nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
C. thay đổi liên kết hóa học trong một số chất.
D. tăng kích thước của các chất.
Đáp án: A
Giải thích:
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
Câu 6. So với lực kiên kết ion, liên kết cộng hóa trị hay liên kết kim loại thì tương tác giữa các phân tử
A. mạnh hơn rất nhiều.
B. yếu hơn rất nhiều.
C. không khác nhiều.
D. giống hoàn toàn.
Đáp án: B
Giải thích:
Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết cộng hóa trị hay liên kết kim loại. Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác van der Waals (Van đơ Van).
Câu 7. Phát biểu nào sau đây không đúng?
A. Keo dán là một ví dụ về việc sử dụng lực tương tác giữa các phân tử để gắn các vật với nhau.
B. Bong bóng xà phòng thể hiện tương tác giữa các phân tử nước và các phân tử xà phòng tạo thành màng mỏng, giữ được không khí bên trong để bay lên.
C. Các tính chất vật lí của các chất có liên kết cộng hóa trị chỉ phụ thuộc vào mức độ phân cực của liên kết cộng hóa trị trong phân tử.
D. Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác van der Waals (Van đơ Van).
Đáp án: C
Giải thích:
Các tính chất vật lí của các chất có liên kết cộng hóa trị được quyết định bởi lực tương tác giữa các phân tử, hình dạng của phân tử và mức độ phân cực của liên kết cộng hóa trị trong phân tử.
Câu 8. Liên kết hydrogen được hình thành giữa
A. nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn).
B. nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện nhỏ) còn cặp electron hóa trị chưa tham gia liên kết.
C. nguyên tử H (đã liên kết với một nguyên tử có độ âm điện nhỏ) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
D. nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
Đáp án: D
Giải thích:
Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
Câu 9. Liên kết hydrogen thường biểu diễn bằng
A. dấu gạch đơn (–)
B. dấu gạch đôi (=).
C. mũi tên một chiều (®).
D. dấu ba chấm (…).
Đáp án: D
Giải thích:
Liên kết hydrogen thường biểu diễn bằng dấu ba chấm (…).
Ví dụ:

Câu 10. Chọn phát biểu đúng. Điều kiện để tạo thành liên kết hydrogen là
A. Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn (như F, O, N, …) và các nguyên tử này phải có ít nhất một cặp electron hóa trị chưa liên kết.
B. Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn (như F, O, N, …).
C. Nguyên tử hydrogen liên kết với các nguyên tử còn ít nhất một cặp electron hóa trị chưa liên kết.
D. Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện nhỏ và các nguyên tử này phải có ít nhất một cặp electron hóa trị chưa liên kết.
Đáp án: A
Giải thích:
Điều kiện cần và đủ để tạo thành liên kết hydrogen:
+ Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn (như F, O, N, …).
+ Nguyên tử F, O, N, … liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
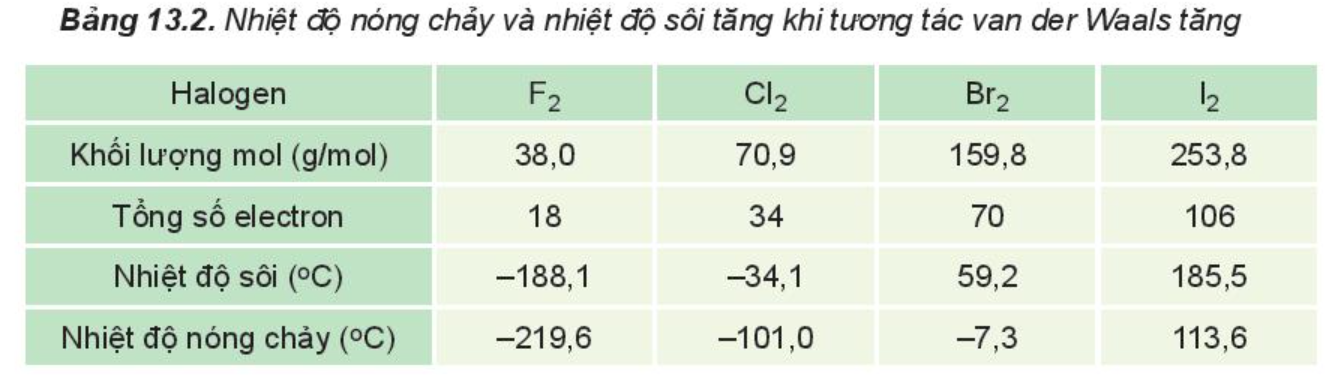
Câu 11. Trong dãy halogen, đi từ F2 đến I2:
A. nhiệt độ nóng chảy và nhiệt độ sôi giảm dần.
B. nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
C. nhiệt độ nóng chảy tăng dần; nhiệt độ sôi giảm dần.
D. nhiệt độ nóng chảy giảm dần; nhiệt độ sôi tăng dần.
Đáp án: A
Giải thích:
Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
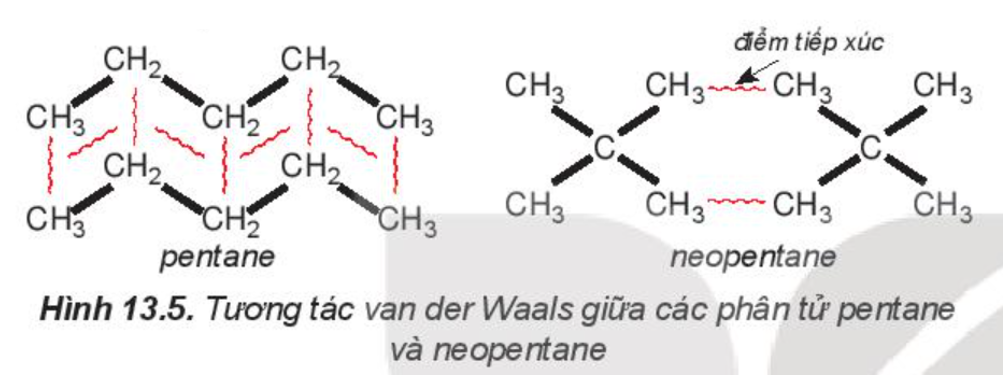
Câu 12. Pentane là hydrocarbon no có công thức C5H12. Phát biểu nào sau đây là đúng?
A. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi thấp hơn so với đồng phân mạch nhánh neopentane.
B. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi cao hơn so với đồng phân mạch nhánh neopentane.
C. Đồng phân mạch không phân nhánh pentane và đồng phân mạch nhánh neopentane có nhiệt độ sôi giống nhau.
D. Tất cả các đồng phân của C5H12 đều có nhiệt độ sôi giống nhau.
Đáp án: B
Giải thích:
Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
Câu 13. Khi khối lượng phân tử tăng thì
A. tương tác van der Waals không thay đổi.
B. tương tác van der Waals tăng sau đó giảm.
C. tương tác van der Waals tăng.
D. tương tác van der Waals giảm.
Đáp án: C
Giải thích:
Khi khối lượng phân tử tăng thì tương tác van der Waals tăng.
Ví dụ: Tổng tương tác van der Waals giữa các phân tử polyethene lớn hơn rất nhiều so với giữa các phân tử ethene. Đó là lý do tại sao polyethene là một chất rắn ở điều kiện thường.
Câu 14. Nước dễ dàng dâng lên trong mao quản của rễ cây để vận chuyển lên thân và lá cây, đó là do có
A. liên kết ion.
B. liên kết cộng hóa trị.
C. tương tác van der Waals.
D. liên kết hydrogen.
Đáp án: D
Giải thích:
Do có liên kết hydrogen nước dễ dàng dâng lên trong mao quản của rễ cây để vận chuyển lên thân và lá cây.
Câu 15. Phát biểu nào sau đây không đúng?
A. Liên kết hydrogen ảnh hưởng đến tính chất của nước đá.
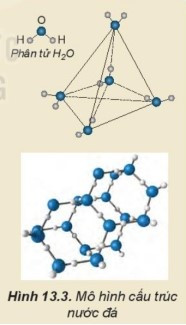
B. Một phân tử nước có thể tạo ra 4 liên kết hydrogen với các phân tử nước khác xung quanh tạo thành cấu trúc tứ diện.
C. Nước đá nặng hơn nước lỏng.
D. Các phân tử nước đóng vai trò điều hòa nhiệt độ trên Trái Đất.
Đáp án: C
Giải thích:
Một phân tử nước có thể tạo ra 4 liên kết hydrogen với các phân tử nước khác xung quanh tạo thành cấu trúc tứ diện. Mạng tinh thể nước đá có vô số cấu trúc như vậy. Cấu trúc này khá “rỗng” nên nước đá nhẹ hơn nước lỏng và có thể nổi một phần trên bề mặt nước lỏng.
Phần 2: Lý thuyết Liên kết hydrogen và tương tác van der waals
I. Mở đầu
Các tính chất vật lí của các chất có liên kết cộng hóa trị được quyết định bởi lực tương tác giữa các phân tử, hình dạng của phân tử và mức độ phân cực của liên kết cộng hóa trị trong phân tử.
Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết cộng hóa trị hay liên kết kim loại. Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác van der Waals (Van đơ Van).
II. Liên kết hydrogen
1. Bản chất của liên kết hydrogen
Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
Ví dụ:
 Một số kiểu tạo thành liên kết hydrogen:
Một số kiểu tạo thành liên kết hydrogen:
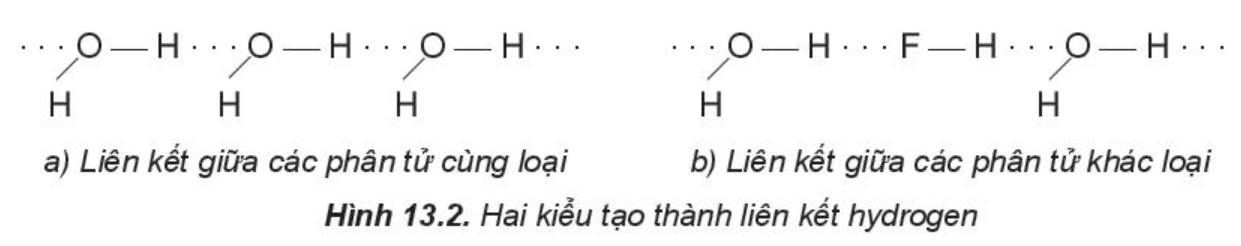
Chú ý:
– Điều kiện cần và đủ để tạo thành liên kết hydrogen:
+ Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N …
+ Nguyên tử F, O, N, … liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
2. Vai trò và ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
Ví dụ: Do ảnh hưởng của liên kết hydrogen nên nhiệt độ nóng chảy và nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4.
III. Tương tác van der Waals
1. Khái niệm tương tác van der Waals
Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Ví dụ:
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
2. Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
Ví dụ 1: Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
Ví dụ 2: Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
Xem thêm các bài trắc nghiệm Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Trắc nghiệm Bài 12: Liên kết cộng hóa trị
Trắc nghiệm Bài 13: Liên kết hydrogen và tương tác van der Waals
Trắc nghiệm Bài 14: Ôn tập chương 3
Trắc nghiệm Bài 15: Phản ứng oxi hóa – khử
Trắc nghiệm Bài 16: Ôn tập chương 4