Giải SBT Hoá học lớp 10 Bài 12: Liên kết cộng hóa trị
Nhận biết
Bài 12.1 trang 32 SBT Hóa học 10: Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
A. một electron chung
B. sự cho – nhận electron
C. một cặp electron góp chung.
D. một hay nhiều cặp electron dùng chung
Lời giải:
Đáp án đúng là: C
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung
Ví dụ: Liên kết cộng hóa trị trong phân tử HCl

Bài 12.2 trang 32 SBT Hóa học 10: Hợp chất nào sau đây có liên kết cộng hóa trị không phân cực?
A. LiCl
B. CF2Cl2
C. CHCl3
D. N2
Lời giải:
Đáp án đúng là: D
Hiệu độ âm điện trong phân tử N2 bằng 0.
Bài 12.3 trang 32 SBT Hóa học 10: Hợp chất nào sau đây có liên kết cộng hóa trị phân cực?
A. H2
B. CHCl3
C. CH4
D. N2
Lời giải:
Đáp án đúng là: B
– H2 và N2 có hiệu độ âm điện bằng 0 ⇒ Có liên kết cộng hóa trị không phân cực.
– Hợp chất CHCl3 gồm 1 liên kết C-H và 3 liên kết C-Cl
Hợp chất CH4 gồm 4 liên kết C-H
(C-H) = |2,55 – 2,2| = 0,35 ⇒ Liên kết cộng hóa trị không phân cực
(C-Cl) = |2,55 – 3,16| = 0,61 ⇒ Liên kết cộng hóa trị phân cực.
Vậy hợp chất CHCl3 có liên kết cộng hóa trị không phân cực.
Bài 12.4 trang 32 SBT Hóa học 10: Liên kết σ là liên kết hình thành do
A. sự xen phủ bên của hai orbital
B. cặp electron dùng chung
C. lực hút tĩnh điện giữa hai ion
D. sự xen phủ trục của hai orbital.
Lời giải:
Đáp án đúng là: D
Liên kết σ là liên kết hình thành do sự xen phủ trục của hai orbital.
Ví dụ:
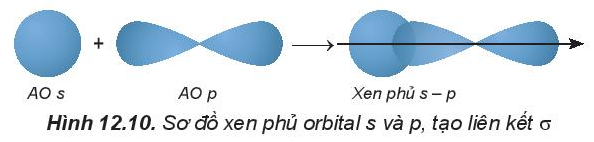
Bài 12.5 trang 32 SBT Hóa học 10: Liên kết π là liên kết hình thành do
A. sự xen phủ bên của hai orbital
B. cặp electron dùng chung
C. lực hút tĩnh điện giữa hai ion
D. sự xen phủ trục của hai orbital
Lời giải:
Đáp án đúng là: A
Liên kết π là liên kết hình thành do sự xen phủ bên của hai orbital
Bài 12.6 trang 32 SBT Hóa học 10: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p – p?
A. H2
B. Cl2
C. NH3
D. HCl
Lời giải:
Đáp án đúng là: B
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
A. Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
B. Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
C. Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
D. Liên kết trong phân tử HCl được hình thành bởi sự xen phủ orbital s – p.
Bài 12.7 trang 32 SBT Hóa học 10: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s – s?
A. H2
B. Cl2
C. NH3
D. HCl
Lời giải:
Đáp án đúng là: A
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
A. Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
B. Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
C. Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
D. Liên kết trong phân tử HCl được hình thành bởi sự xen phủ orbital s – p.
Bài 12.8 trang 32 SBT Hóa học 10: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s – p?
A. H2
B. Cl2
C. NH3
D. O2
Lời giải:
Đáp án đúng là: C
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
O (Z = 8): 1s22s22p4
A. Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
B. Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
C. Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
D. Liên kết trong phân tử O2 được hình thành bởi sự xen phủ orbital p – p.
Thông hiểu
Bài 12.9 trang 32 SBT Hóa học 10: Các liên kết trong phân tử oxygen gồm
A. 2 liên kết π
B. 2 liên kết σ
C. 1 liên kết σ, 1 liên kết π
D. 1 liên kết σ
Lời giải:
Đáp án đúng là: C
Trong phân tử oxygen (O2) hai nguyên tử O liên kết với nhau bằng 1 liên kết đôi (O=O).
1 liên kết đôi gồm 1 liên kết σ, 1 liên kết π
Bài 12.10 trang 32 SBT Hóa học 10: Số liên kết σ và π có trong phân tử C2H2 lần lượt là
A. 2 và 3
B. 3 và 1
C. 2 và 2
D. 3 và 2
Lời giải:
Đáp án đúng là: D
Công thức cấu tạo của C2H2 là: H-C≡C-H
Liên kết 3 gồm 1 liên kết σ và 2 liên kết π.
⇒ Tổng số liên kết σ và π có trong phân tử C2H2 lần lượt là: 3 và 2
Bài 12.11 trang 33 SBT Hóa học 10: Dãy nào sau đây gồm các chất chỉ có liên kết cộng hóa trị?
A. BaCl2, NaCl, NO2
B. SO2, CO2, Na2O2
C. SO3, H2S, H2O
D. CaCl2, F2O, HCl
Lời giải:
Đáp án đúng là: C
A. BaCl2 và NaCl chứa liên kết ion.
B. Na2O2 chứa liên kết ion
D. CaCl2 chứa liên kết ion.
Bài 12.12 trang 33 SBT Hóa học 10: Cho hai nguyên tố X (Z = 20) và Y (Z = 17). Công thức hợp chất tạo thành từ nguyên tố X, Y và liên kết trong phân tử là
A. XY: liên kết cộng hóa trị
B. X2Y3: liên kết cộng hóa trị
C. X2Y: liên lết ion
D. XY2: liên kết ion
Lời giải:
Đáp án đúng là: D
X (Z = 20): 1s22s22p63s23p64s2
Y (Z = 17): 1s22s22p63s23p5
Nguyên tử X là kim loại mạnh, có xu hướng nhường đi 2 electron lớp ngoài cùng tạo thành cation X2+.
Nguyên tử Y là phi kim điển hình, có xu hướng nhận thêm 1 electron và lớp ngoài cùng tạo thành anion Y–.
Ion X2+ và Y– trái dấu hút nhau tạo thành phân tử XY2. Liên kết được tạo thành là liên kết ion.
X2+ + 2Y– → XY2
Bài 12.13 trang 33 SBT Hóa học 10: Độ âm điện của nitrogen gần bằng độ âm điện của chlorine nhưng ở điều kiện thường N2 hoạt động kém hơn Cl2. Giải thích.
Lời giải:
Tuy có độ âm điện của chlorine và nitrogen gần bằng nhau nhưng do trong phân tử Cl2 có liên kết đơn σ (Cl-Cl) còn trong phân tử N2 có liên kết ba (N≡N) gồm 1 liên kết σ và 2 liên kết π rất bền vững. Năng lượng cần để phá vỡ liên kết ba trong phân tử N2 lớn hơn nhiều so với năng lượng cần để phá vỡ một liên kết đơn trong phân tử Cl2. Do đó, ở điều kiện thường, N2 hoạt động kém Cl2.
Vận dụng
Bài 12.14 trang 33 SBT Hóa học 10: Cho các phân tử sau: F2, N2, H2O, CO2.
a) Hãy viết công thức Lewis của các phân tử đó.
b) Hãy cho biết phân tử nào chứa liên kết cộng hóa trị phân cực và phân tử nào chứa liên kết cộng hóa trị không phân cực; phân tử nào phân cực và phân tử nào không phân cực?
Lời giải:
a) Công thức Lewis của các phân tử:
F2
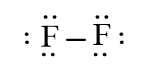
N2
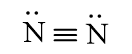
H2O
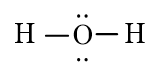
CO2
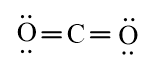
b) Phân tử chứa liên kết cộng hóa trị không phân cực: N2, F2.
Phân tử chứa liên kết cộng hóa trị phân cực: H2O, CO2.
Phân tử phân cực: H2O.
Phân tử không phân cực: N2, F2, CO2.
Bài 12.15 trang 33 SBT Hóa học 10: Cho các phân tử sau: Br2, H2S, CH4, NH3, C2H4, C2H2
a) Phân tử nào có liên kết cộng hóa trị không phân cực? Phân tử nào có liên kết cộng hóa trị phân cực?
b) Phân tử nào chỉ có liên kết đơn? Phân tử nào có liên kết đôi? Phân tử nào có liên kết ba?
Lời giải:
a) Phân tử có liên kết cộng hóa trị không phân cực: Br2.
Phân tử có liên kết cộng hóa trị phân cực: H2S, CH4, NH3, C2H4 và C2H2.
b) Phân tử chỉ có liên kết đơn: H2S, CH4, NH3 và Br2.
Phân tử có liên kết đôi: CH2=CH2.
Phân tử có liên kết ba: CH≡CH.
Bài 12.16 trang 33 SBT Hóa học 10: Ghép nhiệt độ nóng chảy với chất tương ứng và giải thích
|
Chất |
Nhiệt độ nóng chảy (oC) |
|
a) Nước |
1) -138 |
|
b) Muối ăn |
2) 80 |
|
c) Băng phiến |
3) 0 |
|
d) Butane |
4) 801 |
Lời giải:
a) – 3);
b) – 4);
c) – 2);
d) – 1).
Nước, băng phiến, butane là các hợp chất cộng hóa trị, phân tử có độ phân cực không cao nên dễ tách ra khỏi nhau khi đun nóng. Ngược lại, NaCl là tinh thể ion có lực hút mạnh giữa các ion nên khó tách ra khỏi nhau và có nhiệt độ nóng chảy cao.
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 11: Liên kết ion
Bài 12: Liên kết cộng hóa trị
Bài 13: Liên kết hydrogen và tương tác van der Waals
Bài 14: Ôn tập chương 3
Bài 15: Phản ứng oxi hóa – khử