Trắc nghiệm KHTN 7 Bài 1: Nguyên tử
A. Bài tập trắc nghiệm KHTN 7 Bài 1: Nguyên tử
Câu 1. Nguyên tử oxygen có 8 proton. Điện tích hạt nhân của nguyên tử oxygen là
A. 8;
B. +8;
C. −8;
D. 0.
Đáp án: B
Giải thích:
Mỗi hạt proton có điện tích là +1.
Nguyên tử oxygen có 8 proton nên điện tích hạt nhân nguyên tử oxygen là: +1.8 = +8.
Câu 2. Nguyên tử aluminium có 13 proton. Số hạt electron chuyển động quanh hạt nhân nguyên tử này là
A. 13;
B. 26;
C. 27;
D. Không xác định.
Đáp án: A
Giải thích:
Nguyên tử không mang điện (trung hòa về điện) nên tổng số đơn vị điện tích âm bằng tổng số đơn vị điện tích dương.
Do đó, số electron = số proton = 13.
Câu 3. Nguyên tử sodium có 23 hạt trong hạt nhân và có điện tích ở lớp vỏ nguyên tử là −11. Số hạt electron, proton, neutron trong nguyên tử sodium lần lượt là
A. 11; 23; 0;
B. 11; 22; 1;
C. 11; 12; 11;
D. 11; 11; 12.
Đáp án: D
Giải thích:
Điện tích ở lớp vỏ nguyên tử là −11 nên nguyên tử sodium có 11 electron.
Mà trong nguyên tử, số proton = số electron = 11
Hạt nhân gồm proton và neutron nên:
Số neutron = tổng số hạt trong hạt nhân – số proton = 23 – 11 = 12 (hạt)
Vậy số hạt electron, proton, neutron trong nguyên tử sodium lần lượt là 11; 11; 12.
Câu 4. Nguyên tử phosphorus có 15 electron. Số lớp electron và số electron lớp ngoài cùng của nguyên tử này lần lượt là
A. 3 lớp, 3 electron lớp ngoài cùng;
B. 3 lớp, 5 electron lớp ngoài cùng;
C. 2 lớp, 8 electron lớp ngoài cùng;
D. 2 lớp, 5 electron lớp ngoài cùng.
Đáp án: B
Giải thích:
Tron nguyên tử các electron được xếp thành từng lớp. Các electron được sắp xếp lần lượt vào từng lớp theo chiều từ gần hạt nhân ra ngoài.
Do đó, nguyên tử phosphorus có 15 electron sẽ sắp xếp lần lượt như sau:
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
+ Còn lại 15 – 2 – 8 = 5 electron ở lớp thứ 3.
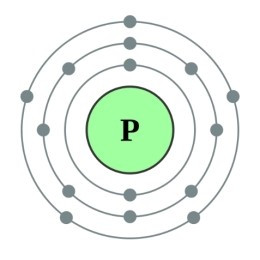
Vậy nguyên tử có 3 lớp electron và 5 electron lớp ngoài cùng.
Câu 5. Một nguyên tử có 17 electron, 17 proton và 18 neutron. Khối lượng nguyên tử này tính theo đơn vị khối lượng nguyên tử là
A. 17 amu;
B. 34 amu;
C. 35 amu;
D. 52 amu.
Đáp án: C
Giải thích:
Chú ý: Khối lượng của electron là 0,00055 nhỏ hơn rất nhiều so với khối lượng của proton và neutron. Do đó có thể coi khối lượng nguyên tử bằng khối lượng hạt nhân.
Proton và neutron đều có khối lượng xấp xỉ bằng 1 amu.
Vậy khối lượng nguyên tử đó là: 17.1 + 18.1 = 35 (amu).
Câu 6. Theo các nhà khoa học hiện nay, nguyên tử là
A. hạt cực kì nhỏ bé, không mang điện;
B. hạt có thể quan sát trực tiếp bằng mắt thường, không mang điện;
C. hạt không thể chia nhỏ hơn được nữa, mang điện tích dương;
D. hạt cực kì nhỏ bé, mang điện tích âm.
Đáp án: A
Giải thích:
Theo các nhà khoa học hiện nay, nguyên tử là hạt cực kì nhỏ bé, không mang điện.
Không thể quan sát nguyên tử bằng mắt hoặc các kính hiển vi thông thường.
Câu 7. Nguyên tử có cấu tạo gồm
A. vỏ nguyên tử và các hạt neutron;
B. proton và neutron;
C. vỏ nguyên tử và hạt nhân nguyên tử;
D. electron và neutron.
Đáp án: C
Giải thích:
Nguyên tử có cấu tạo gồm:
+ Vỏ nguyên tử: được cấu tạo bởi một hay nhiều hạt electron.
+ Hạt nhân nguyên tử: được tạo bởi proton và neutron.
Câu 8. Hạt mang điện tích dương trong hạt nhân là
A. hạt electron;
B. hạt proton;
C. hạt neutron;
D. hạt nhân.
Đáp án: B
Giải thích:
Hạt mang điện tích dương trong hạt nhân là hạt proton.
Mỗi proton có điện tích quy ước là +1.
Câu 9. Hạt được tìm thấy cùng với proton trong hạt nhân là
A. hạt electron;
B. hạt proton;
C. hạt neutron;
D. hạt bụi.
Đáp án: C
Giải thích:
Hạt được tìm thấy cùng với proton trong hạt nhân là hạt neutron.
Câu 10. Khẳng định nào sai khi nói về hạt electron
A. Hạt có khối lượng rất nhỏ có thể bỏ qua khi tính khối lượng nguyên tử;
B. Hạt mang điện tích dương;
C. Hạt có trong lớp vỏ xung quanh hạt nhân;
D. Hạt không chuyển động xung quanh hạt nhân.
Đáp án: B
Giải thích:
Hạt mang điện tích dương là khẳng định sai.
Vì electron mang điện tích âm. Điện tích của một hạt proton có giá trị bằng một điện tích nguyên tố, được viết là −1.
Video giải KHTN 7 Bài 1: Nguyên tử – Cánh diều
B. Lý thuyết KHTN 7 Bài 1: Nguyên tử
I. Nguyên tử là gì?
Nguyên tử là những hạt cực kì nhỏ bé, không mang điện, cấu tạo nên chất.
Ví dụ:
– Kim cương, than chì đều được cấu tạo từ các nguyên tử carbon.

– Nước được tạo nên từ các nguyên tử hydrogen và oxygen.

II. Cấu tạo nguyên tử
Nguyên tử được coi như một quả cầu, gồm hạt nhân nguyên tử và vỏ nguyên tử.
1. Vỏ nguyên tử
– Vỏ nguyên tử được tạo bởi một hay nhiểu electron chuyển động xung quanh hạt nhân.
– Electron: kí hiệu: e; mỗi hạt electron mang điện tích -1.
2. Hạt nhân nguyên tử
– Vị trí: nằm ở tâm của nguyên tử.
– Kích thước: rất nhỏ so với nguyên tử.
– Thành phần: gồm proton và neutron.
+ Proton: kí hiệu: p; mỗi proton mang điện tích +1.
+ Neutron: kí hiệu: n; không mang điện.
– Điện tích hạt nhân nguyên tử = tổng điện tích các proton.
– Số đơn vị điện tích hạt nhân = số proton.
Ví dụ: Nguyên tử helium gồm hạt nhân có 2 proton, 2 neutron và vỏ nguyên tử có 2 electron.
Điện tích hạt nhân = tổng điện tích các proton = 2.(+1) = +2
Số đơn vị điện tích hạt nhân = số proton = 2
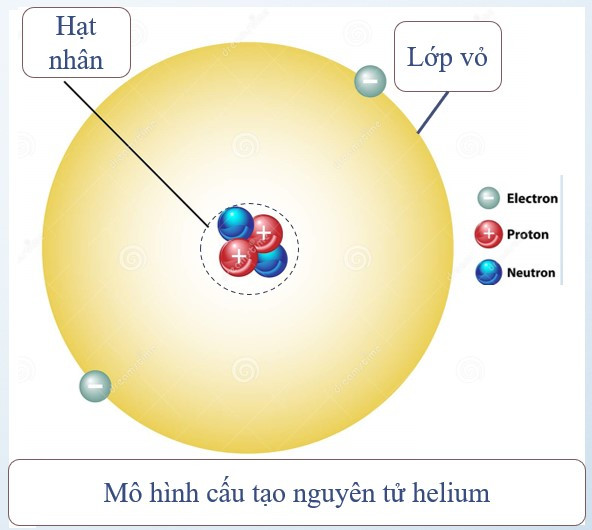
Chú ý:
Số proton = số electron ⇒ Nguyên tử trung hòa về điện
III. Sự chuyển động của electron trong nguyên tử
– Mô hình nguyên tử của Rơ-dơ-pho – Bo:
+ Electron chuyển động trên những quỹ đạo xác định xung quanh hạt nhân.
+ Electron phân bố trên các lớp electron theo chiều từ gần hạt nhân ra ngoài.
+ Số electron tối đa trên mỗi lớp được xác định, như lớp thứ nhất có tối đa 2 electron, lớp thứ hai có tối đa 8 electron,…
Ví dụ 1: Nguyên tử carbon có 6 electron, được phân bố thành hai lớp:
+ Lớp thứ nhất (lớp gần hạt nhân nhất) có 2 electron.
+ Lớp thứ hai có 4 electron.
Ta nói carbon có 4 electron ở lớp ngoài cùng.
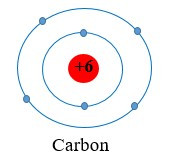
Mở rộng: Trong số các nguyên tử đã biết hiện nay, nguyên tử có kích thước lớn nhất là francium, có chứa 7 lớp electron. Nguyên tử helium có kích thước nhỏ nhất với 1 lớp electron.
IV. Khối lượng của nguyên tử
– Nguyên tử có khối lượng rất nhỏ. Một gam của bất kì chất nào cũng chứa tới hàng tỉ tỉ nguyên tử.
– Đơn vị đo khối lượng nguyên tử: amu (atomic mass unit)
1 amu = 1,6605. 10-24 g.
– Khối lượng của một nguyên tử = khối lượng của proton + khối lượng của neutron + khối lượng của electron.
Tuy nhiên, do khối lượng của electron (0,00055 amu) rất nhỏ so với khối lượng của proton (1 amu) hay neutron (1 amu).
Nên có thể coi khối lượng của một nguyên tử bằng khối lượng hạt nhân (hay bằng tổng khối lượng của proton và neutron).
Ví dụ:
– Nguyên tử sulfur có 16 proton và 16 neutron, nên khối lượng của một nguyên tử sulfur là: 16.1 + 16.1 = 32 (amu)
Xem thêm các bài trắc nghiệm Khoa học tự nhiên 7 Cánh diều hay, chi tiết khác:
Trắc nghiệm KHTN 7 Bài mở đầu: Phương pháp và kĩ năng trong học tập môn Khoa học tự nhiên
Trắc nghiệm KHTN 7 Bài 1: Nguyên tử
Trắc nghiệm KHTN 7 Bài 2: Nguyên tố hoá học
Trắc nghiệm KHTN 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm KHTN 7 Bài 4: Phân tử, đơn chất, hợp chất
Trắc nghiệm KHTN 7 Bài 5: Giới thiệu về liên kết hóa học