Trắc nghiệm KHTN 7 Bài 6: Hóa trị, công thức hóa học
A. Bài tập trắc nghiệm KHTN 7 Bài 6: Hóa trị, công thức hóa học
Câu 1. Cho nguyên tố X hóa trị II và nguyên tố Y hóa trị III. Trong một phân tử hợp chất tạo thành từ X và Y, Tỉ lệ số nguyên tử của X so với Y là
A. ;
B. ;
C. ;
D. 6.
Đáp án: C
Giải thích:
Giả sử trong một phân tử hợp chất tạo thành từ X và Y có a nguyên tử X và b nguyên tử Y.
Theo quy tắc hóa trị, ta có:
![]()
Nên
Do đó, tỉ lệ số nguyên tử của X so với Y là:
Câu 2. Cho công thức hóa học của calcium nitrate là: Ca(NO3)2
Số nguyên tử của mỗi nguyên tố trong phân tử là
A. 1 Ca, 1 N và 3 O;
B. 1 Ca, 2 N và 5 O;
C. 1 Ca, 1 N và 6 O;
D. 1 Ca, 2 N và 6 O.
Đáp án: D
Giải thích:
Công thức hóa học của calcium nitrate là: Ca(NO3)2 cho biết trong phân tử có:
1 nguyên tử Ca, 2 nhóm NO3. Mà mỗi nhóm NO3 có 1 nguyên tử N và 3 nguyên tử O.
Do đó, trong phân tử có 1 nguyên tử Ca; 2.1 = 2 nguyên tử N; 2.3 = 6 nguyên tử O.
Câu 3. Phần trăm khối lượng của nguyên tố O trong hợp chất SO3 là
A. 60%;
B. 40%;
C. 50%;
D. 70%.
Đáp án: A
Giải thích:
Khối lượng của nguyên tố O trong SO3 là: mO = 16.3 = 48 (amu)
Khối lượng của phân tử SO3 là: = 32.1 + 16.3 = 80 (amu)
Phần trăm về của nguyên tố O trong hợp chất SO3 là:
%mO = = = 60%
Câu 4. Hóa trị của N trong hợp chất N2O5 là
A. II;
B. III;
C. I;
D. V.
Đáp án: D
Giải thích:
Gọi hóa trị của N trong hợp chất N2O5 là a.
Vì O có hóa trị II nên áp dụng quy tắc hóa trị, ta có:
![]()
Nên a = V
Vậy N hóa trị V trong hợp chất N2O5.
Câu 5. R là hợp chất của Fe và O, khối lượng phân tử của R là 160 amu. Biết phần trăm khối lượng của O trong R là 30%. Công thức hóa học của R là
A. FeO;
B. Fe2O3;
C. Fe3O4;
D. Không xác định.
Đáp án: B
Giải thích:
Đặt công thức hóa học của R là: FexOy
Khối lượng của nguyên tố O trong một phân tử R là: (amu)
Khối lượng của nguyên tố Fe trong một phân tử R là: 160 – 48 = 112 (amu)
Ta có: 56.x = 112 nên x = 2
16.y = 48 nên y = 3
Vậy công thức hóa học của R là Fe2O3.
Câu 6. Hóa trị là
A. con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác;
B. con số biểu thị khả năng liên kết của các nguyên tử trong cùng một nguyên tố;
C. con số biểu thị khả năng liên kết của phân tử này với phân tử khác;
D. Cả A, B và C đều sai.
Đáp án: A
Giải thích:
Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
Câu 7. Trong hợp chất
A. H luôn có hóa trị là I;
B. O luôn có hóa trị là II;
C. C luôn có hóa trị là IV;
D. Cả A và B đều đúng.
Đáp án: D
Giải thích:
Trong hợp chất, H luôn có hóa trị là I; O luôn có hóa trị là II.
Câu 8. Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, ta có quy tắc hóa trị là
A. tích giữa hóa trị của A và số nguyên tử của B bằng tích giữa hóa trị của B và số nguyên tử của A;
B. hóa trị của A bằng hóa trị của B;
C. tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B;
D. tổng giữa hóa trị và số nguyên tử của A bằng tổng giữa hóa trị và số nguyên tử của B.
Đáp án: C
Giải thích:
Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, ta có quy tắc hóa trị là tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B.
Câu 9. Dựa vào hóa trị và quy tắc hóa trị cho biết mỗi nguyên tử Al có thể liên kết được với bao nhiêu nguyên tử Cl
A. 1;
B. 3;
C. 2;
D. 4.
Đáp án: B
Giải thích:
Ta có hóa trị của Al là III, Cl là I
Giả sử 1 nguyên tử Al liên kết được với x nguyên tử Cl.
Theo quy tắc hóa trị, ta có: ![]() nên x = 3.
nên x = 3.
Vậy mỗi nguyên tử Al có thể liên kết được với 3 nguyên tử Cl.
Câu 10. Dựa vào hóa trị và quy tắc hóa trị cho biết mỗi nguyên tử Ca có thể liên kết được với bao nhiêu nhóm nguyên tử OH
A. 1;
B. 3;
C. 2;
D. 4.
Đáp án: C
Giải thích:
Ta có hóa trị của Ca là II, nhóm OH là I
Giả sử 1 nguyên tử Ca liên kết được với x nhóm nguyên tử OH.
Theo quy tắc hóa trị, ta có: ![]() nên x = 2.
nên x = 2.
Vậy mỗi nguyên tử Ca có thể liên kết được với 2 nhóm nguyên tử OH.
Video giải KHNT 7 Bài 6: Hóa trị, công thức hóa học – Cánh diều
B. Lý thuyết KHTN 7 Bài 6: Hóa trị, công thức hóa học
I. Hóa trị
1. Khái niệm về hóa trị
– Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
Ví dụ:
+ Trong phân tử hydrogen chloride, mỗi nguyên tử H và Cl góp chung 1 electron tạo ra đôi electron dùng chung giữa hai nguyên tử nên H và Cl có hóa trị I.
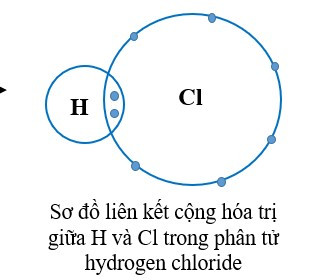
+ Trong phân tử khí carbonic, mỗi nguyên tử O góp chung 2 electron, nguyên tử C góp chung 4 electron. Như vậy nguyên tử C liên kết với 2 nguyên tử O bằng 4 đôi electron chung nên C có hóa trị IV và O có hóa trị II.
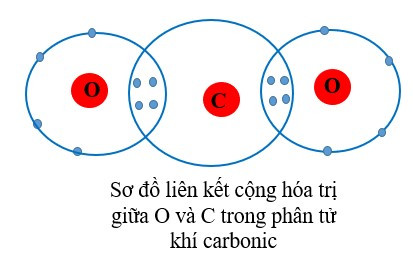
– Thông thường, hóa trị của nguyên tố trong hợp chất cộng hóa trị = số electron mà nguyên tử nguyên tố đó góp chung với nguyên tố khác.
– Trong hợp chất, H luôn có hóa trị I, O luôn có hóa trị II.
– Hóa trị của một số nguyên tố:
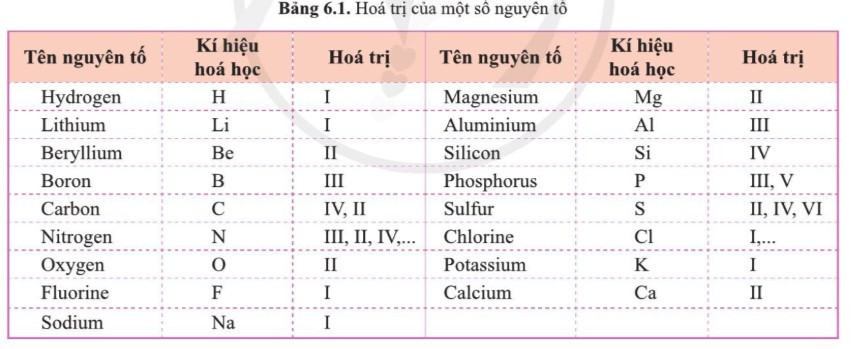
– Hóa trị của một số nhóm nguyên tử

2. Quy tắc hóa trị
– Quy tắc hóa trị: Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B.
Ví dụ:
+ Trong phân tử nước, hóa trị và số nguyên tử tham gia liên kết của H và O như sau:
|
Nguyên tố |
H |
O |
|
Hóa trị |
I |
II |
|
Số nguyên tử |
2 |
1 |
|
Tích hóa trị và số nguyên tử |
I × 2 = II × 1 |
|
+ Trong phân tử sulfur dioxide (SO2), hóa trị và số nguyên tử tham gia liên kết của S và O như sau:
|
Nguyên tố |
S |
O |
|
Hóa trị |
IV |
II |
|
Số nguyên tử |
1 |
2 |
|
Tích hóa trị và số nguyên tử |
IV × 1 = II × 2 |
|
II. Công thức hóa học
1. Công thức hóa học
– Công thức hóa học dùng để biểu diễn chất.
– Công thức hóa học gồm hai phần:
+ Phần chữ: gồm kí hiệu hóa học của nguyên tố tạo thành chất.
+ Phần số: gồm các số được ghi bên phải, dưới chân kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong một phân tử (nếu chỉ có một nguyên tử thì không ghi). Các số này được gọi là chỉ số.

– Công thức hóa học của hợp chất có hai kí hiệu hóa học trở lên.
Ví dụ: NaCl, CaO, HNO3, BaSO4,…
– Công thức hóa học của các đơn chất chỉ có một kí hiẹu hóa học.
+ Với phi kim, phân tử thường có hai nguyên tử.
Ví dụ: N2, H2, O2, Br2,…
+ Với kim loại và một số phi kim, kí hiệu hóa học của nguyên tố được coi là công thức hóa học của đơn chất.
Ví dụ: Kim loại: Fe, Cu, Al, Mg,… và phi kim: C, S, P,…
2. Ý nghĩa của công thức hóa học
Công thức hóa học của một số chất cho biết một số thông tin
+ Nguyên tố tạo ra chất.
+ Số nguyên tử của mỗi nguyên tố có trong một phân tử chất.
+ Khối lượng phân tử của chất.
Ví dụ: Công thức hóa học của nitric acid là HNO3:
+ Nitric acid được tạo thành từ H, N và O.
+ Trong một phân tử nitric acid có 1 nguyên tử H, 1 nguyên tử N và 3 nguyên tử O.
+ Khối lượng phân tử của nitric là:
1 × 1 amu + 1 × 14 amu + 3 × 16 amu = 63 amu
Biết công thức hóa học tính được phần trăm khối lượng các nguyên tố trong hợp chất
– Khi biết công thức hóa học của một chất, tính được thành phần phần trăm khối lượng của các nguyên tố tạo ra chất theo các bước sau:
+ Tính khối lượng mỗi nguyên tố có trong một phân tử hợp chất.
+ Tính khối lượng phân tử.
+ Tính phần trăm khối lượng của nguyên tố theo công thức:
(Khối lượng nguyên tố : Khối lượng phân tử hợp chất) × 100%
Ví dụ: Tính phần trăm khối lượng của Cu, O trong hợp chất CuO.
Hướng dẫn giải:
Ta có: Khối lượng của nguyên tố O trong CuO là:
mO = 1 × 16 amu = 16 amu
Khối lượng của nguyên tố Cu trong CuO là:
mCu = 1 × 64 amu = 64 amu
Khối lượng của phân tử CuO là: MCuO = 16 + 64 = 80 (amu)
Phần trăm khối lượng của Cu trong hợp chất CuO là:
Phần trăm về khối lượng của O trong hợp chất CuO là:
%mO = 100% – %mCu = 100% – 80% = 20%
Biết công thức hóa học và hóa trị của một nguyên tố, xác định được hóa trị của nguyên tố còn lại trong hợp chất
– Cách xác định hóa trị khi biết công thức hóa học và hóa trị của một nguyên tố:
+ Đặt hóa trị của nguyên tố chưa biết là a.
+ Xác định a dựa vào quy tắc hóa trị.
Ví dụ: Xác định hóa trị của Al trong hợp chất có công thực hóa học Al2O3.
Giải:
Gọi hóa trị của Al trong hợp chất là a.
Vì O có hóa trị II nên ta có biểu thức: a × 2 = II × 3 → a = III
Vậy Al có hóa trị III trong hợp chất Al2O3.
3. Xác định công thức hóa học của hợp chất khi biết hóa trị hoặc phần trăm khối lượng của các nguyên tố
a) Biết hóa trị của các nguyên tố, lập công thức hóa học của hợp chất tạo thành từ hai nguyên tố
– Nếu hai nguyên tố A, B có hóa trị tương ứng là a, b thì công thức hóa học của hợp chất tạo thành từ A và B được xác định như sau:
+ Đặt công thức hóa học của hợp chất AxBy.
+ Áp dụng quy tắc hóa trị, xác định tỉ lệ
+ Xác định x, y (x, y thường là những số nguyên tố nhỏ nhất thỏa mãn tỉ lệ trên).
Ví dụ: Lập công thức hóa học của hợp chất được tạo bởi S hóa trị IV và O.
Hướng dẫn giải
+ Đặt công thức của hợp chất là SxOy.
+ Theo quy tắc hóa trị: x × IV = y × II
+ Ta có tỉ lệ:
+ Công thức hóa học của hợp chất là: SO2.
b) Xác định công thức hóa học của hợp chất khi biết phần trăm khối lượng của các nguyên tố và khối lượng phân tử của hợp chất
– Khi biết phần trăm khối lượng của hai nguyên tố A, B tạo nên hợp chất và khối lượng phân tử của chất đó, xác định công thức hóa học theo bước sau:
+ Đặt công thức hóa học của hợp chất AxBy.
+ Tính khối lượng của A, B trong một phân tử chất.
+ Tìm x, y.
Ví dụ: R là hợp chất của Fe và O, khối lượng phân tử của R là 72 amu. Biết phần trăm khối lượng của oxygen trong R là 22,22%. Hãy xác định công thức hóa học của R.
Hướng dẫn giải
+ Đặt công thức hóa học của R là FexOy.
+ Khối lượng của nguyên tố O trong một phân tử R là:
+ Khối lượng của nguyên tố S trong một phân tử R là:
72 – 16 = 56 (amu)
+ Ta có: 16 amu × y = 16 amu ⇒ y = 1
56 amu × x = 56 amu ⇒ x = 1
Vậy công thức hóa học của R là FeO.
Xem thêm các bài trắc nghiệm Khoa học tự nhiên 7 Cánh diều hay, chi tiết khác:
Trắc nghiệm KHTN 7 Bài 5: Giới thiệu về liên kết hóa học
Trắc nghiệm KHTN 7 Bài 6: Hóa trị. Công thức hóa học
Trắc nghiệm KHTN 7 Bài 7: Tốc độ của chuyển động
Trắc nghiệm KHTN 7 Bài 8: Đồ thị quãng đường – thời gian
Trắc nghiệm KHTN 7 Bài 9: Sự truyền âm
Trắc nghiệm KHTN 7 Bài 10: Biên độ, tần số, độ to và độ cao của âm