Giải bài tập Hóa Học lớp 11 Bài 7: Nitơ
Câu hỏi và bài tập (trang 31 sgk Hóa học lớp 11)
Bài 1 trang 31 sgk hóa học 11: Trình bày cấu tạo của phân tử N2. Vì sao ở điều kiện thường, nitơ là một chất trơ ? Ở điều kiện nào nitơ trở nên hoạt động hơn ?
Lời giải
+ Cấu hình electron của nitơ: 1s22s22p3
Công thức cấu tạo của phân tử nitơ:
+ Giữa hai nguyên tử trong phân tử N2 hình thành một liên kết ba bền vững. Mỗi nguyên tử nitơ trong phân tử N2 có 8 electron lớp ngoài cùng, trong đó có ba cặp electron dùng chung và 1 cặp electron dùng riêng đã ghép đôi
Ở điều kiện thường nitơ là chất trơ vì có liên kết ba bền vững giữa hai nguyên tử, liên kết này chỉ bị phân hủy rõ rệt thành nguyên tử ở nhiệt độ 30000C
Ở nhiệt độ cao nitơ trở nên hoạt động vì phân tử N2 phân hủy thành nguyên tử nitơ có 5e lớp ngoài cùng và có độ âm điện tương đối lớn (3,04) nên trở nên hoạt động
Bài 2 trang 31 sgk hóa học 11: Nitơ không duy trì sự hô hấp, nitơ có phải là khí độc không ?
Lời giải
Tuy nitơ không duy trì sự sống nhưng nitơ không phải là khí độc.
Bài 3 trang 31 sgk hóa học 11: a) Cặp công thức của liti nitrua và nhôm nitrua là:
A. LiN3 và Al3N.
B. Li3N và AlN.
C. Li2N3 và Al2N3.
D. Li3N2 và Al3N2.
b) Viết phương trình hóa học của phản ứng tạo thành liti nitrua và nhôm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ. Trong các phản ứng này nitơ là chất oxi hóa hay chất khử ?
Lời giải
a) Đáp án B
Khi liên kết với kim loại nitơ dễ nhận thêm 3e (N có 5e lớp ngoài cùng nên có số oxi hóa -3 còn Li dễ nhường 1e và Al dễ nhường 3e nên lần lượt có số oxi hóa là +1 và +3)
b)
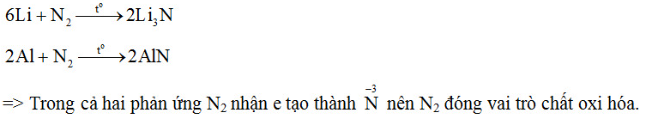
Bài 4 trang 31 sgk hóa học 11: Nguyên tố nitơ có số oxi hóa là bao nhiêu trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O, N2O3, N2O5, Mg3N2 ?
Lời giải
![]()
Vậy số oxi hóa của nitơ trong các hợp chất lần lượt là:
+2; +4; -3; -3; +1; +3; +5; -3.
Bài 5 trang 31 sgk hóa học 11: Cần lấy bao nhiêu lít khí nitơ và khí hiđro để điều chế được 67,2 lít khí amoniac ? Biết rằng thể tích của các khí đều được đo trong cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%.
Lời giải
Ta thấy tỷ lệ về thể tích cùng là tỷ lệ về số mol
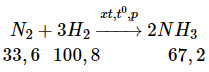
Tỷ lệ số mol cũng chính là tỷ lệ thể tích
Theo phương trình:

Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là
Lý thuyết Nitơ
Trong bảng tuần hoàn nitơ nằm ở ô thứ 7, nhóm VA, chu kì 2.
I. VỊ TRÍ VÀ SỐ OXH
– Trong bảng tuần hoàn nitơ nằm ở ô thứ 7, nhóm VA, chu kì 2.
– Cấu hình electron lớp ngoài cùng là 2s22p3.
– N có các số oxi hóa thường gặp: -3, 0, +1, +2, +3, +4, +5.
– N có số oxi hóa cao nhất là +5, nhưng hóa trị cao nhất chỉ là 4.
II. CẤU TẠO PHÂN TỬ
– Nitơ: N ≡ N.
– Liên kết ba giữa hai nguyên tử nitơ bền nên ở điều kiện thường nitơ tương đối trơ và khó tham gia phản ứng hóa học.
III. TÍNH CHẤT VẬT LÍ
Ở điều kiện thường nitơ là khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở -1960C; rất ít tan trong nước; không duy trì sự sống, sự cháy
IV. TÍNH CHẤT HÓA HỌC
– Nitơ có các số oxi hoá: -3, 0, +1, +2, +3, +4, +5.
– N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử
1. Tính oxi hóa
a) Tác dụng với kim loại:
6Li + N2 → 2Li3N
(Nito tác dụng với Liti ở nhiệt độ thường)
– Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại.
3Mg + N2 → Mg3N2 magie nitrua
b) Tác dụng với hidro:
2. Tính khử
Nito thể hiện tính khử khi tác dụng với chất có độ âm điện lớn hơn:
– Ở nhiệt độ cao (3000oC) Nitơ phản ứng với oxi tạo nitơ monoxit.
N2 + O2 ↔ 2NO (không màu)
– Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
2NO + O2 → 2NO2
V. ĐIỀU CHẾ
– Trong công nghiệp: Chưng cất phân đoạn không khí lỏng.
– Trong phòng thí nghiệm:
NH4NO2 N2 + 2H2O
Hoặc: NH4Cl + NaNO2 N2 + 2H2O + NaCl
VI. ỨNG DỤNG
– Nguyên tố nitơ là thành phần dinh dưỡng chính của thực vật.
– Trong công nghiệp: dùng để tổng hợp NH3, HNO3, phân đạm,…
Sơ đồ tư duy: Nitơ
Phương pháp giải một số dạng bài tập về nitơ
Dạng 1: Bài tập lý thuyết về nitơ
* Một số lưu ý cần nhớ:
– Nito Là chất khí không màu, không mùi ít tan trong nước và không duy trì sự sống, sự cháy
– CTCT có chứa liên kết 3 nên khá trơ về mặt hóa học ở nhiệt độ thường
– Thể hiện tính OXH (khi tác dụng với KL mạnh và Hidro) và khử (khi tác dụng với O2)
* Một số ví dụ điển hình:
Ví dụ 1: Dãy nào dưới đây gồm các chất mà nguyên tố nitơ có khả năng vừa thể hiện tính khử vừa thể hiện tính oxi hóa khi tham gia phản ứng ?
A. NH3, N2O5, N2, NO2
B. N2, NO, N2O, N2O5
C. NH3, NO, HNO3, N2O5
D. NO2, N2, NO, N2O3
Hướng dẫn giải chi tiết:
Nguyên tố N có các số oxi hóa: -3, 0, +1, + 2, +3, +4, +5
Những nguyên tố N mang số oxi hóa trung gian có khả năng vừa thể hiện tính oxi hóa, vừa thể hiện tính khử khi tham gia phản ứng
Trong NH3, Nitơ có số oxi hóa -3, là số oxi hóa thấp nhất nên chỉ thể hiện tính khử.
Trong HNO3 và N2O5, N có số oxi hóa +5, là số oxi hóa cao nhất nên chỉ thể hiện tính oxi hóa.
Đáp án D
Ví dụ 2: Nitơ có nhiều trong khoáng vật diêm tiêu, diêm tiêu có thành phần chính là
A. NaNO2
B. NH4NO3
C. NaNO3
D. NH4NO2
Hướng dẫn giải chi tiết:
Nitơ có nhiều trong khoáng vật diêm tiêu, diêm tiêu có thành phần chính là: NaNO3
Đáp án C
Ví dụ 3: Ở điều kiện thường, nitơ phản ứng được với
A. Mg
B. K
C. Li
D. F2
Hướng dẫn giải chi tiết
Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua.
6Li + N2 → 2Li3N
Đáp án C.
Ví dụ 4: Mệnh đề nào dưới đây đúng?
A. Nitơ không duy trì sự hô hấp vì nitơ là một khí độc.
B. Vì có liên kết ba nên phân tử nitơ rất bền, ở nhiệt độ thường khá trơ về mặt hóa học.\
C. Khi tác dụng với kim loại hoạt động, nitơ thể hiện tính khử.
D. Số oxi hóa của nitơ trong các hợp chất và ion AlN, N2O4, NH4+, NO3–, NO2– lần lượt là: -3; -4; -3; +5; +3.
Hướng dẫn giải chi tiết:
A sai, nitơ không duy trì sự hô hấp vì nitơ là khí trơ, không phải là khí độc.
B đúng
C sai vì trong phản ứng của nitơ với kim loại thì nitơ thể hiện tính oxi hóa, kim loại thể hiện tính khử
D sai vì trong N2O4 nguyên tử N có số oxi hóa +4
![]()
Đáp án B
Dạng 2: Bài toán về phản ứng tổng hợp và phân hủy NH3
* Một số lưu ý cần nhớ:
Ta có phương trình phản ứng:
N2 (k) + 3H2 (k) 2NH3 (k)
Hằng số cân bằng của phản ứng thuận là:

Để làm được loại bài toán này, em cần khảo sát phương trình phản ứng qua các giai đoạn: đề bài, phản ứng, sau phản ứng. Dựa vào đặc điểm dữ kiện đề bài cho để tìm ra đáp số cho bài toán.* Một số ví dụ điển hình:
Ví dụ 1: Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
A. 10 atm.
B. 8 atm.
C. 9 atm.
D. 8,5 atm.
Hướng dẫn giải chi tiết:
Ta có phương trình phản ứng:
N2 + 3H2 2NH3 (1)
bđ: 10 10 0 : lít
pư: 2 6 4 : lít
spư: 8 4 4 : lít
=> Tổng thể tích hỗn hợp khí sau phản ứng là: 8 + 4 + 4 = 16 (lít)
Theo đề bài, trước và sau phản ứng, nhiệt độ đều không đổi
=> Ta có:
Đáp án B
Ví dụ 2: Sau quá trình tổng hợp NH3 từ H2 và N2, áp suất trong bình giảm đi 10% so với áp suất lúc đầu. Biết nhiệt độ của phản ứng giữ không đổi trước và sau phản ứng. Phần trăm theo thể tích của N2, H2, NH3 trong hỗn hợp khí thu được sau phản ứng lần lượt là :
A. 25% ; 25% ; 50%.
B. 30% ; 25% ; 45%.
C. 22,22% ; 66,67% ; 11,11%.
D. 20% ; 40% ; 40% .
Hướng dẫn giải chi tiết:
Trong một bình kín có nhiệt độ không đổi thì áp suất tỉ lệ thuận với số mol hỗn hợp khí :
nhỗn hợp khí sau phản ứng = =
Ta có phương trình phản ứng:
N2 + 3H2 2NH3 (1)
bđ: 1 3 0 : mol
pư: x 3x 2x : mol
spư: 1–x 3–3x 2x : mol
Theo (1) ta thấy :
nhỗn hợp khí sau phản ứng = (1–x) + (3–3x) + 2x = 4 – 2x = 3,6 x = 0,2
% V NH3 = 11,11%
Đáp án C
Ví dụ 3: Từ 10 m3 hỗn hợp N2 và H2 lấy theo tỉ lệ 1:3 về thể tích, biết hiệu suất phản ứng tổng hợp thực tế là 95%. Có thể sản xuất được lượng amoniac là
A. 5 m3
B. 4,25 m3
C. 4,75 m3
D. 7,5 m3
Hướng dẫn giải chi tiết:
Ta có V N2 : V H2 = 1 : 3
V N2 + V H2 = 10 m3
=> V N2 = 2,5 m3 ; V H2 = 7,5 m3
Ta có phương trình phản ứng:
N2 + 3H2 2NH3 (1)
(1) V NH3 lý thuyết = 2 . n N2 = 2 . 2,5 = 5 m3
Theo đề bài, hiệu suất của phản ứng là 95%.
=> V NH3 thực tế thu được sau phản ứng là:
5 . 95% = 4,75 m3
Đáp án C