Giải SBT Hóa học 11 Bài 39: Dẫn xuất halogen của hidrocacbon
Bài 39.1 trang 61 SBT Hóa học 11: Chất nào sau đây là dẫn xuất halogen của hiđrocacbon ?
A. Cl-CH2-COOH
B. C6H5-CH2-Cl
C. CH3-CH2-Mg-Br
Lời giải:
Dẫn xuất halogen của hiđrocacbon là C6H5-CH2-Cl
Chọn B.
Bài 39.2 trang 61 SBT Hóa học 11: Chất nào sau đây không phải là dẫn xuất halogen của hiđrocacbon ?
A. CH2=CH-CH2Br
B. ClBrCH-CF3
C. Cl2CH-CF2-O-CH3
D. C6H6Cl6
Lời giải:
Chất không phải là dẫn xuất halogen của hiđrocacbon là Cl2CH-CF2-O-CH3
Chọn C.
Bài 39.3 trang 61 SBT Hóa học 11: Benzyl bromua có công thức cấu tạo nào trong số các công thức dưới đây ?

Lời giải:
Công thức của Benzyl bromua là:
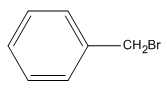
Chọn D.
Bài 39.4 trang 61 SBT Hóa học 11: Viết phương trình hoá học thực hiện các biến hoá dưới đây, nêu rõ điều kiện của phản ứng và ghi tên các chất.

(Mỗi mũi tên là một phương trình phản ứng
Phương pháp giải:
Học sinh hệ thống hóa các loại hiđrocacbon quan trọng: ankan, anken, ankađien, ankin và dẫn xuất halogen về tính chất hóa học của chúng để viết PTHH.
Lời giải:

Bài 39.5 trang 61 SBT Hóa học 11: Viết phương trình hoá học của các phản ứng thực hiện các biến hoá dưới đây :
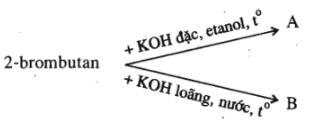
Ở đây A và B là các sản phẩm chính của phản ứng. Hãy viết các chất hữu cơ dưới dạng công thức cấu tạo.
Lời giải:
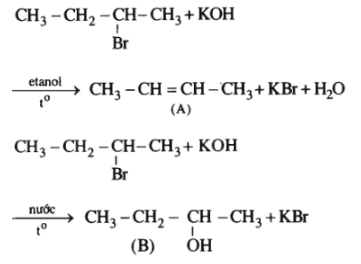
Bài 39.6 trang 61 SBT Hóa học 11: Đốt cháy hoàn toàn 3,96 g chất hữu cơ A, thu được 1,792 lít CO2 (đktc) và 1,440 g H2O. Nếu chuyển hết lượng clo có trong 2,475 g chất A thành AgCl thì thu được 7,175 g AgCl.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A biết rằng tỉ khối hơi của A đối với etan là 3,3.
3. Viết các công thức cấu tạo mà A có thể có và ghi tên từng chất theo hai cách đọc tên khác nhau.
Phương pháp giải:
1. +) Tìm mC, mH, mCl, mO(nếu có) từ đó xác định thành phần các nguyên tố trong A
+) Tìm tỉ lệ các nguyên tố trong A CTĐGN của A.
2. Tìm khối lượng phân tử A dựa vào tỉ khối hơi CTPT cần tìm của A.
3. Viết CTCT và gọi tên A.
Lời giải:
1. Khi đốt cháy A ta thu được CO2 và H2O; vậy A phải chứa C và H.
Khối lượng C trong 1,792 lít CO2 là : = 0,96 (g).
Khối lượng H trong 1,44 g H2O : = 0,16 (g).
Đó cũng là khối lượng C và H trong 3,96 g A.
Theo đầu bài A phải chứa Cl. Khối lượng Cl trong 7,175 g AgCl :
Đó cũng là khối lượng Cl trong 2,475 g A.
Vậy, khối lượng Cl trong 3,96 g A : = 2,840 (g).
Khối lượng C, H và Cl đúng bằng khối lượng chất A (3,96 g).
Vậy, chất A có dạng CxHyClz.
x : y : z = = 0,08 : 0,16 : 0,08 = 1 : 2 : 1
CTĐGN của A là CH2Cl.
2. MA = 3,3.30 = 99 (g/mol)
= 99 49,5n = 99 n = 2
CTPT của A là C2H4Cl2.
3. Các CTCT
