Khoa học tự nhiên 8 Bài 4: Dung dịch và nồng độ
A. Lý thuyết KHTN 8 Bài 4: Dung dịch và nồng độ
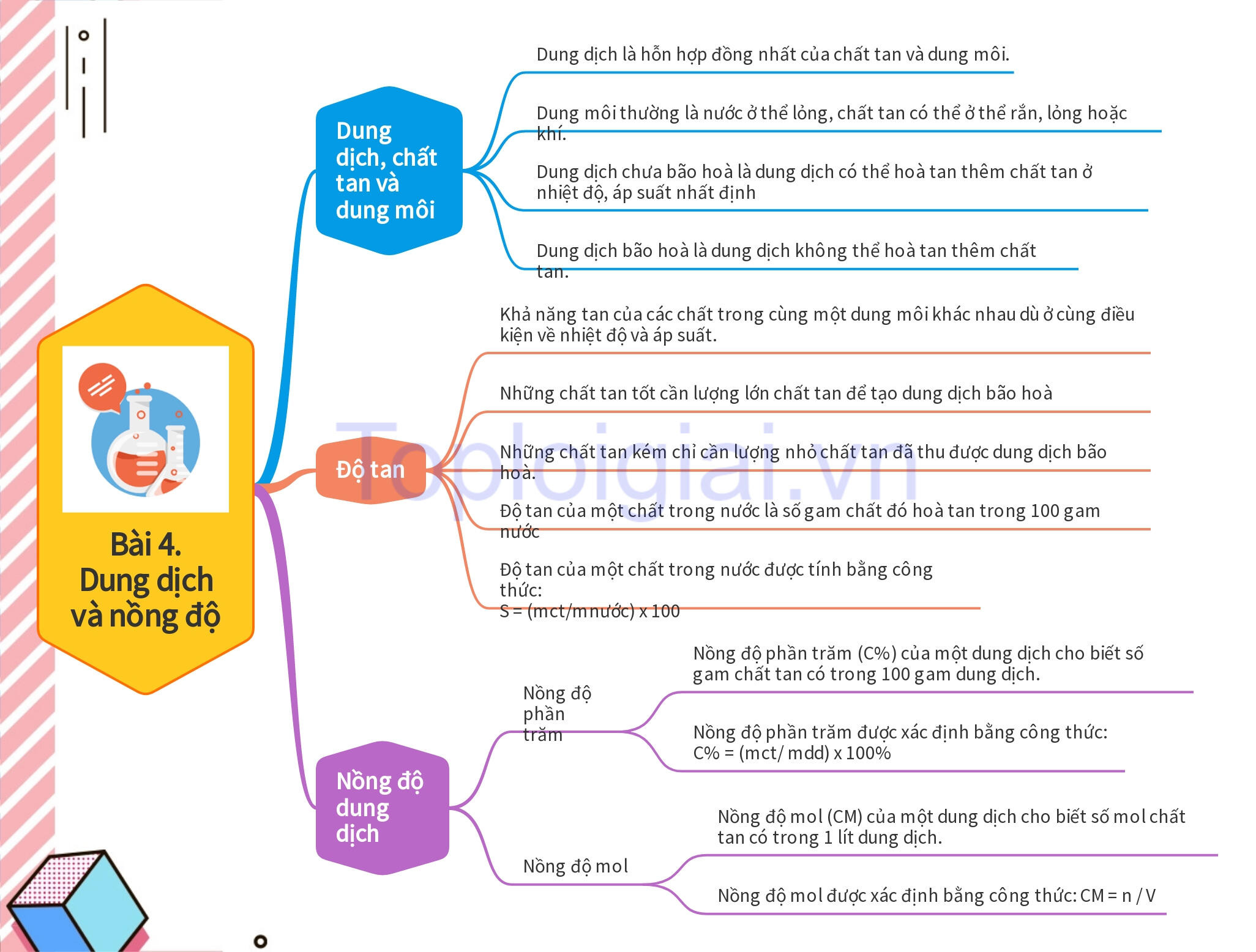
I. Dung dịch, chất tan và dung môi
– Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi.
– Dung môi thường là nước ở thể lỏng, chất tan có thể ở thể rắn, lỏng hoặc khí.
– Dung dịch chưa bão hoà là dung dịch có thể hoà tan thêm chất tan ở nhiệt độ, áp suất nhất định, còn dung dịch bão hoà là dung dịch không thể hoà tan thêm chất tan.

II. Độ tan
– Khả năng tan của các chất trong cùng một dung môi khác nhau dù ở cùng điều kiện về nhiệt độ và áp suất.
– Những chất tan tốt cần lượng lớn chất tan để tạo dung dịch bão hoà, còn những chất tan kém chỉ cần lượng nhỏ chất tan đã thu được dung dịch bão hoà.
– Độ tan của một chất trong nước là số gam chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở nhiệt độ, áp suất xác định.
– Độ tan của một chất trong nước được tính bằng công thức: S = (mct/mnước) x 100, trong đó S là độ tan, đơn vị g/100 g nước; mct là khối lượng chất tan, đơn vị là gam (g); mnước là khối lượng nước, đơn vị là gam (g).
III. Nồng độ dung dịch
– Nồng độ dung dịch là đại lượng được sử dụng để định lượng một dung dịch đặc hay loãng. Có hai loại nồng độ dung dịch thường dùng là nồng độ phần trăm và nồng độ mol.
– Nồng độ phần trăm:
Nồng độ phần trăm (C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch. Nồng độ phần trăm được xác định bằng công thức:
C% = (mct/ mdd) x 100%
Trong đó: C% là nồng độ phần trăm của dung dịch, đơn vị %; mct là khối lượng chất tan, đơn vị là gam (g); mdd là khối lượng dung dịch, đơn vị là gam (g).
– Nồng độ mol:
Nồng độ mol (CM) của một dung dịch cho biết số mol chất tan có trong 1 lít dung dịch. Nồng độ mol được xác định bằng công thức:
CM = n / V
Trong đó: CM là nồng độ mol của dung dịch, có đơn vị là mol/l và thường được biểu diễn là M; n là số mol chất tan, đơn vị là mol; V là thể tích dung dịch, đơn vị là lít (L).
Sơ đồ tư duy KHTN 8 Bài 4: Dung dịch và nồng độ
B. Bài tập trắc nghiệm KHTN 8 Bài 4: Dung dịch và nồng độ
Đang cập nhật.