Giải bài tập Hóa Học lớp 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Câu hỏi và bài tập (trang 20 sgk Hóa học lớp 11)
Bài 1 trang 20 sgk Hóa học 11: Điều kiện để xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li là gì ? Lấy các thí dụ minh hoạ.
Lời giải
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi có ít nhất một trong các điều kiện sau:
- Tao thành chất kết tủa
Ví dụ: AgNO3 + NaCl → AgCl↓+ NaNO3
- Tạo thành chất điện li yếu
Ví dụ: CH3COONa + HCl → CH3COOH + NaCl
- Tạo thành chất khí
Ví dụ: Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Bài 2 trang 20 sgk Hóa học 11: Tại sao các phản ứng giữa dung dịch axit và hiđroxit có tính bazơ và phản ứng giữa muối cacbonat và dung dịch axit rất dễ xảy ra ?
Lời giải
Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ rất dễ xảy ra vì có sự tạo thành chất điện li rất yếu là H2O
Ví dụ: Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Phản ứng giữa muối cacbonat và dung dịch axit dễ xảy ra vì có sự tạo thành chất khí là CO2
Ví dụ: Na2CO3 + 2HCl → 2NaCl + CO2 ↑+ H2O
Bài 3 trang 20 sgk Hóa học 11: Lấy một số thí dụ chứng minh rằng : bản chất của phản ứng trong dung dịch các chất điện li là phản ứng giữa các ion.
Lời giải
Thí dụ 1: AgNO3 + NaCl AgCl + NaNO3
AgNO3, NaCl, NaNO3 là những chất điện ly mạnh trong dung dịch, chúng phân ly thành các ion. Ta có phương trình ion:
Vậy thực chất trong dung dịch chỉ có phản ứng của
Còn các ion và Na+ vẫn tồn tại trong dung dịch trước và sau phản ứng
Thí dụ 2: Na2SO3 + 2HCl 2NaCl + SO2 + H2O
Na2SO3, HCl và NaCl là những chất điện ly mạnh trong dung dịch, chúng phân ly thành các ion. Ta có phương trình ion:
Vậy thực chất trong dung dịch chỉ có phản ứng của 2H+ và còn các ion Na+ và Cl– vẫn tồn tại trong dung dịch trước và sau phản ứng. Thực chất các phản ứng trong dung dịch điện ly là phản ứng giữa các ion vì các chất điện ly đã phân ly thành các ion
Bài 4 trang 20 sgk Hóa học 11: Phương trình ion rút gọn của phản ứng cho biết :
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Lời giải
Vì chỉ rõ các ion nào đã tác dụng với nhau làm cho phản ứng xảy ra.
Đáp án C
Bài 5 trang 20 sgk Hóa học 11: Viết các phương trình phân tử và ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch giữa các cặp chất sau :
a) Fe2(SO4)3 + NaOH
b) NH4Cl + AgNO3
c) NaF + HCl
d) MgCl2 + KNO3
e) FeS (r) + HCl
g) HClO + KOH
Lời giải
Phương trình phân tử và ion xảy ra trong dung dịch :
a) Fe2(SO4)3 + 6NaOH → 2Fe(OH)3↓ + 3Na2SO4
Fe3+ + 3OH– → Fe(OH)3↓
b) NH4Cl + AgNO3 → NH4NO3 + AgCl↓
Cl– + Ag+ → AgCl↓
c) NaF + HCl → NaCl + HF↑
F– + H+ → HF↑
d) Không có phản ứng xảy ra
e) FeS(r) + 2HCl → FeCl2 + H2S ↑
FeS(r) + 2H+ → Fe2+ + H2S↑
g) HClO + KOH → KClO + H2O
HClO + OH– → CIO– + H2O
Bài 6 trang 20 sgk Hóa học 11: Phản ứng nào dưới đây xảy ra trong dung dịch tạo được kết tủa Fe(OH)3 ?
A. FeSO4 + KMnO4 + H2SO4
B. Fe2(SO4)3 + KI
C. Fe(NO3)3 + Fe
D. Fe(NO3)3 + KOH
Lời giải
Phản ứng giữa Fe(NO3)3 và KOH tạo được kết tủa Fe(OH)3.
Đáp án D
Bài 7 trang 20 sgk Hóa học 11: Lấy thí dụ và viết các phương trình hoá học dưới dạng phân tử và ion rút gọn cho các phản ứng sau :
a) Tạo thành chất kết tủa.
b) Tạo thành chất điện li yếu.
c) Tạo thành chất khí.
Lời giải
a. Tạo thành chất kết tủa:
1. AgNO3 + HCl AgCl + HNO3
Ag+ + Cl– AgCl
2. K2SO4 + Ba(OH)2 BaSO4 + 2KOH
3. Na2CO3 + MgCl2 MgCO3 + 2NaCl
b. Tạo thành chất điện li yếu
1. 2CH3COONa + H2SO4 Na2SO4 + 2CH3COOH
CH3COO– + H+ CH3COOH
2. NaOH + HNO3 NaNO3 + H2O
H+ + OH– H2O
3. NaF + HCl NaCl + HF
H+ + F– HF
c. Tạo thành chất khí
1. FeS + 2HCl FeCl2 + H2S
FeS + 2H+ Fe2+ + H2S
2. K2SO3 + 2HCl 2KCl + H2O + SO2
3. NaOH + NH4Cl NaCl + NH3 + H2O
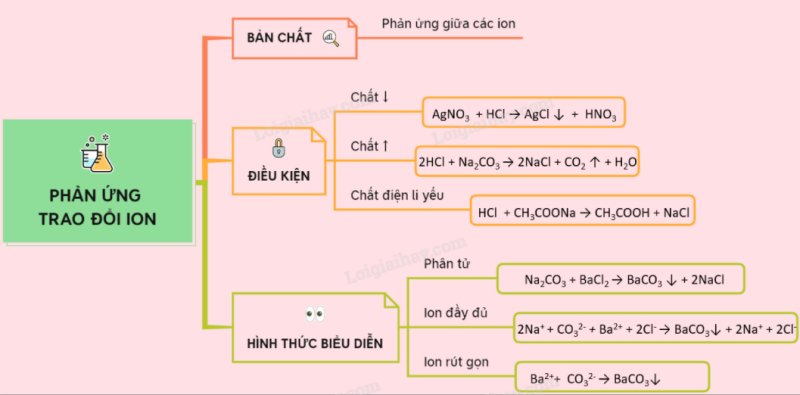
Lý thuyết phản ứng trao đổi ion trong dung dịch các chất điện li.
Bản chất của phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
1. Bản chất
– Bản chất của phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
2. Điều kiện xảy ra phản ứng trao đổi
– Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li là trong sản phẩm phản ứng phải có ít nhất một trong các điều kiện tạo thành:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
VD: Trường hợp tạo kết tủa:
AgNO3 + HCl → AgCl + HNO3
VD : Trường hợp tạo chất khí :
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
VD : Trường hợp tạo chất điện li yếu :
HCl + CH3COONa → CH3COOH + NaCl
3. Các hình thức biểu diễn phản ứng trao đổi ion.
– Phương trình phân tử :
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
– Phương trình ion:
(Các chất điện li mạnh viết dạng ion, các chất điện li yếu, kết tủa viết dạng phân tử) :
2Na+ + CO32- + Ba2+ + 2Cl– → BaCO3 + 2Na+ + 2Cl–
– Phương trình ion thu gọn (bỏ các ion giống nhau ớ hai vế):
Ba2++ CO32- → BaCO3↓
Sơ đồ tư duy: Phản ứng trao đổi ion trong dung dịch các chất điện li.
Phương pháp giải một số dạng bài tập về phản ứng trao đổi ion trong dung dịch
Dạng 1: Lý thuyết về phản ứng trao đổi ion trong dung dịch
* Một số lưu ý cần nhớ:
– Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion
– Phản ứng trao đổi ion trong dung dịch chất điện li chỉ xảy ra khi các ion kết hợp với nhau tạo thành ít nhất một trong các chất sau: Chất kết tủa, chất khí hay chất điện li yếu
– Một số đặc điểm về phản ứng thủy phân muối:
+ Muối của kim loại mạnh và gốc axit mạnh là muối có môi trường trung tính (pH = 7)
VD: NaCl, BaCl2, K2SO4…
+ Muối của kim loại mạnh và gốc axit yếu là muối có môi trường bazo (pH > 7)
VD: Na2CO3,K2S, CH3COONa…
+ Muối của kim loại yếu và gốc axit mạnh là muối có môi trường axit (pH < 7)
VD: NH4Cl , ZnCl2, Al2(SO4)3…
* Một số ví dụ điển hình:
Ví dụ 1: Cho phản ứng NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
A. 2KOH + FeCl2 → Fe(OH)2 + 2KCl.
B. NaOH + NH4Cl → NaCl + NH3 + H2O.
C. KOH + HNO3 → KNO3 + H2O.
D. NaOH + NaHCO3 → Na2CO3 + H2O.
Hướng dẫn giải chi tiết:
Phương trình ion rút gọn của phản ứng NaOH + HCl → NaCl + H2O là:
OH– + H+ → H2O
A. 2OH– + Fe2+ → Fe(OH)2
B. OH– + NH4+ → NH3 + H2O
C. OH– + H+ → H2O
D. OH– + HCO3– → CO32- + H2O
Đáp án C.
Ví dụ 2: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
A. các chất phản ứng phải là chất điện li mạnh.
B. một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
C. các chất phản ứng phải là những chất dễ tan.
D. phản ứng phải là thuận nghịch.
Hướng dẫn giải chi tiết:
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
Đáp án B.
Ví dụ 3: Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và CuSO4.
B. NH3 và AgNO3.
C. Na2ZnO2 và HCl.
D. NaHSO4 và NaHCO3.
Hướng dẫn giải chi tiết:
B. AgNO3 + H2O + 3NH3 → NH4NO3 + (Ag(NH3)2)OH
C. Na2ZnO2 + 2HCl → 2NaCl + Zn(OH)2
Nếu HCl dư : Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
D. NaHCO3 + NaHSO4 → H2O + Na2SO4 + CO2
Đáp án A
Ví dụ 4: Cặp chất nào sau đây không thể tồn tại trong một dung dịch?
A. NaClO và AlCl3.
B. NaOH và KCl.
C. KNO3 và HCl.
D. Ba(OH)2 và AlCl3.
Hướng dẫn giải chi tiết:
Ba(OH)2 và AlCl3 không thể cùng tồn tại trong một dung dịch vì chúng phản ứng với nhau:
3Ba(OH)2 + 2AlCl3 → 3BaCl2 + 2Al(OH)3↓
Đáp án D
Ví dụ 5: Cho các phản ứng hoá học sau:
(1) (NH4)2SO4 + BaCl2
(2) CuSO4 + Ba(NO3)2
(3) Na2SO4 + BaCl2
(4) H2SO4 + BaSO3
(5) (NH4)2SO4 + Ba(OH)2
(6) Fe2(SO4)3 + Ba(NO3)2
Các phản ứng đều có cùng phương trình ion rút gọn là
A. (1), (2), (3), (6).
B. (1), (3), (5), (6).
C. (2), (3), (4), (6).
D. (3), (4), (5), (6).
Hướng dẫn giải chi tiết:
(1) SO42- + Ba2+ → BaSO4
(2) SO42- + Ba2+ → BaSO4
(3) SO42- + Ba2+ → BaSO4
(4) 2H+ + SO42- + BaSO3 → BaSO4 + SO2 + H2O
(5) 2NH4+ + SO42- + Ba2+ + OH– → BaSO4 + NH3 + H2O
(6) SO42- + Ba2+ → BaSO4
=> Các phản ứng có cùng phương trình ion rút gọn là: (1), (2), (3), (6).
Đáp án A
Dạng 2: Bài toán về bảo toàn điện tích để tính lượng chất có trong dung dịch
* Một số lưu ý cần nhớ:
– Nội dung định luật bảo toàn điện tích: Trong một dung dịch, tổng giá trị điện tích âm bằng tổng giá trị điện tích dương
=> Tổng số mol ion dương . giá trị điện tích dương = Tổng số mol ion âm . giá trị điện tích âm.
VD: Xét dung dịch có chứa 0,1 mol MgCl2
Xét 0,1 mol MgCl2 có chứa 0,1 mol Mg2+ và 0,2 mol Cl– thỏa mãn định luật bảo toàn điện tích.
Ta có: n Mg2+ . giá trị điện tích ion Mg2+ = 0,1 . 2
n Cl– . giá trị điện tích ion Cl– = 0,2 . 1
=> n Mg2+ . giá trị điện tích ion Mg2+ = n Cl– . giá trị điện tích ion Cl–
* Một số ví dụ điển hình:
Ví dụ 1: Một cốc nước có chứa a mol Ca2+, b mol Mg2+, c mol Cl–, d mol HCO3–. Hệ thức liên hệ giữa a, b, c, d là :
A. 2a+2b=c-d.
B. a+b=c+d.
C. 2a+2b=c+d.
D. a+b=2c+2d.
Hướng dẫn giải chi tiết:
Áp dụng định luật bảo toàn điện tích ta có:
Đáp án C.
Ví dụ 2: Một dung dịch chứa 0,02 mol Cu2+, 0,03 mol K+, x mol Cl– và y mol SO42–. Tổng khối lượng các muối tan có trong dung dịch là 5,435 gam. Giá trị của x và y lần lượt là :
A. 0,01 và 0,03.
B. 0,02 và 0,05.
C. 0,05 và 0,01.
D. 0,03 và 0,02.
Hướng dẫn giải chi tiết:
Áp dụng định luật bảo toàn điện tích, tổng giá trị điện tích âm bằng tổng giá trị điện tích dương
=> 0,02 . 2 + 0,03 . 1 = x .1 + y . 2 (I)
Áp dụng định luật bảo toàn khối lượng ta có:
m Cu + m K + m Cl + m SO4 = 5,435
=> 0,02 . 64 + 0,03 . 39 ++ 35,5x + 96y = 5,435 (II)
Từ (I) và (II) => x = 0,03; y = 0,02
Đáp án D
Ví dụ 3: Cho 22,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thì thu được bao nhiêu gam muối clorua khan?
Hướng dẫn giải chi tiết:
– Muối thu được chứa: Na+; K+; Cl−
Dạng 3: Sử dụng phương trình ion rút gọn để tính toán lượng chất trong dung dịch
* Một số lưu ý cần nhớ:
Để làm được loại bài tập này, các em chỉ cần viết phương trình ion rút gọn
=> Từ phương trình ion, áp dụng thêm định luật bảo toàn điện tích, bảo toàn nguyên tố, …..
=> lượng các ion theo yêu cầu của đề bài
* Một số ví dụ điển hình:
Ví dụ 1: Trộn 250 ml dung dịch chứa hỗn hợp HCl 0,08M và H2SO4 0,01M với 250 ml dung dịch NaOH aM thu được 500 ml dung dịch có pH = 12. Giá trị a là :
A. 0,13M.
B. 0,12M.
C. 0,14M.
D. 0.10M.
Hướng dẫn giải chi tiết:
Tổng số mol ion H+ trong dung dịch axit là :
Tổng số mol ion OH– trong dung dịch bazơ là :
Dung dịch sau phản ứng có pH = 12, suy ra có pOH = 2, suy ra dung dịch sau phản ứng còn bazơ dư, [OH– dư] = 10-2M = 0,01M.
Phương trình phản ứng :
(1)
mol: 0,025 → 0,025
Theo (1) và giả thiết ta thấy sau phản ứng số mol OH– dư là (0,25a – 0,025) mol.
Nồng độ OH– dư là :
Ví dụ 2: Dung dịch X chứa các ion: Fe3+ ; SO42 ; NH4+; Cl−. Chia dung dịch thành 2 phần bằng nhau:
– Phần 1: Cho tác dụng với lượng dư dung dịch NaOH , đun nóng thu được 0,672 lít khí ở đktc và 1,07 gam kết tủa.
– Phần 2: Tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa.
Tổng khối lượng các muối khan thu được khi cô cạn dung dịch X là (quá trình cô cạn chỉ có nước bay hơi)
Hướng dẫn giải chi tiết:
– Phần 1: nNH3 = 0,03 mol; nFe(OH)3 = 0,01 mol => nFe3+ = 0,01 mol
NH4+ + OH– → NH3 + H2O
nNH4+ = nNH3 = 0,03 mol
Phần 2: nBaSO4 = 0,02 mol => nSO4 = 0,02 mol
– Bảo toàn điện tích:
=> 3.0,01 + 1.0,03 = 2.0,02 + nCl- => nCl- = 0,02 mol
– Bảo toàn khối lượng (trong 1 phần)
=> cô cạn dung dịch X thu được:
mmuối = 2.3,73 = 7,46 gam
Ví dụ 3: Trộn dung dịch chứa Ba2+ ; OH− 0,06 mol và Na+ 0,02 mol với dung dịch HCO3− 0,04 mol; CO32− 0,03 mol và Na+. Khối lượng kết tủa thu được sau khi trộn là:
Hướng dẫn giải chi tiết:
–
=> => > nBa2+